
 English
English
 French
French
BPCO: définition, prévalence, étiologie et évaluation médico-économique
COPD: definition, prevalence, etiology and medical-economic evaluation
K. Atsou1,2, I. Annesi-Maesano1,2, C. Chouaid1,2,3
1: Epidemiology of Allergic and Respiratory Diseases Department. INSERM UMR-S 707 27 rue Chaligny, 75012, Paris, France
2: Université Pierre et Marie Curie, Paris 6 - UMR S 707: EPAR. Paris F-75012, France
3: Service de Pneumologie. Hôpital Saint-Antoine. Paris F-75012, France
Corresponding author
Dr Kokuvi ATSOU
EPAR UMR S 707. INSERM & UPMC Paris Univ 06
Medical School Pierre et Marie Curie Site Saint-Antoine
27, rue Chaligny 75571 Paris CEDEX 12
E-mail: atsou@u707.jussieu.fr
ABSTRACT
Chronic obstructive pulmonary disease (COPD) is a major cause of morbidity and death in the world. And this trend will increase in the coming years with the aging of the population. To learn more about the disease and raise awareness of the current and future burden of this disaster, the COPD, especially for the developing countries, which have limited resources a priori, it is important to know the epidemiological situation and the risk factors of this condition.
Epidemiological data on COPD when available show that the prevalence of the disease varies from one population to another, suggesting a difference in exposure to risk factors and/or predispositions, a population another. This article reviews the epidemiology and risk factors for COPD in the world as well as the costs associated with COPD.
Understanding of the pathophysiology of COPD and collecting the logical data of COPD have been progressed in recent decades. Epidemiological data on COPD are still not available for most developing countries. However, efforts are underway to collect these data. These efforts should be encouraged to develop an understanding of COPD, which takes into account the patient population in its geographical and cultural environment to better target actions to prevent and improve COPD management.
KEYWORDS: COPD, epidemiology, physiopathology, diagnosis, treatment
RÉSUMÉ
La bronchopneumopathie chronique obstructive (BPCO) est l’une des principales causes de morbidité et de décès dans le monde. Et cette tendance va augmenter dans les prochaines années avec le vieillissement de la population. Pour mieux connaître la maladie et faire prendre conscience du poids actuel et à venir de cette catastrophe qu’est la BPCO particulièrement pour les pays de développement, qui ont à priori des moyens limités, il importe de bien connaitre la situation épidémiologique et les facteurs de risque de cette affection.
Les données épidémiologiques de la BPCO lorsqu’elles sont disponibles montrent que la prévalence de cette affection varie d’une population à une autre, suggérant une différence dans l’exposition aux facteurs de risque et/ou dans les prédispositions, d’une population à une autre. Cet article passe en revue de la situation épidémiologique et les facteurs de risque de la BPCO dans le monde ainsi que les coûts associés à la BPCO.
La compréhension de la physiopathologie de la BPCO et le recueil des données épidémiologiques de la BPCO ont évolué depuis ces dernières décennies. Les données épidémiologiques de la BPCO ne sont toujours pas disponibles pour la plupart des pays en développement. Toutefois, des efforts sont en cours pour recueillir ces données. Ces efforts doivent être encourager afin de développer une connaissance de la BPCO qui tienne compte de la population de malades dans son environnement géographique et culturel pour mieux cibler les actions à entreprendre pour prévenir et améliorer la prise en charge.
MOTS CLES: BPCO, epidémiologie, physiopathologie, diagnostic, traitement
INTRODUCTION
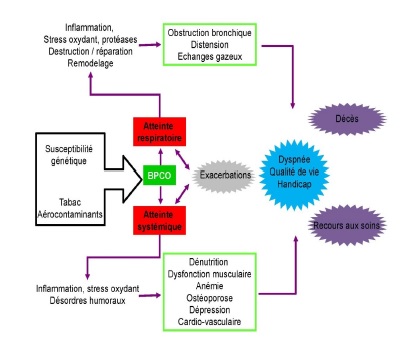
Anciennement associée au symptôme de “catarrhe” (inflammation des muqueuses des voies respiratoires accompagnée d’une sécrétion des glandes lors d’un rhume, grippe ou infections à rhinovirus), la BPCO est une pathologie respiratoire obstructive d’apparition progressive. Selon les estimations de l'OMS en 2005, 80 millions de personnes avaient une BPCO modérée à sévère et plus de 3 millions de personnes en sont mortes, soit 5% de décès toutes causes dans le monde [1]. C’est la seule cause de mortalité en constante augmentation, ces dernières décennies et neuf à dix pourcent des adultes de plus de 40 ans en seraient atteints dans le monde [2]. De plus, la population potentiellement à risque était initialement associée à des fumeurs de plus de 40 ans, mais elle pourrait s’étendre aux personnes de moins de 40 ans [3]. La BPCO est sous estimée, sous diagnostiquée et sous traitée. Elle a un effet majeur sur l'état de santé et les patients atteints de BPCO présentent généralement de comorbidités associées (dépression, de maladies cardiovasculaires, de la déperdition de la masse musculaire et des infections) [4], qui contribuent à une morbidité et mortalité importante.
En raison de la forte prévalence et de son potentiel invalidant, la BPCO constitue un lourd fardeau économique et social. Sa prise en charge est multifactorielle, le coût direct annuel de prise en charge varie de 522 à 3196 $ par patient, en Europe [5].
Les données provenant des pays en développement sont rares. Toutefois, il a été montré que la consommation de cigarettes ; principal facteur de risque de la BPCO, augmente dans la plupart des pays en développement, mais diminue dans la plupart des pays industrialisés (Amériques, Europe) (http://whqlibdoc.who.int/ publications/2011/9789240687813_eng.pdf).
La pollution de l'air intérieur due à la combustion de la biomasse, des combustibles traditionnels et le charbon, l'infection tuberculeuse antérieure, la pollution de l'air extérieur et les infections respiratoires de la petite enfance sont autant de risques supplémentaires de la BPCO dans les pays en développement. En Asie du sud-est et dans le pacifique-ouest, le poids de la BPCO, en termes de nombre de décès, d’année de vie perdue et d’année de vie passée avec un handicap est plus important que dans les pays industrialisés [6]. Cette mobi-mortalité de la BPCO devrait augmenter dans les prochaines décennies. Et comme dans les pays industrialisés, cette augmentation de prévalence et d’handicap due à la BPCO, devrait s’accompagner d’un poids économique important et de la plupart des comorbidités liées au tabac [7]. Le poids croissant de la BPCO appelle à éveiller les différents acteurs intervenant dans la prise de décision de santé afin d’améliorer la prise en charge. Le recueil et l'analyse des données l'épidémiologie de la BPCO contribue à cette action.
DEFINITION
La BPCO est définie comme une “maladie évitable et traitable, caractérisée par une obstruction ventilatoire non complètement réversible, souvent progressive et associée à une réponse inflammatoire anormale des bronches à des particules ou gaz nocifs” [8]. Cette définition de la BPCO fondée sur la mesure de l’obstruction bronchique est dite fonctionnelle. La diminution et la susceptibilité à cette diminution peuvent être différentes d’un individu à un autre et renvoie à différents phénotypes de la BPCO. Cliniquement, la BPCO est définie à partir de résultats d’exploration fonctionnelle et/ou la présence de symptômes de toux et expectoration quotidienne, pendant trois mois et au moins deux années consécutives.
Dans les études épidémiologiques, la BPCO après avoir été initialement déterminée à l’aide des symptômes de bronchite et dyspnée est désormais définie à partir des données d’exploration fonctionnelle (Encadré 1), notamment le rapport du volume expiratoire maximum second (VEMS) sur la capacité vitale (CV), plus rarement le limite inférieure de la normale (LLN). Le VEMS est le volume maximal d’air expiré pendant la première seconde d’une expiration forcée ou lente et la capacité vitale correspond au volume mobiliser au cours d’une expiration en partant de la position d’inspiration complète. Cependant, les recommandations ERSATS doivent être utilisées et donc le résultat exprimé en termes de limite inférieure de la normale (LLN) à partir d’équations de référence en fonction de l’âge, appropriées à la population concernée [9]. Ce, afin de pouvoir prendre en compte la variabilité biologique des sujets et l’effet très significatif de l’âge sur la valeur de référence de ces rapports, en particulier chez les moins de 30 ans et les plus de 50 ans.
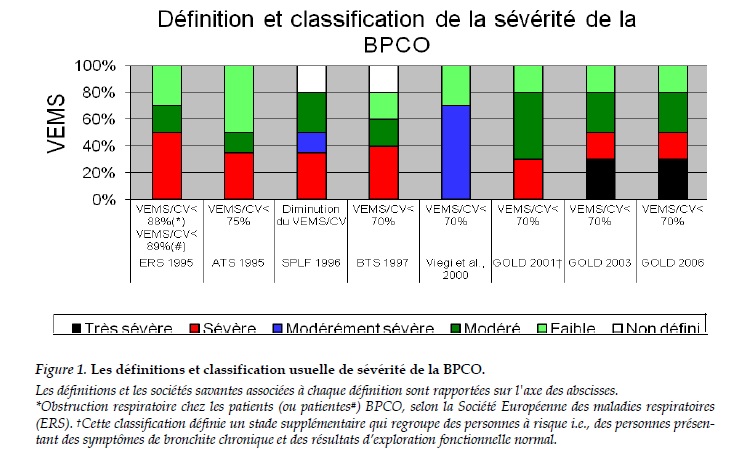
La valeur du rapport VEMS/CV en dessous de laquelle une personne est considérée comme BPCO diffère selon les définitions de BPCO (Figure 1) élaborées par les sociétés savantes compétentes telles que l’“American Thoracic Society (ATS)” [10], la “British Thoracic Society (BTS)” [11], l’ “European Respiratory Society (ERS)” [12], la “Global initiative for chronic Obstructive Lung Disease (GOLD)” [8], la “Société de Pneumologie de langue française (SPLF)” [13]. La valeur du VEMS/CV <70% semble se dégager comme le standard et a été consigné dans

les nouveaux critères de définition et de classification développés par l'Initiative mondiale pour la maladie pulmonaire obstructive chronique (GOLD) [8]. Alors que les critères de la définition cliniques de la BPCO ne sont pas clairs sur l’utilisation des valeurs de la fonction pulmonaire avant ou après administration de bronchodilatateur pour définir et classer la BPCO, les critères GOLD se référent aux valeurs après bronchodilatation.
La définition GOLD telle qu’elle est proposée est robuste pour le dépistage de l'obstruction bronchique dans la population générale mais le processus de vieillissement peut affecter le volume et les muscles pulmonaires et l’utilisation de ces ratios pourrait surestimer la BPCO chez les personnes âgées et sous estimer la BPCO chez les plus jeunes. C’est pour cela que le LLN a été introduit et conseillé pour les études épidémiologiques [14]. La limitation du débit ou l’obstruction bronchique due à la BPCO peut aussi être due à une atteinte des alvéoles et une destruction du parenchyme (emphysème) [15].
En absence de donnée d’exploration fonctionnelle, l’identification des BPCO peut être fondée sur la présence des symptômes de toux, d’expectoration et d’essoufflement. Les patients BPCO définis à partir de la présence des symptômes de toux et expectoration quotidienne, pendant trois mois et au moins deux années consécutives sont en réalité des bronchites chroniques; phase initiale de la BPCO. Le recouvrement entre ces deux entités peut être très "lâche": la bronchite chronique est inconstante chez les patients qui présentent ou vont développer une BPCO. Par ailleurs, cette définition ne traduit qu’en partie les conséquences de l’obstruction bronchique. Toutefois, tous les patients atteints de bronchite chronique ne développent pas une BPCO.
BPCO, CONSÉQUENCES FONCTIONNELLES, SÉVÉRITÉ ET NOUVELLES CLASSIFICATIONS
La BPCO conduit à un trouble ventilatoire obstructif a priori irréversible et qui ne subit que peu de variation après une prise en charge. La meilleure façon d’estimer actuellement l’obstruction bronchique est la spirométrie. La diminution du rapport de Tiffeneau définit le syndrome obstructif et la valeur du VEMS spécifie le degré d’obstruction. Le degré d’obstruction permet de classer les patients BPCO selon des stades de sévérité différents. Il n'existe aucun consensus concernant la définition de la sévérité de la BPCO. Comme précédemment dit, il existe plusieurs classifications internationales pour définir l’obstruction comme celle de “American Thoracic Society (ATS)” [10], “British Thoracic Society (BTS)” [11], “European Respiratory Society (ERS)” [12], “Global initiative for chronic Obstructive Lung Disease (GOLD)” [8], “Société de Pneumologie de langue française (SPLF)” [13]. La classification de sévérité à quatre stades proposée par GOLD en 2006 [8], semble être le standard actuel. Elle classe les patients BPCO en quatre stades de sévérité selon la valeur de leur VEMS:
• GOLD I (Faible): VEMS/CV < 0,70 et VEMS1 ≥ 80% prédite.
• GOLD II (Moyen): VEMS/CV < 0,70 et 50% ≤VEMS1 < 80% prédite.
• GOLD III (Sévère): VEMS/CV < 0,70 et 30% ≤VEMS1 < 50% prédite.
• GOLD IV (Très sévère): VEMS/CV < 0,70 et VEMS1 < 30% prédite.
Le fardeau de la BPCO ne dépend pas que de la sévérité de la maladie, mais aussi de la survenue de symptômes. Par ailleurs, la sévérité de la BPCO définie à partir de VEMS ne rende pas suffisamment compte du type, de la fréquence et de la sévérité des symptômes ; c’est une indication de l’état de santé du patient. La classification de la BPCO est un domaine très actif. De nouvelles propositions de critères de classification de la BPCO sont rapportées dans la littérature. Ces classifications associent aux VEMS, des paramètres de santé comme l’âge, l’essoufflement, l’indice de masse corporelle, l’activité physique, le statut tabagique et les exacerbations. Ainsi, en plus des données d’obstruction bronchique, les classifications BODE [16] et DOSE [17], par exemple, considère en plus l’indice de masse corporelle, l’ essoufflement et l’activité physique pour le premier (BODE), l’essoufflement, le statut tabagique et les exacerbations pour le second (DOSE). Par ailleurs, tout récemment une classification fondée sur des phénotypes a été proposée par un groupe de chercheurs français. Cette classification regroupe les malades BPCO en quatre classes: jeune et faible, jeune et sévère, vieux et faible, vieux et sévère. Ces nouvelles classifications multidimensionnelle rendent mieux compte de l’état du patient et pourraient contribuer à améliorer la prise en charge et la qualité de vie des patients.
BPCO ET EXACERBATIONS
Le patient BPCO présente des dégradations épisodiques de leur état de base appelées exacerbations. Il n’y a pas de définition unanimement reconnue des exacerbations de la BPCO ; elles sont pour la plupart fondées sur la symptomatologie et/ou le traitement.
Les exacerbations de la BPCO fondée sur la symptomatologie sont décrites comme "une aggravation aiguë des symptômes respiratoires associée à une dégradation de l’état physiologique du patient" [18], ou comme "un événement de l’histoire naturelle de la BPCO caractérisé par une modification de la dyspnée, toux, et /ou expectorations de base du patient au-delà de la variation routinière, se posant avec acuité et justifiant d’un changement de médication" [19].
Les définitions d’exacerbations fondées sur la médication associent les visites médicales, les changements et /ou augmentations de médicaments (anticholinergique, corticostéroïdes et antibiotiques) et la fréquence des hospitalisations [20].
Les exacerbations peuvent être faibles (recours à l’automédication), modérées (traitement par antibiotique, stéroïdes orales et/ou recours à une consultation téléphonique) ou sévères (consultation spécialisée et/ou admission à l'hôpital) [21]. Elles sont généralement sous diagnostiquées (les exacerbations faibles à modérées, sujettes à l’automédication ne sont pas souvent rapportées). Elles sont responsables d’une dégradation de l’état de santé du patient et probablement de la diminution de la fonction respiratoire. Elles apparaissent comme un élément central de l’histoire naturelle de la BPCO.
BPCO ET CO-MORBIDITE
La BPCO évolue rarement de manière isolée. Elle est souvent associée à des manifestations extra pulmonaires qui participent à l’aggravation de l’état de santé. Parmi ces comorbidités citons l’atrophie musculaire [22], les atteintes cardiovasculaires, la dépression [23], la diminution de la masse maigre, l’ostéopénie et des infections [8, 24]. Le traitement de la BPCO est préventif (arrêt du tabac, vaccinations), pharmacologique (bronchodilatateurs et corticoïdes) ou physique (réhabilitation respiratoire). L’arrêt du tabac est le seul traitement qui ait montré un ralentissement de la diminution de l’obstruction bronchique [25]. La pharmacothérapie permet de prévenir les symptômes, de réduire la fréquence et la sévérité des exacerbations et d’améliorer la qualité de vie des patients. La réhabilitation respiratoire vise à réduire les symptômes et à améliorer la qualité de vie (physique et émotionnelle) du patient. Les recommandations de prise en charge sont relativement bien documentées par les sociétés savantes qui proposent des algorithmes de traitements [8, 10-13].
POIDS EPIDEMIOLOGIQUE DE LA BPCO
La plupart des données épidémiologiques de la BPCO (prévalence, sévérité, exacerbation et mortalité) proviennent de pays à revenus élevés [26]. Même dans ces pays, ces données sont difficilement disponibles et sont largement sous estimées, la plupart des malades consultant dans les stades tardifs de la maladie [27]. Les données épidémiologiques provenant de pays en développement sont plutôt rares. Pour autant, ces informations sont importantes pour améliorer la prise en charge de la maladie.
Prévalence
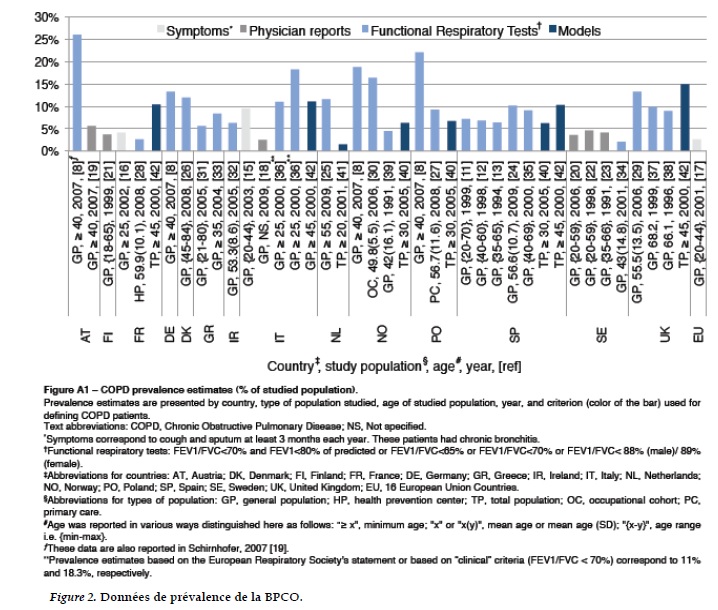
Dans une méta-analyse publiée en 2006, Halbert et ses collaborateurs [2] évaluent la prévalence mondiale de la BPCO en se fondant sur des estimations réalisée en population dans 28 pays à travers le monde. La définition la plus usuelle est celle de la “Global initiative for chronic Obstructive Lung Disease” (13 estimations) [8]. D’autres définition de la BPCO, telles celle de l'European Respiratory Society en 1995 (deux estimations) [12] et de l'American Thoracic Society (ATS) (deux estimations) [10] ont également été utilisées. La prévalence mondiale de la BPCO était en moyenne de 7,6% (95% intervalle de confiance (IC) 6,0-9,5%) (37 études).

La prévalence de la bronchite chronique était de 6,4% (95% intervalle de confiance (IC) 5,3–7,7%) (38 études) et 1,8% (95% intervalle de confiance (IC) 1,3– 2,6%) des patients étaient emphysémateux (8 études). Les auteurs soulignent que les estimations de prévalence fondées sur des données d’exploration fonctionnelle mesurée par spirométrie étaient les plus élevées; 9,2% contre 4,9% pour des estimations fondées sur avis des patients par exemple.
La BPCO était plus fréquente chez les personnes de 40 ans (9,0%) et plus de, chez les fumeurs (15,4%), chez les hommes (9,8%) et les personnes vivant en milieu urbain (10,2%) [2]. Il y avait une hétérogénéité des données qui est en partie expliquée par l’âge et le statut tabagique. Par ailleurs, des différences méthodologiques d’une étude à une autre et d’un pays à un autre empêchent toute comparaison efficiente des données disponibles [29] (Figure 2). Les dernières recommandations préconisent l’utilisation du LLN pour identifier la BPCO et en mesurer la prévalence [14].
Il existe peu de données de prévalence de la BPCO dans les pays en développement. Et pourtant, la prévalence de la BPCO devrait y augmenter dans les prochaines décennies, en particulier en Asie et en Afrique; conséquence de l’augmentation de la consommation du tabac [7, 30-33].
Chan-yeung et ses collaborateurs [7] rapportent les résultats des estimations de prévalence de la BPCO modérée à sévère, réalisés par Tan et ses collaborateurs, dans différents pays de l’Asie. Selon les résultats de ce modèle, la prévalence de la BPCO en Chine, Hong Kong, Taiwan, Japon, Corée et Thaïlande en 2000 varie entre 2,5% et 10,9%. Comme pour les estimations mondiales de la prévalence de la BPCO de Halbert et ses collaborateurs [2], il y a une variation des estimations d’un pays à un autre et ces variations peuvent en partie être dues à la différence méthodologique et à la population considérée dans les estimations de base utilisées dans le modèle. De plus, cette affection étant largement sous diagnostiquée dans les pays en développement, la prévalence est susceptible d'être sous-estimée.
Les données rapportées Chan-yeung et ses collaborateurs sont similaires à celles rapportées par le groupe de travail régional sur la BPCO, qui estiment la prévalence de la BPCO dans 12 pays d’Asie et du Pacifique, en 2003. La prévalence de la BPCO y est estimée à 6,3%. La plus grande prévalence était obtenue au Vietnam (6,7%) [34]. La BPCO est plus fréquente chez les fumeurs et anciens fumeurs; 13,5% des fumeurs et anciens fumeurs de plus de 40 ans font la BPCO [35]. Cette estimation probablement sous estimée, compte tenu du fait que le diagnostic n’y est pas systématique. Cette situation présage des problèmes sanitaires auxquels seront confrontés les décideurs de santé, notamment au Vietnam où la consommation du tabac est en cours d’augmentation. Des efforts sont en cours pour améliorer le recueil des données de prévalence, mais la qualité de données et la différence méthodologiques empêche une meilleur comparaison de données.
Mortalité
Les personnes présentant une BPCO modérée à sévère meurent beaucoup plus vite que les personnes présentant une fonction respiratoire normale [26]. Et pourtant, la mortalité des patients BPCO est largement sous estimée. Dans une étude prospective randomisée sur des patients BPCO (Towards a Revolution in COPD Health–TORCH–), les auteurs ont montré que 35% des décès des patients BPCO étaient attribués à des causes pulmonaires, 27% à des maladies cardiovasculaires et 21% aux cancers.
Dix pour cent ont été attribués à “autres causes” et dans 7% des cas, la cause n’a pas pu être déterminée [36 26]. Ces données suggèrent que les décès attribués à la BPCO sont sous-estimés, en particulier quand ils sont associées à des comorbidités comme le cancer du poumon ou les accidents vasculaires cérébraux. Cette sous estimation de la BPCO devrait être plus importante dans les pays en développement qui non seulement n'ont pas les moyens de mieux diagnostiquer et classer la BPCO, mais aussi, peu d’efforts sont consacrés à des maladies chronique comme la BPCO, les maladies infectieuses retenant toute l’attention.
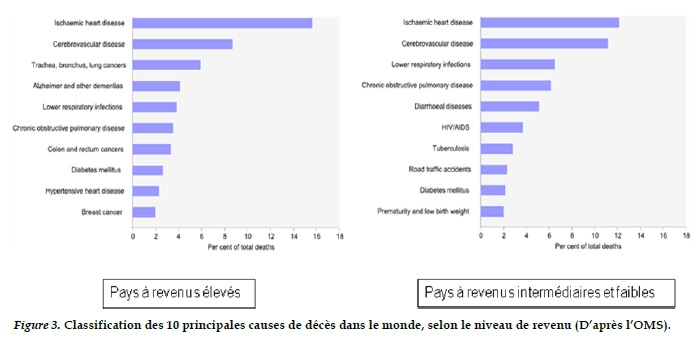
Les données de mortalité de la BPCO varient d’un pays à un autre et même au sein d’un même pays, les estimations peuvent être différentes [29]. Ces estimations peuvent être faite en population générale, chez le généraliste en ville ou à l’hôpital [29]. Malgré les différences méthodologiques d’une étude à l’autre, les estimations standardisées de décès attribuées à la BPCO, rapportées par des institutions régionales comme l’Eurostat ou de l’OMS, rendent compte du poids de la maladie. Selon un rapport commandé par l’OMS et la Banque Mondiale sur la “ Global Burden of Disease (GBD)”, la BPCO est actuellement la quatrième cause de décès dans le monde, avec 2,7 millions de décès dans le monde, soit 4,8'% des décès toutes causes [37]. Ces estimations sont similaires à celles de l’OMS. Les pays à revenus faibles et intermédiaires paient la plus lourde charge, soit 4,9% pour 3,8% pour les pays à revenus élevés. D’autres sources comme celles de l’Observatoire Mondiale de la Santé (GHO) estiment à 6,3% la mortalité associées à la BPCO dans les pays à revenus faibles et intermédiaires contre 3,8% pour les pays à revenus élevés (Figure 3).
(http://www.who.int/gho/mortality_burden_disease/ causes_death_2008/en/index.html)
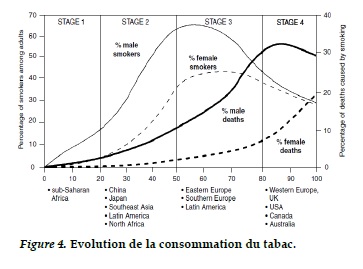
Dans le groupe de pays à revenu faible et intermédiaire, les régions du pacifique-est et l’Asie du sudouest ont les plus forts taux de décès [7]. Une augmentation de ces estimations de mortalité est prévue dans les prochaines décennies [38, 39]. On estime que la consommation du tabac et les conséquences du tabagisme comme la BPCO [38], vont augmenter dans les pays en développement dans les prochaines années (Figure 4). Actuellement, la prévalence de la consommation du tabac dans les pays en développement, en particulier en Asie du sud est supérieur à 30% [40] contrairement à celle des pays développés qui décroit depuis plusieurs dizaine d’années et actuellement en dessous des 30%. Ces estimations et projections ne représentent qu’une partie du poids de la BPCO, une bonne partie de patients BPCO vont vivre avec leur handicap avec les conséquences socio -économique que cela peut représenter.
Morbidité et coûts associés La BPCO est une maladie très coûteuse et un domaine d’augmentation de coût. Aux États-Unis par exemple, le coût total de la maladie était estimé à 23,9 milliards de dollars en 1993 [41]. En 2003, l’«US National Heart, Lung, and Blood Institute » a estimé le coût de la BPCO à 32,1 milliard (http:// www.nhlbi.nih.gov/health/public/lung/other/ copd_fact.pdf).
Et pourtant, ces estimations sont probablement sousestimées. Selon le livre blanc européen du poumon, publiée par l'ERS, le coût total de la BPCO est estimé à 38,7 milliards d'euros, soit plus du 1/3 des coûts de toutes les maladies respiratoires réunies (102 milliards d'euros).
En 2001, l’OMS estimait à 33,45 et 5,8 millions, le nombre d’années de vie ajustées sur l'incapacité attribuable attribuées à la BPCO dans les pays à revenus intermédiaires et faibles puis dans les pays à revenues élevés, respectivement [6]. L’Asie du sudouest occupe la deuxième place en termes d’années de vie ajustées sur l'incapacité attribuable attribuées à la BPCO, après le pacifique-est [7]. Ces informations peuvent être obtenues à partir d'un large éventail de sources (visite aux urgences, hospitalisations, consultation chez les généralistes ou spécialistes) et sont de ce fait, parfois, difficilement comparables entre elles, compte tenu des problèmes découlant des difficultés de normalisation de diagnostic. Les patient souffrant de la BPCO ont généralement des comorbidités associées, comme l'atrophie musculaire, les maladies cardiovasculaires, la dépression, l'ostéopénie, et les infections [4] qui contribuent à une forte morbidité de la maladie.
Dans la plupart des cas, il est difficile de faire la part entre ce qui est dû à la BPCO et ce qui est dû à la comorbidité. Ces morbidités ont un coût. L’analyse des coûts médicaux de la BPCO illustre la difficulté à estimer le vrai poids de la maladie.
Le sous-diagnostic et la présence de comorbidités sont des exemples des difficultés rencontrées dans l’estimation du coût de la BPCO ; la BPCO partage plusieurs comorbidités avec d’autres pathologie ayant le tabac comme facteur de risque. Par ailleurs, comme pour les comorbidités, la prévalence et la mortalité, beaucoup des différences méthodologiques d’une étude à l’autre empêchent une comparaison objective des estimations d’un pays à un autre. Les coûts peuvent être «directs» (les admissions, les médicaments, les équipements médicaux...) et indirects (arrêt du travail et manque de productivité, décès prématurés).
FACTEURS DE RISQUE
Le risque de développer une BPCO est lié à une interaction entre des facteurs environnementaux et la susceptibilité génétique de la personne, contribuant probablement à l'hétérogénéité dans la sensibilité aux facteurs de risque Tableau 1 [15]. La cigarette, l’'inhalation de polluants ou des irritants de l'environnement, le déficit en α1-antitrypsine et les expositions professionnelles sont des facteurs de risque de la BPCO.
Dans un moindre mesure, la pollution de l'air intérieur et extérieur, la pauvreté, les facteurs nutritionnels, tels que les antioxydants, les acides gras polyinsaturés (AGPI) et le sel; le tabagisme passif, l'âge, les facteurs familiaux et génétiques; hyperréactivité bronchique; infections de l'enfance, et, éventuellement, un niveau élevé d'immunoglobulines E (Ig) à un jeune âge sont des facteurs pronostics positifs de l'obstruction des voies respiratoires [42].
Le rôle du sexe comme facteur de risque de la BPCO est toujours discuté. Dans le passé, la plupart des études ont montré que la prévalence et la mortalité de la BPCO étaient élevées chez les hommes que chez les femmes. Mais des études plus récentes provenant des pays développés montrent que la prévalence de la maladie est presque égale chez les mâles et les femelles, reflétant probablement évolution des modes de consommation de tabac. L’identification de ces facteurs de risque participe à la stratégie de prévention et de prise en charge efficace de la BPCO. Ces facteurs de risque sont détaillés dans les paragraphes suivants.
Le tabagisme
La fumée du tabac est le facteur de risque le plus couramment décrit. [43, 44]. La prévalence de la BPCO est plus importante chez les fumeurs [36, 45]. Non seulement le tabac est un facteur de risque de la BPCO, mais une fois la maladie établie, le tabac est également associé à une progression plus rapide de la maladie: la fonction pulmonaire des BPCO fumeurs diminuent deux fois plus vite que les BPCO non fumeurs [46]. Fletcher et ses collaborateurs furent les premiers à montrer cet impact du tabac sur l’histoire naturelle de la BPCO (Fletcher C). Cette hypothèse ont été confirmée plus tard, dans d’autres études observationnelles [47, 48]. La cigarette est également associé à un risque élevé de décès [26] Cependant, tous les fumeurs ne développent pas de BPCO, seuls 15 à 50% des fumeurs développent une BPCO [45, 49]. Des données plus récentes ont montré que l’exposition passive des non fumeurs à la fumée du tabac augmente le risque de faire de la BPCO. Bien évidemment, ces risques sont moins importants que dans le cadre d’une exposition active. Le tabagisme de la femme enceinte (tabagisme passif pour le fœtus) peut également constituer un risque pour le fœtus, en affectant la croissance des poumons et le développement in utero et éventuellement, le système immunitaire.
Facteurs génétiques
Divers facteurs génétiques susceptibles d’augmenter le risque pour une personne de développer la BPCO ont été décrits [50-52]. Le facteur de risque génétique de la BPCO le mieux documenté est une déficience héréditaire en α1-antitrypsine [53, 54]. Cette déficience se traduit chez les malades BPCO (fumeurs ou non), par un développement prématuré et accéléré de l'emphysème et le déclin panlobulaire de la fonction pulmonaire. Le tabagisme est un facteur d’ activation de ce risque [55, 56].Toutefois, la déficience héréditaire en α1-antitrypsine n’explique qu’une petite proportion des cas de BPCO. Elle est responsable de 1 à 3% environ, des BPCO aux Etats-Unis [57].
La BPCO est une maladie polygénique ; plusieurs gènes candidats potentiels pourraient contribuer à la survenue et au développement de la BPCO [58]. La BPCO n'est pas seulement une maladie des poumons, mais aussi un trouble inflammatoire systémique. De ce fait, d'autres facteurs génétiques en rapport avec les réactions inflammatoires systémiques de la BPCO ou les facteurs de reconstruction tissulaire pourraient être impliqués dans la survenue et le développement de la BPCO. Il y aurait par exemple, un gène de susceptibilité à la fumée du tabac, le chromosome 2q [59], le facteur de croissance TGF-β1, microsome epoxide hydrolase 1 (EPHX 1) [60], le facteur de nécrose tumorale (TNFα) [61]. Toutefois, l’impact et la description des variantes génétiques fonctionnelles qui seraient impliquées dans ces interactions sont toujours discutés.
Pollution atmosphérique
Des niveaux élevés de pollution de l'air peuvent affecter le développement de la fonction pulmonaire, et ainsi devenir un facteur de risque de BPCO. De plus, par le biais du stress oxydant, ils peuvent être à l’origine des mécanismes inflammatoires à l’origine de la BPCO.
Il existe dans la littérature, de plus en plus d’évidence de l’effet de la pollution de l'air intérieure et extérieure sur la fréquence des exacerbations, des hospitalisations et la mortalité la BPCO [62-65]. Toutefois, l’impact de la pollution de l’air extérieur sur la pathogénie et l’histoire naturelle de la BPCO est difficile à mettre en évidence. De façon générale, il a été montré que la pollution de l’air par les moteurs des véhicules est associée à une diminution de la fonction respiratoire [66] Les principaux polluants impliqués sont le dioxyde de soufre, le monoxyde de carbone, les oxydes d'azote et de particules ambiantes (PM2.5 et PM10) [67, 68]. Ce sont des agents oxydants puissants impliqués dans les phénomènes inflammatoires associés à l’exacerbation de la BPCO et probablement à la pathogénie (histoire naturelle) de la BPCO.
Les mécanismes par lesquels ces polluants interfèrent sur l’histoire naturelle de la BPCO pourraient être similaires à ceux de la cigarette.
En Europe par exemple, une étude réalisée par la Fédération européenne des associations de patients souffrant de maladies respiratoires et d’allergies a montré l’impact de la qualité de l’air intérieur dans l’apparition des maladies liées à l’environnement comme la BPCO [69]. L’utilisation de biomasse comme source d’énergie associée à une mauvaise ventilation du logement, est un facteur de risque de la BPCO. Les femmes et les enfants sont ainsi exposés chaque jours à des niveaux élevés de pollution de l'air intérieur. En effet, pour des millions de personnes à travers le monde, surtout dans les pays en développement qui utilisent la biomasse et le charbon comme leur principale source d'énergie pour cuisiner, se chauffer et pour d’autres besoins ménagers, il a été montré que ces sources d’énergie induisent une pollution de l’air intérieur [64]. Les biocombustibles utilisés par les femmes comme source d’énergie, explique en partie la forte prévalence de la BPCO des femmes non fumeurs au Moyen orient, en Afrique et en Asie [7]. La pollution de l'air intérieur résultant de la combustion de bois et autres combustibles biomasse est aussi responsable de millions de décès dans le monde.
Nutrition
La consommation alimentaire a une incidence sur la BPCO, à la fois comme source de micronutriments antioxydants intervenant directement dans les réactions oxydatives de l’histoire naturelle de la BPCO [70] et à la fois comme source d’énergie et d’ éléments constitutifs des muscles respiratoires pour assurer le bon fonctionnement de ces organes [71, 72]. Les antioxydants comme les vitamines C et E, [73, 74] certains acides gras polyinsaturés des poissons [75, 76] et le magnésium, pourrait jouer un rôle protecteur contre le développement de la BPCO.
En occurrence, il pourraient jouer un rôle important d’ une part, dans les phénomènes d’oxydation induits par des radicaux libres inhalés ou des agents oxydants endogènes ou des enzymes protéolytiques libérés par des neutrophiles après inhalation de la fumée de cigarette et d'autres polluants volatiles et d’autre part dans les phénomènes oxydatifs qui conduisent à l’emphysème [64, 77].
Par exemple, dans une étude prospective réalisée aux Pays-Bas, sur des personnes présentant des symptômes respiratoires chroniques ou un emphysème ou une bronchite chronique, l’augmentation de ces symptômes est associée à une diminution de la consommation de fruit, reflétant une baisse de la vitamine C [78]. Des résultats similaires ont été mis en évidence dans l'étude NHANES II [79] sur des personnes présentant la bronchite et une respiration sifflante, dont l’augmentation des symptômes est corrélée à une baisse de la vitamine C. Une autre étude a démontré une association relativement faible entre la fonction pulmonaire et l’apport de la vitamine E [80]. Toutefois, les mécanismes par lesquels ces ce vitamines interfèrent directement ou en association avec d’autres nutriments, dans les phénomènes oxydatifs de la BPCO, sont encore discutés. Les apports alimentaires de ces vitamines peuvent donc jouer un rôle de défense de l'hôte contre les dommages oxydatifs des poumons. Mais comme pour les vitamines C et E anti-oxydantes, le magnésium et les acides gras polyinsaturés ont de façon directe ou indirecte un rôle protecteur par rapport à la BPCO, mais ces résultats ont besoin d’être validés par des études cliniques.
Expositions professionnelles
Les expositions professionnelles liées à la BPCO sont l’exposition aux poussières, vapeurs, fumées et autres produits chimiques dans le lieu de travail. Aux Etats-Unis, 19,2% des cas de BPCO sont attribuables à une exposition professionnelle; 31,1% des cas surviennent chez des non fumeurs [81]. Les expositions professionnelles seraient responsables de 15 à 19% de BPCO chez les fumeurs [82]et près de 30% chez les non fumeurs [83]. Les professions les plus à risque de la BPCO sont ceux qui impliquent généralement une exposition aux poussières ou fumées [84, 85]. La poussière de charbon [86, 87], la poussière de silice [88, 89], le cadmium [90] sont les plus documentés. D’autres poussières, fumées ou solvants professionnels ont également été mis en évidence [91, 92].
Infections
Enfin, les infections ont un rôle important dans le développement [93] et la progression de la BPCO, en provoquant en particulier des exacerbations [94, 95]. Les infections, que ce soit virales ou bactériennes, contribue à l’apparition de la BPCO et une fois la maladie installée, elles ont une incidence sur l’état de santé du patient. [96]. Les épisodes infectieux dans la petite enfance pourraient être associés à la BPCO à l’âge adulte [97].
Ainsi, le fait que les conséquences respiratoires des infections aiguës dans l'enfance sont perceptibles plusieurs mois voir années après [98, 99], serait compatible avec l’hypothèse selon laquelle les infections de l’enfance pourraient à long terme induire un risque de BPCO. Toutefois, le rôle des infections respiratoires de la petite enfance dans le développement de la BPCO de l'adulte reste controversé et mériterait d'être confirmé sur des cohortes plus importantes suivies sur des périodes plus longues.
Catégorie socio-professionnelle
Il a été montré que le risque de développer la BPCO est corréler au statut socio-professionnel de la personne [100, 101]. Toutefois, il est difficile de raire la part entre ce qui est du au statut socio professionnel lui même et les autres facteurs de risque avérés de la BPCO comme l’exposition au tabac, la nutrition, la pollution intérieure et l’exposition professionnelle, liés au statut socio économique de la personne.
Asthme et tuberculose
La présence de l’asthme pourrait prédisposer une personne à la BPCO. Des interactions entre l’asthme et la BPCO ont été montrées. Il a été montré notamment, d’une part, que la présence de l’asthme est associée à une accélération de la diminution de la fonction pulmonaire chez les patients BPCO [102]. Il a été aussi montré que certains adultes souffrant d'asthme présentaient des caractéristiques radiographiques évocatrices de la BPCO. Par exemple, l’ analyse tomodensitométrique de certains adultes asthmatiques non fumeurs, particulièrement ceux présentant un asthme de longue date et sévère, a révélé des caractéristiques emphysémateuses [103, 104]. Par ailleurs, il ya des caractéristiques radiographiques révélateur d’emphysème chez des anciens fumeurs de longue date, asthmatiques, suggérant l’hypothèse d’un possible rôle de l’asthme dans la genèse de la BPCO.
La tuberculose pulmonaire a été associée à une accélération de la diminution de la fonction pulmonaire [105]. L’étude épidémiologique PLATINO réalisée en population générale dans 5 grandes villes d’Amérique du Sud a montré une très grande association entre la BPCO et une infection passée ou en cours, de tuberculose [106]. Par ailleurs, il a été montré un risque accru de la tuberculose et l’exposition à la fumée de la biomasse [107, 108], ce qui démontre la complexité des interactions entre l'inhalation de fumée et de la fonction pulmonaire altérée.
Dans les pays en développement et le plus souvent à forte prévalence de tuberculose, une attention particulière doit être apportée aux patients réunissant ces conditions d’exposition. Toutefois, les preuves d'une relation causale entre la tuberculose et la BPCO ne sont pas totalement établies. Est-ce que la perte de fonction respiratoire liée à la tuberculose est cliniquement semblable à celle du à la BPCO ou l’exposition au tabac ?
Symptômes
La présence de symptômes de toux chronique, de production chronique d’expectoration et l’essoufflement augmente le risque de détérioration de la fonction pulmonaire [109].
Toutefois, ces symptômes étant fortement associés à l’exposition au tabac, il est difficile de faire la part entre le tabac et l’effet des symptômes dans la détérioration de la fonction pulmonaire. Ceci étant, l’ exposition au tabac étant associée à un plus faible niveau d’expression de ces symptômes, [110, 111] leur présence augmenterait le risque de détérioration de la fonction pulmonaire.
Le rôle de l’hypersécrétion chronique du mucus dans la BPCO est discuté. En général, la présence d’hypersécrétion chronique du mucus n’est pas associée à un risque supplémentaire de décès lié à la BPCO [112]. Toutefois, l’hypersécrétion chronique du mucus en présence d’une limitation de fonction respiratoire serait associé à un risque supplémentaire de décès toutes causes [113, 114].
Sexe
Les expositions environnementales pourraient affecter les femmes et les hommes différemment. En effet, il existe d’une part, des différences biologiques, physiologiques et hormonales entre les hommes et les femmes et d’autre part, des différences de traitement et d’exposition aux facteurs de risque, liées à la culture. Les hommes et les femmes diffèrent également en termes d'exposition aux facteurs environnementaux (polluants intérieurs et extérieurs, l'alimentation, etc.). Ces différences dans les expositions environnementales et professionnelles sont liées aux différences de comportements et d’activités.
Les polluants en générale et le tabagisme en particulier, principal facteur de risque de la BPCO, a une plus grande incidence sur les femmes que les hommes [115]. D’une part, l’effet du tabagisme précoce sur le développement du poumon est plus marquant chez les femmes [111, 116], d’autre part, les femmes auraient une plus grande susceptibilité à développer la BPCO, par rapport aux hommes [72].
La prévalence de la BPCO a été pendant longtemps, plus important chez les hommes que les femmes ; conséquence de la différence dans l’exposition aux facteurs de risque et les différences physiologique et atomiques. Ces dernières décennies, aussi bien dans les pays développés que dans les pays en développement, la tendance est à l’augmentation de la prévalence chez les femmes. Dans les pays en développement, les efforts visant à promouvoir des carburants plus propres, l’utilisation de foyers améliorés dans les activités ménagères, une meilleure ventilation à domicile, la réduction de l’exposition à la poussière toxique et à la fumée, la lutte contre les maladies infectieuses comme la tuberculose et le VIH, et l’amélioration de la nutrition sont autant de moyens par lesquels la santé respiratoire des femmes peut être améliorée.
Association de facteurs de risque
Tout ou partie des facteurs de risque cités plus haut peuvent coexister chez un patient BPCO. L’usage du tabac, la consommation d'alcool, le manque d’activités physiques, forte indice de masse corporelle, la pression artérielle anormal et le taux anormal de cholestérol circulant niveau peuvent intervenir simultanément. Dans l'étude nord-ouest de la Santé Adélaïde, qui visait à cibler les interventions qui affectent chaque étape du continuum de la maladie chronique, 1% des personnes atteintes de BPCO a montré deux ou plusieurs de ces facteurs de risque.
CONCLUSION
La compréhension de la physiopathologie de la BPCO et le recueil des données épidémiologiques de la BPCO ont évolué depuis ces dernières décennies. Les données épidémiologiques de la BPCO ne sont toujours pas disponibles pour la plupart des pays en développement. Toutefois, des efforts sont en cours pour recueillir ces données. Ces efforts doivent être encourager afin de développer une connaissance de la BPCO qui tienne compte de la population de malades dans son environnement géographique et culturel pour mieux cibler les actions à entreprendre pour prévenir et améliorer la prise en charge.
CONFLIT D’INTERÊT
Aucun
REFERENCES
1. WHO. "Bronchopneumopathie chronique obstructive (BPCO)." Aide-mémoire. Novembre 2009. http:// www.who.int/mediacentre/factsheets/fs315/fr/ index.html.
2. Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006: 28(3): 523532.
3. de Marco R, Accordini S, Cerveri I, Corsico A, Sunyer J, Neukirch F, et al. An international survey of chronic obstructive pulmonary disease in young adults according to GOLD stages. Thorax 2004: 59(2): 120-125.
4. Sin DD, Anthonisen NR, Soriano JB, Agusti AG. Mortality in COPD: Role of comorbidities. Eur Respir J 2006: 28(6): 1245-1257.
5. Wouters EF. Economic analysis of the Confronting COPD survey: an overview of results. Respir Med 2003: 97 Suppl C: S3-14.
6. Lopez AD, Mathers CD, Ezzati M, Jamison DT, Murray CJ. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data. Lancet 2006: 367(9524): 1747-1757.
7. Chan-Yeung M, Ait-Khaled N, White N, Ip MS, Tan WC. The burden and impact of COPD in Asia and Africa. Int J Tuberc Lung Dis 2004: 8(1): 2-14.
8. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (UPDATED 2009). : http:// www.goldcopd.com/download.asp?intId=554
9. Vollmer WM, Gislason T, Burney P, Enright PL, Gulsvik A, Kocabas A, et al. Comparison of spirometry criteria for the diagnosis of COPD: results from the BOLD study. Eur Respir J 2009: 34(3): 588-597.
10. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med 1995: 152(5 Pt 2): S77-121.
11. BTS guidelines for the management of chronic obstructive pulmonary disease. The COPD Guidelines Group of the Standards of Care Committee of the BTS. Thorax 1997: 52 Suppl 5: S1-28.
12. COPD Guidelines Web-based Guidelines 2007 [cited 2007; Available from: http://www.ersnet.org/ers/lr/browse/ default.aspx
13. SPLF. Recommendations of the Francophone Society of Pneumology for pulmonary rehabilitation in COPD. Rev Mal Respir 2005: 22(4): 696-704.
14. Bakke PS, Ronmark E, Eagan T, Pistelli F, AnnesiMaesano I, et al. Recommendations for epidemiological studies on COPD. Eur Respir J 2011: 38(6): 1261-1277.
15. Mannino DM, Buist AS. Global burden of COPD: risk factors, prevalence, and future trends. Lancet 2007: 370 (9589): 765-773.
16. Celli BR, Cote CG, Marin JM, Casanova C, Montes de Oca M, Mendez RA, et al. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med 2004: 350(10): 1005-1012.
17. Jones RC, Donaldson GC, Chavannes NH, et al. Derivation and validation of a composite index of severity in chronic obstructive pulmonary disease: the DOSE Index. Am J Respir Crit Care Med 2009: 180: 1189-1195.
18. Seemungal TA, Donaldson GC, Bhowmik A, et al. Time course and recovery of exacerbations in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000: 161(5): 1608-1613.
19. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2007: 176(6): 532-555.
20. Rodriguez-Roisin R. Toward a consensus definition for COPD exacerbations. Chest 2000: 117(5 Suppl 2): 398S401S.
21. Andersson F, Borg S, Jansson SA, Jonsson AC, Ericsson A, Prutz C, et al. The costs of exacerbations in chronic obstructive pulmonary disease (COPD). Respir Med 2002: 96(9): 700-708.
22. Agusti AG, Noguera A, Sauleda J, Sala E, Pons J, Busquets X. Systemic effects of chronic obstructive pulmonary disease. Eur Respir J 2003: 21(2): 347-360.
23. Curkendall SM, Lanes S, de Luise C, Stang MR, Jones JK, She D, et al. Chronic obstructive pulmonary disease severity and cardiovascular outcomes. Eur J Epidemiol 2006: 21(11): 803-813.
24. Mallia P, Johnston SL. Mechanisms and experimental models of chronic obstructive pulmonary disease exacerbations. Proc Am Thorac Soc 2005: 2(4): 361-366; discussion 371-362.
25. Anthonisen NR, Connett JE, Kiley JP, Altose MD, Bailey WC, Buist AS, et al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA 1994: 272(19): 1497-1505.
26. Mannino DM, Doherty DE, Sonia Buist A. Global Initiative on Obstructive Lung Disease (GOLD) classification of lung disease and mortality: findings from the Atherosclerosis Risk in Communities (ARIC) study. Respir Med 2006: 100(1): 115-122.
27. Pena VS, Miravitlles M, Gabriel R, Jimenez-Ruiz CA, Villasante C, Masa JF, et al. Geographic variations in prevalence and underdiagnosis of COPD: results of the IBERPOC multicentre epidemiological study. Chest 2000: 118(4): 981-989.
28. Roche N. BPCO: Definition, Diagnostic. www.santejeunesse-sports.gouv.fr/IMG/ppt/definition.ppt
29. Atsou K, Chouaid C, Hejblum G. Variability of the chronic obstructive pulmonary disease key epidemiological data in Europe: systematic review. BMC Med 2011: 9(1): 7.
30. Ait-Khaled N, Enarson DA, Ottmani S, El Sony A, Eltigani M, Sepulveda R. Chronic airflow limitation in developing countries: burden and priorities. Int J Chron Obstruct Pulmon Dis 2007: 2(2): 141-150.
31. Ko FW, Hui DS, Lai CK. Worldwide burden of COPD in high- and low-income countries. Part III. Asia-Pacific studies. Int J Tuberc Lung Dis 2008: 12(7): 713-717.
32. Mehrotra A, Oluwole AM, Gordon SB. The burden of COPD in Africa: a literature review and prospective survey of the availability of spirometry for COPD diagnosis in Africa. Trop Med Int Health 2009: 14(8): 840848.
33. Teramoto S, Yamamoto H, Yamaguchi Y, Matsuse T, Ouchi Y. Global burden of COPD in Japan and Asia. Lancet 2003: 362(9397): 1764-1765.
34. COPD prevalence in 12 Asia-Pacific countries and regions: projections based on the COPD prevalence estimation model. Respirology 2003: 8(2): 192-198.
35. Duong-Quy S, Hua-Huy T, Mai-Huu-Thanh B, DoanThi-Quynh N, Le-Quang K, Nguyen-Van H, et al. [Early detection of smoking related chronic obstructive pulmonary disease in Vietnam]. Rev Mal Respir 2009: 26 (3): 267-274.
36. Calverley PM, Anderson JA, Celli B, Ferguson GT, Jenkins C, Jones PW, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007: 356(8): 775-789.
37. Lopez A, Mathers C, Ezzati M, Jamison D, CJL. M. Global Burden of Disease and Risk Factors. Oxford University Press USA ed. World Bank, 2006.
38. Lopez AD, Collishaw NE, T P. A descriptive model of the cigarette epidemic in developed countries. Tobacco Control 1994: 3: 242-247.
39. Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 2006: 3(11): e442.
40. Sinha DN, Palipudi KM, Rolle I, Asma S, Rinchen S. Tobacco use among youth and adults in member countries of South-East Asia region: Review of findings from surveys under the global tobacco surveillance system. Indian J Public Health 2011: 55(3): 169-176.
41. Sullivan SD, Ramsey SD, Lee TA. The economic burden of COPD. Chest 2000: 117(2 Suppl): 5S-9S.
42. Yach D, Hawkes C, Gould CL, Hofman KJ. The global burden of chronic diseases: overcoming impediments to prevention and control. JAMA 2004:291: 2616-2622.
43. Chan-Yeung M, Ho AS, Cheung AH, Liu RW, Yee WK, Sin KM, et al. Determinants of chronic obstructive pulmonary disease in Chinese patients in Hong Kong. Int J Tuberc Lung Dis 2007: 11(5): 502-507.
44. Yin P, Jiang CQ, Cheng KK, Lam TH, Lam KH, Miller MR, et al. Passive smoking exposure and risk of COPD among adults in China: the Guangzhou Biobank Cohort Study. Lancet 2007: 370(9589): 751-757.
45. Lundback B, Lindberg A, Lindstrom M, Ronmark E, Jonsson AC, Jonsson E, et al. Not 15 but 50% of smokers develop COPD?--Report from the Obstructive Lung Disease in Northern Sweden Studies. Respir Med 2003: 97(2): 115-122.
46. Scanlon PD, Connett JE, Waller LA, Altose MD, Bailey WC, Buist AS. Smoking cessation and lung function in mild-to-moderate chronic obstructive pulmonary disease. The Lung Health Study. Am J Respir Crit Care Med 2000: 161(2 Pt 1): 381-390.
47. Tashkin DP, Detels R, Simmons M, Liu H, Coulson AH, Sayre J, et al. The UCLA population studies of chronic obstructive respiratory disease: XI. Impact of air pollution and smoking on annual change in forced expiratory volume in one second. Am J Respir Crit Care Med 1994: 149(5): 1209-1217.
48. Xu X, Dockery DW, Ware JH, Speizer FE, Ferris BG, Jr. Effects of cigarette smoking on rate of loss of pulmonary function in adults: a longitudinal assessment. Am Rev Respir Dis 1992: 146(5 Pt 1): 1345-1348.
49. Rennard SI, Vestbo J. COPD: the dangerous underestimate of 15%. Lancet 2006: 367(9518): 1216-1219.
50. Hersh CP, Demeo DL, Lazarus R, Celedon JC, Raby BA, Reilly JJ, et al. Genetic determinants of functional impairment in chronic obstructive pulmonary disease. Proc Am Thorac Soc 2006: 3(6): 476.
51. Sandford AJ, Pare PD. Genetic risk factors for chronic obstructive pulmonary disease. Clin Chest Med 2000: 21 (4): 633-643.
52. Silverman EK. Progress in chronic obstructive pulmonary disease genetics. Proc Am Thorac Soc 2006: 3(5): 405-408.
53. Eriksson S. Studies in alpha 1-antitrypsin deficiency. Acta Med Scand Suppl 1965: 432: 1-85.
54. Wood AM, de Pablo P, Buckley CD, Ahmad A, Stockley RA. Smoke exposure as a determinant of autoantibody titre in alpha-antitrypsin deficiency and COPD. Eur Respir J: 37(1): 32-38.
55. Mittman C, Lieberman J, Marasso F, Miranda A. Smoking and chronic obstructive lung disease in alpha -1-antitrypsin deficiency. Chest 1971: 60(3): 214-221.
56. Silverman EK, Province MA, Campbell EJ, Pierce JA, Rao DC. Family study of alpha 1-antitrypsin deficiency: effects of cigarette smoking, measured genotype, and their interaction on pulmonary function and biochemical traits. Genet Epidemiol 1992: 9(5): 317-331.
57. Strange C, Stoller JK, Sandhaus RA, Dickson R, Turino G. Results of a survey of patients with alpha-1 antitrypsin deficiency. Respiration 2006: 73(2): 185-190.
58. Silverman EK. Genetic Epidemiology of COPD. Chest 2002: 121(3 Suppl): 1S-6S.
59. Silverman EK,
FIGURES/TABLE

REFERENCES
1. WHO. "Bronchopneumopathie chronique obstructive (BPCO)." Aide-mémoire. Novembre 2009. http:// www.who.int/mediacentre/factsheets/fs315/fr/ index.html.
2. Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006: 28(3): 523532.
3. de Marco R, Accordini S, Cerveri I, Corsico A, Sunyer J, Neukirch F, et al. An international survey of chronic obstructive pulmonary disease in young adults according to GOLD stages. Thorax 2004: 59(2): 120-125.
4. Sin DD, Anthonisen NR, Soriano JB, Agusti AG. Mortality in COPD: Role of comorbidities. Eur Respir J 2006: 28(6): 1245-1257.
5. Wouters EF. Economic analysis of the Confronting COPD survey: an overview of results. Respir Med 2003: 97 Suppl C: S3-14.
6. Lopez AD, Mathers CD, Ezzati M, Jamison DT, Murray CJ. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data. Lancet 2006: 367(9524): 1747-1757.
7. Chan-Yeung M, Ait-Khaled N, White N, Ip MS, Tan WC. The burden and impact of COPD in Asia and Africa. Int J Tuberc Lung Dis 2004: 8(1): 2-14.
8. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (UPDATED 2009). : http:// www.goldcopd.com/download.asp?intId=554
9. Vollmer WM, Gislason T, Burney P, Enright PL, Gulsvik A, Kocabas A, et al. Comparison of spirometry criteria for the diagnosis of COPD: results from the BOLD study. Eur Respir J 2009: 34(3): 588-597.
10. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med 1995: 152(5 Pt 2): S77-121.
11. BTS guidelines for the management of chronic obstructive pulmonary disease. The COPD Guidelines Group of the Standards of Care Committee of the BTS. Thorax 1997: 52 Suppl 5: S1-28.
12. COPD Guidelines Web-based Guidelines 2007 [cited 2007; Available from: http://www.ersnet.org/ers/lr/browse/ default.aspx
13. SPLF. Recommendations of the Francophone Society of Pneumology for pulmonary rehabilitation in COPD. Rev Mal Respir 2005: 22(4): 696-704.
14. Bakke PS, Ronmark E, Eagan T, Pistelli F, AnnesiMaesano I, et al. Recommendations for epidemiological studies on COPD. Eur Respir J 2011: 38(6): 1261-1277.
15. Mannino DM, Buist AS. Global burden of COPD: risk factors, prevalence, and future trends. Lancet 2007: 370 (9589): 765-773.
16. Celli BR, Cote CG, Marin JM, Casanova C, Montes de Oca M, Mendez RA, et al. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med 2004: 350(10): 1005-1012.
17. Jones RC, Donaldson GC, Chavannes NH, et al. Derivation and validation of a composite index of severity in chronic obstructive pulmonary disease: the DOSE Index. Am J Respir Crit Care Med 2009: 180: 1189-1195.
18. Seemungal TA, Donaldson GC, Bhowmik A, et al. Time course and recovery of exacerbations in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000: 161(5): 1608-1613.
19. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2007: 176(6): 532-555.
20. Rodriguez-Roisin R. Toward a consensus definition for COPD exacerbations. Chest 2000: 117(5 Suppl 2): 398S401S.
21. Andersson F, Borg S, Jansson SA, Jonsson AC, Ericsson A, Prutz C, et al. The costs of exacerbations in chronic obstructive pulmonary disease (COPD). Respir Med 2002: 96(9): 700-708.
22. Agusti AG, Noguera A, Sauleda J, Sala E, Pons J, Busquets X. Systemic effects of chronic obstructive pulmonary disease. Eur Respir J 2003: 21(2): 347-360.
23. Curkendall SM, Lanes S, de Luise C, Stang MR, Jones JK, She D, et al. Chronic obstructive pulmonary disease severity and cardiovascular outcomes. Eur J Epidemiol 2006: 21(11): 803-813.
24. Mallia P, Johnston SL. Mechanisms and experimental models of chronic obstructive pulmonary disease exacerbations. Proc Am Thorac Soc 2005: 2(4): 361-366; discussion 371-362.
25. Anthonisen NR, Connett JE, Kiley JP, Altose MD, Bailey WC, Buist AS, et al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA 1994: 272(19): 1497-1505.
26. Mannino DM, Doherty DE, Sonia Buist A. Global Initiative on Obstructive Lung Disease (GOLD) classification of lung disease and mortality: findings from the Atherosclerosis Risk in Communities (ARIC) study. Respir Med 2006: 100(1): 115-122.
27. Pena VS, Miravitlles M, Gabriel R, Jimenez-Ruiz CA, Villasante C, Masa JF, et al. Geographic variations in prevalence and underdiagnosis of COPD: results of the IBERPOC multicentre epidemiological study. Chest 2000: 118(4): 981-989.
28. Roche N. BPCO: Definition, Diagnostic. www.santejeunesse-sports.gouv.fr/IMG/ppt/definition.ppt
29. Atsou K, Chouaid C, Hejblum G. Variability of the chronic obstructive pulmonary disease key epidemiological data in Europe: systematic review. BMC Med 2011: 9(1): 7.
30. Ait-Khaled N, Enarson DA, Ottmani S, El Sony A, Eltigani M, Sepulveda R. Chronic airflow limitation in developing countries: burden and priorities. Int J Chron Obstruct Pulmon Dis 2007: 2(2): 141-150.
31. Ko FW, Hui DS, Lai CK. Worldwide burden of COPD in high- and low-income countries. Part III. Asia-Pacific studies. Int J Tuberc Lung Dis 2008: 12(7): 713-717.
32. Mehrotra A, Oluwole AM, Gordon SB. The burden of COPD in Africa: a literature review and prospective survey of the availability of spirometry for COPD diagnosis in Africa. Trop Med Int Health 2009: 14(8): 840848.
33. Teramoto S, Yamamoto H, Yamaguchi Y, Matsuse T, Ouchi Y. Global burden of COPD in Japan and Asia. Lancet 2003: 362(9397): 1764-1765.
34. COPD prevalence in 12 Asia-Pacific countries and regions: projections based on the COPD prevalence estimation model. Respirology 2003: 8(2): 192-198.
35. Duong-Quy S, Hua-Huy T, Mai-Huu-Thanh B, DoanThi-Quynh N, Le-Quang K, Nguyen-Van H, et al. [Early detection of smoking related chronic obstructive pulmonary disease in Vietnam]. Rev Mal Respir 2009: 26 (3): 267-274.
36. Calverley PM, Anderson JA, Celli B, Ferguson GT, Jenkins C, Jones PW, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007: 356(8): 775-789.
37. Lopez A, Mathers C, Ezzati M, Jamison D, CJL. M. Global Burden of Disease and Risk Factors. Oxford University Press USA ed. World Bank, 2006.
38. Lopez AD, Collishaw NE, T P. A descriptive model of the cigarette epidemic in developed countries. Tobacco Control 1994: 3: 242-247.
39. Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 2006: 3(11): e442.
40. Sinha DN, Palipudi KM, Rolle I, Asma S, Rinchen S. Tobacco use among youth and adults in member countries of South-East Asia region: Review of findings from surveys under the global tobacco surveillance system. Indian J Public Health 2011: 55(3): 169-176.
41. Sullivan SD, Ramsey SD, Lee TA. The economic burden of COPD. Chest 2000: 117(2 Suppl): 5S-9S.
42. Yach D, Hawkes C, Gould CL, Hofman KJ. The global burden of chronic diseases: overcoming impediments to prevention and control. JAMA 2004:291: 2616-2622.
43. Chan-Yeung M, Ho AS, Cheung AH, Liu RW, Yee WK, Sin KM, et al. Determinants of chronic obstructive pulmonary disease in Chinese patients in Hong Kong. Int J Tuberc Lung Dis 2007: 11(5): 502-507.
44. Yin P, Jiang CQ, Cheng KK, Lam TH, Lam KH, Miller MR, et al. Passive smoking exposure and risk of COPD among adults in China: the Guangzhou Biobank Cohort Study. Lancet 2007: 370(9589): 751-757.
45. Lundback B, Lindberg A, Lindstrom M, Ronmark E, Jonsson AC, Jonsson E, et al. Not 15 but 50% of smokers develop COPD?--Report from the Obstructive Lung Disease in Northern Sweden Studies. Respir Med 2003: 97(2): 115-122.
46. Scanlon PD, Connett JE, Waller LA, Altose MD, Bailey WC, Buist AS. Smoking cessation and lung function in mild-to-moderate chronic obstructive pulmonary disease. The Lung Health Study. Am J Respir Crit Care Med 2000: 161(2 Pt 1): 381-390.
47. Tashkin DP, Detels R, Simmons M, Liu H, Coulson AH, Sayre J, et al. The UCLA population studies of chronic obstructive respiratory disease: XI. Impact of air pollution and smoking on annual change in forced expiratory volume in one second. Am J Respir Crit Care Med 1994: 149(5): 1209-1217.
48. Xu X, Dockery DW, Ware JH, Speizer FE, Ferris BG, Jr. Effects of cigarette smoking on rate of loss of pulmonary function in adults: a longitudinal assessment. Am Rev Respir Dis 1992: 146(5 Pt 1): 1345-1348.
49. Rennard SI, Vestbo J. COPD: the dangerous underestimate of 15%. Lancet 2006: 367(9518): 1216-1219.
50. Hersh CP, Demeo DL, Lazarus R, Celedon JC, Raby BA, Reilly JJ, et al. Genetic determinants of functional impairment in chronic obstructive pulmonary disease. Proc Am Thorac Soc 2006: 3(6): 476.
51. Sandford AJ, Pare PD. Genetic risk factors for chronic obstructive pulmonary disease. Clin Chest Med 2000: 21 (4): 633-643.
52. Silverman EK. Progress in chronic obstructive pulmonary disease genetics. Proc Am Thorac Soc 2006: 3(5): 405-408.
53. Eriksson S. Studies in alpha 1-antitrypsin deficiency. Acta Med Scand Suppl 1965: 432: 1-85.
54. Wood AM, de Pablo P, Buckley CD, Ahmad A, Stockley RA. Smoke exposure as a determinant of autoantibody titre in alpha-antitrypsin deficiency and COPD. Eur Respir J: 37(1): 32-38.
55. Mittman C, Lieberman J, Marasso F, Miranda A. Smoking and chronic obstructive lung disease in alpha -1-antitrypsin deficiency. Chest 1971: 60(3): 214-221.
56. Silverman EK, Province MA, Campbell EJ, Pierce JA, Rao DC. Family study of alpha 1-antitrypsin deficiency: effects of cigarette smoking, measured genotype, and their interaction on pulmonary function and biochemical traits. Genet Epidemiol 1992: 9(5): 317-331.
57. Strange C, Stoller JK, Sandhaus RA, Dickson R, Turino G. Results of a survey of patients with alpha-1 antitrypsin deficiency. Respiration 2006: 73(2): 185-190.
58. Silverman EK. Genetic Epidemiology of COPD. Chest 2002: 121(3 Suppl): 1S-6S.
59. Silverman EK, Palmer LJ, Mosley JD, Barth M, Senter JM, Brown A, et al. Genomewide linkage analysis of quantitative spirometric phenotypes in severe earlyonset chronic obstructive pulmonary disease. Am J Hum Genet 2002: 70(5): 1229-1239.
60. Hu G, Shi Z, Hu J, Zou G, Peng G, Ran P. Association between polymorphisms of microsomal epoxide hydrolase and COPD: results from meta-analyses. Respirology 2008: 13(6): 837-850.
61. Huang SL, Su CH, Chang SC. Tumor necrosis factoralpha gene polymorphism in chronic bronchitis. Am J Respir Crit Care Med 1997: 156(5): 1436-1439.
62. Curtis L, Rea W, Smith-Willis P, Fenyves E, Pan Y. Adverse health effects of outdoor air pollutants. Environ Int 2006: 32(6): 815-830.
63. Katsouyanni K, Touloumi G, Samoli E, Gryparis A, Le Tertre A, Monopolis Y, et al. Confounding and effect modification in the short-term effects of ambient particles on total mortality: results from 29 European cities within the APHEA2 project. Epidemiology 2001: 12(5): 521-531.
64. Abboud RT, Vimalanathan S. Pathogenesis of COPD. Part I. The role of protease-antiprotease imbalance in emphysema. Int J Tuberc Lung Dis 2008: 12(4): 361-367.
65. Laden F, Neas LM, Dockery DW, Schwartz J. Association of fine particulate matter from different sources with daily mortality in six U.S. cities. Environ Health Perspect 2000: 108(10): 941-947.
66. Abbey DE, Burchette RJ, Knutsen SF, McDonnell WF, Lebowitz MD, Enright PL. Long-term particulate and other air pollutants and lung function in nonsmokers. Am J Respir Crit Care Med 1998: 158(1): 289-298.
67. Bernstein JA, Alexis N, Bacchus H, Bernstein IL, Fritz P, Horner E, et al. The health effects of non-industrial indoor air pollution. J Allergy Clin Immunol 2008: 121 (3): 585-591.
68. Kampa M, Castanas E. Human health effects of air pollution. Environ Pollut 2008: 151(2): 362-367.
69. Franchi M, Carrer P, Kotzias D, Rameckers EM, Seppanen O, van Bronswijk JE, et al. Working towards healthy air in dwellings in Europe. Allergy 2006: 61(7): 864-868.
70. Bast A, Haenen GR, Doelman CJ. Oxidants and antioxidants: state of the art. Am J Med 1991: 91: 2S-13S.
71. Baldi S, Pinna GD, Crotti P, Montemartini S, Dacosto E, Fanfulla F, et al. Nutritional status and airflow obstruction: two independent contributors to CO diffusing capacity impairment in COPD. Monaldi Arch Chest Dis 2005: 63(1): 13-16.
72. Prescott E, Almdal T, Mikkelsen KL, Tofteng CL, Vestbo J, Lange P. Prognostic value of weight change in chronic obstructive pulmonary disease: results from the Copenhagen City Heart Study. Eur Respir J 2002: 20(3): 539-544.
73. Tsiligianni IG, van der Molen T. A systematic review of the role of vitamin insufficiencies and supplementation in COPD. Respir Res: 11: 171.
74. Wu TC, Huang YC, Hsu SY, Wang YC, Yeh SL. Vitamin E and vitamin C supplementation in patients with chronic obstructive pulmonary disease. Int J Vitam Nutr Res 2007: 77(4): 272-279.
75. Schwartz J, Weiss ST. The relationship of dietary fish intake to level of pulmonary function in the first National Health and Nutrition Survey (NHANES I). Eur Respir J 1994: 7(10): 1821-1824.
76. Sharp DS, Rodriguez BL, Shahar E, Hwang LJ, Burchfiel CM. Fish consumption may limit the damage of smoking on the lung. Am J Respir Crit Care Med 1994: 150(4): 983-987. 7
77. Kuempel ED, Wheeler MW, Smith RJ, Vallyathan V, Green FH. Contributions of dust exposure and cigarette smoking to emphysema severity in coal miners in the United States. Am J Respir Crit Care Med 2009: 180 (3): 257-264.
78. Schwartz J, Weiss ST. Dietary factors and their relation to respiratory symptoms. The Second National Health and Nutrition Examination Survey. Am J Epidemiol 1990: 132(1): 67-76.
79. Schwartz J, Weiss ST. Relationship between dietary vitamin C intake and pulmonary function in the First National Health and Nutrition Examination Survey (NHANES I). Am J Clin Nutr 1994: 59(1): 110-114.
80. Britton J, Pavord I, Richards K, Wisniewski A, Knox A, Lewis S, et al. Dietary magnesium, lung function, wheezing, and airway hyperreactivity in a random adult population sample. Lancet 1994: 344(8919): 357362.
81. Hnizdo E, Sullivan PA, Bang KM, Wagner G. Association between chronic obstructive pulmonary disease and employment by industry and occupation in the US population: a study of data from the Third National Health and Nutrition Examination Survey. Am J Epidemiol 2002: 156(8): 738-746.
82. Oxman AD, Muir DC, Shannon HS, Stock SR, Hnizdo E, Lange HJ. Occupational dust exposure and chronic obstructive pulmonary disease. A systematic overview of the evidence. Am Rev Respir Dis 1993: 148(1): 38-48.
83. Leuenberger P, Schwartz J, Ackermann-Liebrich U, et al. Passive smoking exposure in adults and chronic respiratory symptoms (SAPALDIA Study). Swiss Study on Air Pollution and Lung Diseases in Adults, SAPALDIA Team. Am J Respir Crit Care Med 1994: 150: 1222-1228.
84. Hendrick DJ. Occupational and chronic obstructive pulmonary disease (COPD). Thorax 1996: 51: 947-955.
85. Zock JP, Sunyer J, Kogevinas M, Kromhout H, Burney P, Anto JM. Occupation, chronic bronchitis, and lung function in young adults. An international study. Am J Respir Crit Care Med 2001: 163(7): 1572-1577.
86. Coggon D, Newman Taylor A. Coal mining and chronic obstructive pulmonary disease: a review of the evidence. Thorax 1998: 53(5): 398-407.
87. Cohen RA, Patel A, Green FH. Lung disease caused by exposure to coal mine and silica dust. Semin Respir Crit Care Med 2008: 29(6): 651-661.
88. Hnizdo E, Vallyathan V. Chronic obstructive pulmonary disease due to occupational exposure to silica dust: a review of epidemiological and pathological evidence. Occup Environ Med 2003: 60(4): 237-243.
89. Rushton L. Chronic obstructive pulmonary disease and occupational exposure to silica. Rev Environ Health 2007: 22(4): 255-272.
90. Davison AG, Fayers PM, Taylor AJ, Venables KM, Darbyshire J, Pickering CA, et al. Cadmium fume inhalation and emphysema. Lancet 1988: 1: 663-667.
91. Bakke PS, Baste V, Hanoa R, Gulsvik A. Prevalence of obstructive lung disease in a general population: relation to occupational title and exposure to some airborne agents. Thorax 1991: 46(12): 863-870.
92. Post WK, Heederik D, Kromhout H, Kromhout D. Occupational exposures estimated by a population specific job exposure matrix and 25 year incidence rate of chronic nonspecific lung disease (CNSLD): the Zutphen Study. Eur Respir J 1994: 7(6): 1048-1055.
93. Sethi S, Maloney J, Grove L, Wrona C, Berenson CS. Airway inflammation and bronchial bacterial colonization in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006: 173(9): 991-998.
94. Wedzicha JA, Seemungal TA. COPD exacerbations: defining their cause and prevention. Lancet 2007: 370 (9589): 786-796.
95. Seemungal T, Harper-Owen R, Bhowmik A, et al. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001: 164(9): 1618-1623.
96. Retamales I, Elliott WM, Meshi B, et al. Amplification of inflammation in emphysema and its association with latent adenoviral infection. Am J Respir Crit Care Med 2001: 164(3): 469-473.
97. Shaheen SO, Barker DJ, Holgate ST. Do lower respiratory tract infections in early childhood cause chronic obstructive pulmonary disease? Am J Respir Crit Care Med 1995: 151(5): 1649-1651; discussion 1651-1642.
98. Korppi M, Piippo-Savolainen E, Korhonen K, Remes S. Respiratory morbidity 20 years after RSV infection in infancy. Pediatr Pulmonol 2004: 38(2): 155-160.
99. Piippo-Savolainen E, Remes S, Kannisto S, Korhonen K, Korppi M. Early predictors for adult asthma and lung function abnormalities in infants hospitalized for bronchiolitis: a prospective 18- to 20-year follow-up. Allergy Asthma Proc 2006: 27(4): 341-349.
100. Miravitlles M, Naberan K, Cantoni J, Azpeitia A. Socioeconomic status and health-related quality of life of patients with chronic obstructive pulmonary disease. Respiration: 82(5): 402-408.
101. Yin P, Zhang M, Li Y, Jiang Y, Zhao W. Prevalence of COPD and its association with socioeconomic status in China: findings from China Chronic Disease Risk Factor Surveillance 2007. BMC Public Health: 11: 586.
102. Ulrik CS, Lange P. Decline of lung function in adults with bronchial asthma. Am J Respir Crit Care Med 1994: 150(3): 629-634.
103. Vignola AM, Paganin F, Capieu L, Scichilone N, Bellia M, Maakel L, et al. Airway remodelling assessed by sputum and high-resolution computed tomography in asthma and COPD. Eur Respir J 2004: 24(6): 910- 917.
104. Yilmaz S, Ekici A, Ekici M, Keles H. High-resolution computed tomography findings in elderly patients with asthma. Eur J Radiol 2006: 59(2): 238-243.
105. Hnizdo E, Singh T, Churchyard G. Chronic pulmonary function impairment caused by initial and recurrent pulmonary tuberculosis following treatment. Thorax 2000: 55(1): 32-38.
106. Menezes AM, Hallal PC, Perez-Padilla R, Jardim JR, Muino A, Lopez MV, et al. Tuberculosis and airflow obstruction: evidence from the PLATINO study in Latin America. Eur Respir J 2007: 30(6): 1180-1185.
107. Mishra B, Mehta S, Sinha ND, Shukla SK, Ahmed N, Kawatra A. Evaluation of work place stress in health university workers: a study from rural India. Indian J Community Med: 36(1): 39-44.
ARTICLE INFO
DOI: 10.12699/jfvp.3.8.2012.12
Conflict of Interest
Non
Date of manuscript receiving
21/11/2011
Date of publication after correction
15/7/2012
Article citation
Atsou K, Annesi-Maesano I, Chouaid C. COPD: definition, prevalence, etiology and medical-economic evaluation. J Func Vent Pulm 2012;03(08):12-26.