
 English
English
 French
French
Intérêt de l’endoscopie en fluorescence dans la BPCO
Interest of fluorescence endoscopy in COPD
L. Portel, J.P. Homasson
Association Franco-Vietnamienne de Pneumologie - AFVP
Centre Hospitalier Spécialisé en Pneumologie
24, rue Albert Thuret
94669, Chevilly Larue - France
Corresponding author
Dr Jean-Paul HOMASSON
Association Franco-Vietnamienne de Pneumologie. Chevilly-Larue
E-mail: jphomasson@wanadoo.fr
ABSTRACT
Patients with COPD have an increased risk of developing lung cancer. The prevalence of precancerous lesions of the proximal bronchial tree is higher among current smokers and former smokers, and patients exposed to various potentially carcinogenic agents.
For many years we know that the fluorescence of normal and cancerous tissues is different. The localized fluorescent default corresponds to an area in relation to pathological thickening of the bronchial mucosa. Then it may be a simple hyperplasia or inflammation with different stages: metaplasia, dysplasia, mild, moderate, severe, or carcinoma in situ and micro-invasive.
It is then very interesting to perform the fluorescence endoscopy in patients with COPD. This is a population at risk, but for reasons not least economically, most teams agrees to realize the fluorescence endoscopy for the patients having tobacco consumption from 20 to 30 package-year (PY).
So, in patients with COPD due to tobacco consumption more than 20 PY and/or professional etiology, practice fluorescence endoscopy associated with conventional endoscopy should be proposed if the equipment is available to do that. Defects in fluorescence should then be biopsied because the endoscopic appearance can not anticipate the evolution grade of the lesion.
KEYWORDS: COPD, lung cancer, fluorescence, endoscopy, metaplasia, dysplasia
RÉSUMÉ
Les patients atteints de BPCO ont un risque accru de développer un cancer bronchique. La prévalence des lésions précancéreuses de l’arbre bronchique proximal est élevée chez les fumeurs actifs et les anciens fumeurs, ainsi que chez les patients exposés à différents agents potentiellement cancérigènes.
Depuis de nombreuses années on sait que la fluorescence des tissus normaux et cancéreux est différente. Le défaut localisé de fluorescence correspond à une zone pathologique en rapport avec un épaississement de la muqueuse bronchique. Il peut alors s’agir d’une simple hyperplasie ou de différents stades d’inflammation: métaplasie, dysplasie légère, modérée, sévère ou de carcinome in-situ et micro-invasif.
C’est en fait tout l’intérêt de réaliser une endoscopie en fluorescence chez les patients présentant une BPCO. Il s’agit là d’une population à risque mais pour des raisons ne serait-ce qu’économique, la plupart des équipes s’accorde pour proposer cette endoscopie à partir d’une consommation de 20 à 30 PA.
Alors, chez les patients atteints de BPCO par tabagisme supérieur à 20 PA et/ou d’origine professionnelle, la pratique d’emblée d’une endoscopie en fluorescence doit être proposée, dans la mesure où l’on dispose du matériel. Tout défaut de fluorescence doit alors être biopsié car l’aspect endoscopique ne peut préjuger du grade évolutif de la lésion.
MOTS CLES: BPCO, cancer bronchique, fluorescence, endoscopie, métaplasie, dysplasie
INTRODUCTION
Les patients atteints de BPCO ont un risque accru de développer un cancer bronchique. La prévalence des lésions précancéreuses de l’arbre bronchique proximal est élevée chez les fumeurs actifs et les anciens fumeurs, ainsi que chez les patients exposés à différents agents potentiellement cancérigènes (amiante, chromates, hydrocarbures, substances radioactives…).
Ces substances peuvent être à l’origine de BPCO comme il est écrit dans le chapitre sur les maladies professionnelles [1, 2]. On a vu l’ intérêt de pratiquer une endoscopie bronchique chez ces patients, mais la détection de lésions précancéreuses en lumière blanche reste limitée même pour des endoscopistes entrainés. D’où l’intérêt de proposer aux patients une endoscopie en fluorescence qui va améliorer la détection de lésions précancéreuses et de cancers in situ.
TECHNIQUE ET PRINCIPE D’AUTOFLUORESCENCE
Depuis de nombreuses années on sait que la fluorescence des tissus normaux et cancéreux est différente. Cette fluorescence est difficilement détectable ; aussi on a initialement cherché à l’amplifier par l’injection intraveineuse de diverses drogues, fluorescéine [3], dérivés de l’hématoporphyrine [4] qui se fixent préférentiellement sur des zones pathologiques. Ces techniques insuffisamment spécifiques ou présentant trop d’effets secondaires (photo-sensibilisation) ont été abandonnées pour le dépistage des lésions précancéreuses, au profit de l’autofluorescence des tissus. Illuminés dans une longueur d’ondes proche de l’ultra-violet, les tissus émettent une faible fluorescence provenant de chromophores cellulaires et tissulaires. La technique a été initialement décrite par Lam [5, 6] avec le système LIFE actuellement abandonné. L’élastine est l’élément le plus fluorescent.
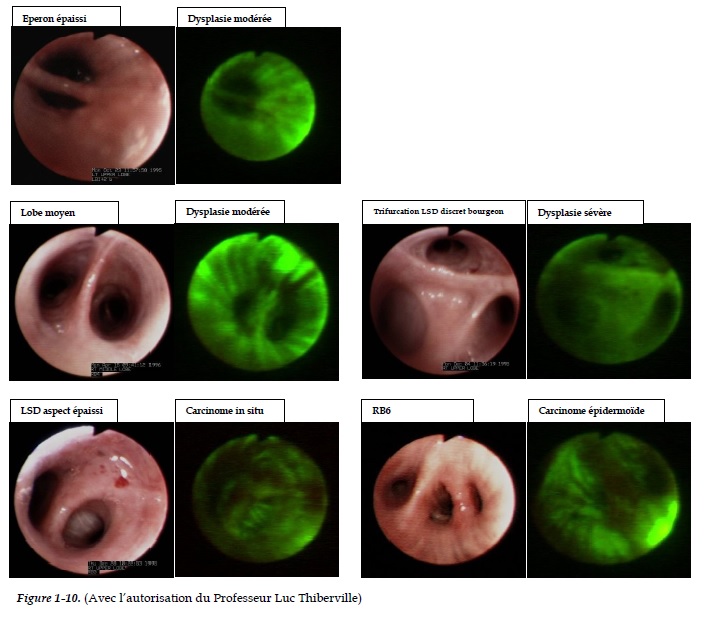
Les techniques ont progressivement évoluées et le coût du matériel a fortement diminué. L’illumination nécessite une source lumineuse au xénon de forte puissance. Les bronches apparaissent colorées (bleu, vert, rouge selon les types de matériel). Le défaut localisé de fluorescence correspond à une zone pathologique en rapport avec un épaississement de la muqueuse bronchique. Il peut alors s’agir d’une simple hyperplasie ou de différents stades d’inflammation: métaplasie, dysplasie légère, modérée, sévère ou de carcinome in-situ et micro-invasif (Figures 1 -10).
Les systèmes d’autofluorescence actuellement disponibles (Storz ; Wolf ; Pentax etc…) sont globalement équivalents et plus maniables que le système LIFE [7, 8].
DEPISTAGE DES LESIONS PRECANCEREUSES DE BAS GRADE
C’est en fait tout l’intérêt de réaliser une endoscopie en fluorescence chez les patients présentant une BPCO. Il s’agit là d’une population à risque mais pour des raisons ne serait-ce qu’économique, la plupart des équipes s’accorde pour proposer cette endoscopie à partir d’une consommation de 20 à 30 PA. Les lésions sont souvent minimes et l’endoscopie doit être à la fois minutieuse et prudente. Le nombre de faux positifs peut être important. Ils sont liés à des traumatismes au cours de l’endoscopie. La toux, fréquente chez ces patients lors de l’examen peut entrainer des hémorragies localisées réalisant un déficit de fluorescence [9]. Si l’on reconnaît la supériorité de l’examen en fluorescence par rapport à la lumière blanche pour détecter des aspects lésionnels souvent discrets, la rentabilité de l’examen reste cependant opérateur-dépendant mais également expérience-dépendant [10].
EVOLUTIVITE DES LESIONS BRONCHIQUES PRECANCEREUSES
La proportion de lésions précancéreuses qui va évoluer vers une lésion de plus haut grade n’est pas connue. De même la durée requise pour passer à un stade évolutif supérieur n’est pas connue. L’évolution « classique »: métaplasie, dysplasie légère, modérée, sévère et carcinome in-situ ne concerne que les carcinomes épidermoïdes ; ou la proportion d’adénocarcinomes, le plus souvent distaux est de plus en plus importante. Cette remarque peut limiter partiellement l’intérêt du dépistage par fluorescence. Une étude réalisée au CHU de Rouen [11] sur 100 patients et 321 sites bronchiques biopsiés de façon itérative a été poursuivie 18 mois. Les résultats sont rapportés Tableau I.
Seulement 1,5% des métaplasies et 2% des dysplasies de bas grade ont progressé vers des lésions de grade supérieur. Les autres restent au même grade ou vont disparaître. Ainsi 68% des dysplasies sévères va régresser sans traitement. L’influence du sevrage tabagique sur la régression des lésions de haut grade est probable, mais non constante. Les autres lésions persistent ou évoluent vers un grade supérieur de carcinome in-situ. 10% des carcinomes in-situ sont susceptibles de régresser ; les autres restent au même stade ou vont évoluer vers un cancer invasif. Ces données résultent d’une seule étude et sont donc à considérer avec grande prudence. D’autres études de suivi longitudinal endoscopique ont montré que 85% des carcinomes in-situ et 30% des lésions dysplasiques sévères persistent ou progressent dans un délai de 2 ans sans traitement. Aussi une vaste étude nationale française multicentrique a-t-elle été mise en place par Luc Thiberville dès 2006 pour évaluer l’évolutivité des lésions précancéreuses de bas grade suivies en endoscopie en fluorescence (étude SELEPREBB). Les résultats sont attendus pour 2012.
QUE FAIRE DES LESIONS DE HAUT GRADE ?
L’étude SELEPREBB nous donnera une orientation sur le suivi endoscopique éventuel des lésions de bas grade. Pour les lésions de haut grade, il n’y a pas actuellement de traitement de référence. Il semble cependant que les carcinomes in-situ ne doivent plus être traités chirurgicalement mais par endoscopie interventionnelle. La cryothérapie a fait la preuve de son efficacité (12) mais des résultats identiques peuvent être attendus avec la thermocoagulation HF. La photochimiothérapie peut être une alternative plus onéreuse. La tendance actuelle est de traiter par voie endoscopique les hyperplasies sévères et pour certains anatomopathologistes, le traitement des dysplasies modérées pourrait être envisagé, compte tenu de l’innocuité des traitements proposés par cryothérapie ou thermocoagulation.
CONCLUSION
Chez les patients atteints de BPCO par tabagisme supérieur à 20 PA et/ou d’origine professionnelle, la pratique d’emblée d’une endoscopie en fluorescence doit être proposée, dans la mesure où l’on dispose du matériel. Tout défaut de fluorescence doit alors être biopsié car l’aspect endoscopique ne peut préjuger du grade évolutif de la lésion. Mais l’exploration reste limitée à la partie proximale de l’arbre bronchique et en pratique aux seules lésions précédant les carcinomes épidermoïdes. La surveillance endoscopique des lésions de bas grade reste à définir. Les lésions de haut grade doivent traitée par voie endoscopique.
CONFLIT D’INTERÊT
Aucun.
REFERENCES
1. PARIS C , THIBERVILLE L., EBRAN B., HUONG D., METAYER J., NOUVET G., CAILLARD J.F. Prévalence of bronchial preneoplasia after occupational exposure to asbestos. A preliminary study using autofluorescence endoscopy. “Ninth International Conference on Occupational Respiratory Diseases” Kyoto, Japan Expert Medica International Congress Series 1198 ; 1153.
2. PETERS E.J., MORICE R., BENNER S.E., LIPPMAN S., LUKEMAN J., LEE JS, ROJY, HONG W.K. Squamous metaplasia ot the bronchial mucosa and its relationship to smoking Chest 1993 ; 103 : 1429-1932.
3. HOMASSON J.P., BONNIOT J.P., ANGEBAULT M., RENAULT P., CARNOT F., SANTELLI G. Fluorescence as a guide to bronchial biopsy. Thorax 1985 ; 40 : 38-40.
4. LIPSON R.L., BLADES E.J., OLSEN A.M. Hematoporphyrin derivative : a new. aid for the endoscopic detection of malignant disease.J. Thorac. Cardiovasc. Surg. 1961 ; 42 : 623-629.
5. HUNG J., LAM S., LERICHE J.C., PALCIC B. Autofluorescence of normal and malignant bronchital tissue. Lasers Surg. Med. 1991 ; 11 : 99-105.
6. AM S., MAC AULAY C., HUNG J., LERICHE J.C.PROFIO A.E., PALCIC B. Detection of dysplasia and CIS with a lung imaging fluorescence endoscopy device. J. Thorac. Cardiovasc. Surg. 1993 ; 105 : 1035-1040.
7. IERARD Ph., MARTIN B., VERDEBOUT J.M., FABER J., RICHEZ M., SCULIER J.P., NINANE V. Journal of bronchology 2011 ;
8 : 254-259. 8. HOMASSON J.P., ANGEBAULT M., NGUYEN BICH N. Autofluorescence bronchique. Etude préliminaire portent sur deux systèmes sans illumination laser ni photosensibilisant. Rev. Pneumol. Clin. 2001 ; 57 : 202205.
9. THIBERVILLE L., PARIS C., Quelle place pour la photodétection endoscopique du cancer bronchique non à petites cellules ? Oncologie 2002 ; 4 : 234-236.
10. THIBERVILLE L., NINAVE V., VERMYLEN P. Le diagnostic endoscopique des lésions précancéreuses bronchiques. Rev. Mal. Resp. 2000 ; 17 : 351-355.
11. THIVERVILLE L. Place des techniques endoscopiques endobronchiques pour la détection des cancers bronchiques Arch. Mal. Prof. 1999 ; 60 : 263-269.
12. DEYGAS N., FROUDRARAKIS M., OZENNE G., VERGNON J.M. Cryotherapy in early superficial bronchogenic carcinoma. Chest 2001 ; 120 : 26-31.
FIGURE/TABLE

REFERENCES
1. PARIS C , THIBERVILLE L., EBRAN B., HUONG D., METAYER J., NOUVET G., CAILLARD J.F. Prévalence of bronchial preneoplasia after occupational exposure to asbestos. A preliminary study using autofluorescence endoscopy. “Ninth International Conference on Occupational Respiratory Diseases” Kyoto, Japan Expert Medica International Congress Series 1198 ; 1153.
2. PETERS E.J., MORICE R., BENNER S.E., LIPPMAN S., LUKEMAN J., LEE JS, ROJY, HONG W.K. Squamous metaplasia ot the bronchial mucosa and its relationship to smoking Chest 1993 ; 103 : 1429-1932.
3. HOMASSON J.P., BONNIOT J.P., ANGEBAULT M., RENAULT P., CARNOT F., SANTELLI G. Fluorescence as a guide to bronchial biopsy. Thorax 1985 ; 40 : 38-40.
4. LIPSON R.L., BLADES E.J., OLSEN A.M. Hematoporphyrin derivative : a new. aid for the endoscopic detection of malignant disease.J. Thorac. Cardiovasc. Surg. 1961 ; 42 : 623-629.
5. HUNG J., LAM S., LERICHE J.C., PALCIC B. Autofluorescence of normal and malignant bronchital tissue. Lasers Surg. Med. 1991 ; 11 : 99-105.
6. AM S., MAC AULAY C., HUNG J., LERICHE J.C.PROFIO A.E., PALCIC B. Detection of dysplasia and CIS with a lung imaging fluorescence endoscopy device. J. Thorac. Cardiovasc. Surg. 1993 ; 105 : 1035-1040.
7. IERARD Ph., MARTIN B., VERDEBOUT J.M., FABER J., RICHEZ M., SCULIER J.P., NINANE V. Journal of bronchology 2011 ;
8 : 254-259. 8. HOMASSON J.P., ANGEBAULT M., NGUYEN BICH N. Autofluorescence bronchique. Etude préliminaire portent sur deux systèmes sans illumination laser ni photosensibilisant. Rev. Pneumol. Clin. 2001 ; 57 : 202205.
9. THIBERVILLE L., PARIS C., Quelle place pour la photodétection endoscopique du cancer bronchique non à petites cellules ? Oncologie 2002 ; 4 : 234-236.
10. THIBERVILLE L., NINAVE V., VERMYLEN P. Le diagnostic endoscopique des lésions précancéreuses bronchiques. Rev. Mal. Resp. 2000 ; 17 : 351-355.
11. THIVERVILLE L. Place des techniques endoscopiques endobronchiques pour la détection des cancers bronchiques Arch. Mal. Prof. 1999 ; 60 : 263-269.
12. DEYGAS N., FROUDRARAKIS M., OZENNE G., VERGNON J.M. Cryotherapy in early superficial bronchogenic carcinoma. Chest 2001 ; 120 : 26-31.
ARTICLE INFO
DOI: 10.12699/jfvp.3.8.2012.27
Conflict of Interest
Non
Date of manuscript receiving
12/3/2012
Date of publication after correction
15/7/2012
Article citation
Portel L, Homasson J.P. Interest of fluorescence endoscopy in COPD. J Func Vent Pulm 2012;03(08):27-30.