
 English
English
 French
French
Prognostic factors of non-small cell lung cancer in advanced stages
Les facteurs pronostiques du cancer bronchique non à petites cellules aux stades avancés
S. Bacha, S. Habibech, S. Cheikhrouhou, H. Racil, N. Chaouch, A. Sghaier, A. Chabbou
Service de Pneumologie 2. Hôpital Abderrahmane Mami Ariana. Tunisie
Corresponding author
Dr. BACHA Saoussen
12 Rue Abbes Ibn Ferness. Cité la Gazelle Arian 2083. Tunisie
E-mail: saoussenbacha@yahoo.fr
ABSTRACT
Background. Lung cancer is one of the most frequently occurring neoplasms and is the leading cause of death by cancer worldwide. Although management of NSCLC has continued to improve, the prognosis remains poor. The aim of this study was to assess prognosis factors of locally or metastatic NSCLC.
Materials and methods. It is a retrospective study, including patients with locally advanced and metastatic NSCLC, diagnosed in our department between 2005 and 2013.
Results. We included 142 patients with a mean age of 60 years. All patients were male. The cancer was at stage IIIB in 36.6% of cases and IV in 76.1% of cases. One hundred thirty five patients (95%) were smokers. PS was 0-1 in 80.3% of cases. Pathologic analysis leads to adenocarcinoma in 50.7% of cases and squamous cell carcinoma in 25.4% of cases. Chemotherapy was performed in 69% of patients; 36% of patients received radiotherapy. Overall survival was 8.9 months. Overall survival at 6 and 12 months was 67% and 36%. Better survival was observed in patients aged less than 65 years (HR=2.05; p=0.012), having better performance status (PS) (HR=2.79; p=0.015), having the CRP level less than 10mg/l (HR=2.60; p=0.007) and who received chemotherapy (HR=9.85; p<0.0001).
Conclusion. The prognosis factors in advanced NSCLC in this study were age, PS, receiving chemotherapy and CRP. They should be considered by physicians to improve management of advanced NSCLC.
KEYWORDS: Non-small cell lung cancer, prognosis factors, survival.
RÉSUMÉ
Introduction. Le cancer broncho-pulmonaire est le cancer le plus meurtrier dans le monde. Malgré les différentes avancées thérapeutiques, son pronostic demeure mauvais. Le but de notre étude est d’évaluer les facteurs pronostiques du cancer broncho-pulmonaire non à petites cellules (CBPNPC) aux stades avancés.
Matériels et méthodes. Il s’agit d’une étude rétrospective incluant tous les patients présentant un CBPNPC stade IIIB et IV pris en charge entre Janvier 2005 à Janvier 2013.
Résultats. Nous avons colligé 142 patients. La moyenne d’âge était de 60 ans. Tous les patients étaient de sexe masculin. Le cancer était classé stade IIIB et IV dans respectivement 36,6% et 76,1% des cas. Cent trente-cinq patients (95%) étaient des fumeurs actifs. Le performans status était 0-1 dans 80,3% des cas. Il s’agissait d’un adénocarcinome dans 50,7% des cas et d’un carcinome épidermoïde dans 25,4% des cas. Soixante-neuf pour cent et 36% des patients avaient reçu respectivement une chimiothérapie et une radiothérapie. La survie médiane était de 8,9 mois. Les probabilités de survie à 6 et 12 mois étaient respectivement de 67% et 36%. En analyse multivariée, le PS<2 (HR=2,79; p=0,015), l’âge < 65 ans (HR=2,05; p=0,012), un taux de CRP < 10mg/l (HR=2,60; p=0,007) et l’administration de la chimiothérapie (HR=9,85; p<0,0001) étaient des facteurs de meilleure survie.
Conclusion. Les facteurs pronostiques du CBPNPC stade IIIB et IV dans cette étude sont l’âge, le PS, l’administration de la chimiothérapie et la CRP. Ils doivent être pris en considération afin d’optimiser la prise en charge des patients.
MOTS CLÉS: Cancer bronchique non à petites cellules, facteurs pronostiques, survie.
INTRODUCTION
Le cancer broncho-pulmonaire primitif est la première cause de décès par cancer chez la population masculine à l’échelle mondiale et nationale [1-3]. Sur le plan anatomopathologique, le carcinome non micro-cellulaire est de loin le plus fréquent, rencontré dans plus des trois quarts des cas [1, 4]. Plus de la moitié des cas des carcinomes broncho-pulmonaires non à petites cellules (CBPNPC) sont diagnostiqués aux stades localement avancés et métastatiques [2, 3]. Moins de 15% des patients seront finalement guéris expliquant entre autres le mauvais pronostic du CBPNPC [1-4]. En dépit des progrès indéniables, les ressources thérapeutiques disponibles pour ces patients demeurent d’efficacité modeste et de toxicité non négligeable. La stratification pronostique concourt ainsi à l’amélioration de la qualité de vie en épargnant au patient les effets iatrogènes d’un traitement lourd et inutile. De nombreux auteurs avaient ainsi cherché des facteurs pronostiques permettant de prédire le futur du patient notamment la survie indépendamment du traitement reçu. Les facteurs pronostiques sont surtout importants à connaitre également à un niveau collectif pour interpréter les données de la littérature et guider la recherche clinique. Dans ce cadre, nous avons mené un travail rétrospectif dont le but était d’étudier les facteurs pronostiques du CBPNPC aux stades avancés (stade IIIB et IV) chez une population tunisienne de sexe masculin.
PATIENTS ET MÉTHODES
C’est une étude rétrospective incluant tous les patients admis dans notre service de pneumologie sur une période de 8 ans allant de Janvier 2005 à Janvier 2013, et chez lesquels le diagnostic de cancer broncho-pulmonaire primitif était retenu. N’étaient inclus dans notre étude que les patients présentant un cancer bronchique non à petites cellules confirmés histologiquement et classé stade IIIB ou IV selon la septième édition de la classification TNM (2009). L’extension tumorale thoracique et à distance était évaluée par une tomodensitométrie thoraco-abdominale et cérébrale et une endoscopie bronchique chez tous nos patients. Les dossiers datant d’avant 2009 et classés selon des éditions TNM plus anciennes étaient tous révisés et reclassés selon la septième édition en nous basant sur les données de l’imagerie initiale. Le recueil des données était réalisé à partir du dossier médical et avait concerné essentiellement les données cliniques et radiologiques, les modalités thérapeutiques et les données relatives à la survie sans progression et la survie globale. La réponse tumorale était évaluée selon les critères Response Evaluation Criteria in Solid Tumors (RECIST) dans sa version 1.1. La date de point était fixée au 12 juin 2015.
Statistiques
La recherche des facteurs pronostiques de survie était effectuée en analyse univariée (facteur par facteur) en comparant les courbes de survie par le test du Log Rank. Les courbes de survie étaient dressées selon la méthode de Kaplan Meier. Une analyse multivariée par régression Cox avec une méthode descendante pas à pas était conduite permettant de calculer des risques relatifs ajustés, mesurant le rôle propre de chaque facteur (les facteurs introduits sont ceux dont le p<0,05 dans l’analyse univariée ainsi que ceux dont le p est compris entre 0,05 et 0,2). Les facteurs inclus dans le modèle mutivarié étaient l’âge<65 ans, le PS 0-1, l’administration de la chimiothérapie, la CRP<10 mg/l et l’histologie. Le seuil de signification statistique était fixé à 0,05.
RÉSULTATS
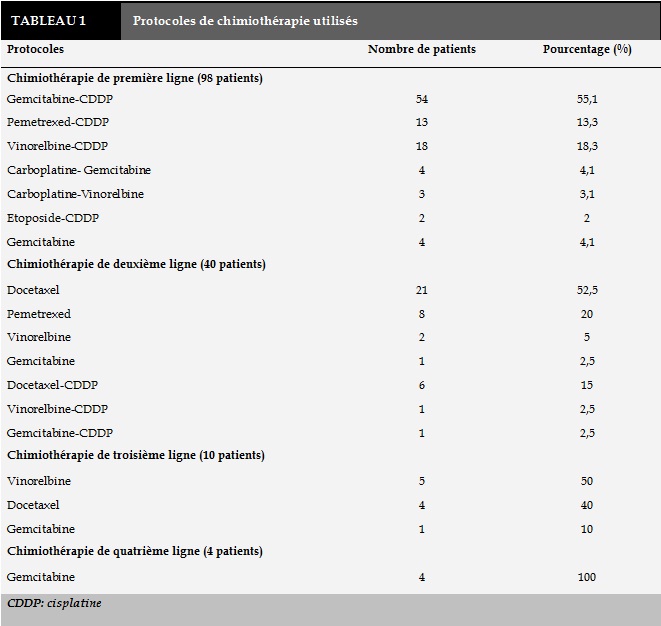
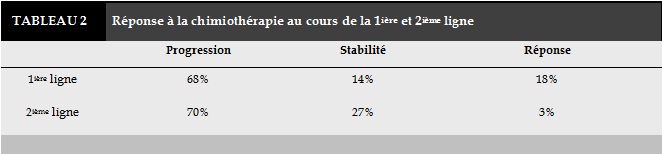
Parmi les patients hospitalisés entre Janvier 2005 et Janvier 2013 pour suspicion de cancer broncho-pulmonaire, 142 patients répondaient aux critères d’inclusion. L’âge médian des patients était de 60 ans avec des extrêmes allant de 37 à 82 ans; 36% des patients appartenaient à la tranche d’âge entre 55 et 65 ans. Tous les patients étaient de sexe masculin vu le mode de recrutement de notre service. Cent trente-cinq patients soit 95% étaient des fumeurs actifs au moment du diagnostic. Sept patients seulement étaient non tabagiques. La consommation tabagique médiane était de 43 paquets-années (PA). Une consommation tabagique de plus de 20 PA était retrouvée chez 88% des patients. Le sevrage tabagique après le diagnostic de CBPNPC n’était réalisé que chez 39,9% des patients tabagiques. Soixante-quatre patients (45%) n’avaient aucune tare associée. Les comorbidités respiratoires étaient notées chez vingt-sept patients (19%). Il s’agissait de broncho-pneumopathie chronique obstructive (BPCO) chez 19 patients suivis par l’hypertension artérielle chez 16 patients. Le diabète était noté dans 21 cas (14,7%). L’évaluation de l’état général avait montré un PS 0-1 dans 80,3% des cas, un PS à 2 dans 9,2% des cas et un PS à 3 dans 2,8% des cas. Il s’agissait d’un adénocarcinome dans 50,7% des cas, d’un carcinome épidermoïde dans 25,4% des cas et d’un carcinome non typé dans 19,7% des cas. Il s’agissait d’un stade IIIB dans 23,9% des cas et d’un stade IV dans 76,1% des cas. La taille tumorale variait entre des extrêmes de 12mm à 130 mm avec une moyenne à 70mm. La majorité des patients (90,2%) présentaient un stade T3 ou T4. Vingt-quatre patients seulement (16,9%) avaient un stade N0 ou N1. Les patients ayant un seul site métastatique au moment du diagnostic représentaient la proportion la plus importante soit 45,2% des cas. Trente-quatre (23,9%) et 10 patients (7%) présentaient respectivement deux et trois sites métastatiques ou plus au moment du diagnostic. Soixante-neuf pour cent des patients avaient bénéficié d’au moins une ligne de chimiothérapie. Quarante-quatre patients (31%) n’avaient reçu aucune chimiothérapie. Quarante (28,2%) et 10 patients (7%) avaient reçu respectivement une deuxième et une troisième ligne ou plus de chimiothérapie. L’abstention thérapeutique d’emblée était due au PS altéré (PS≥3) chez 50% des cas, au décès du patient ou sa perte de vue dans 50% des cas. La chimiothérapie de première ligne était à base de sels de platine dans 93% des cas. Le docétaxel en monothérapie était la drogue la plus utilisée au cours de la deuxième ligne (soit dans 54% des cas) (Tableau 1). Qu’il s’agisse de la première ou de la deuxième ligne, la progression tumorale était l’évolution la plus fréquente (Tableau 2).
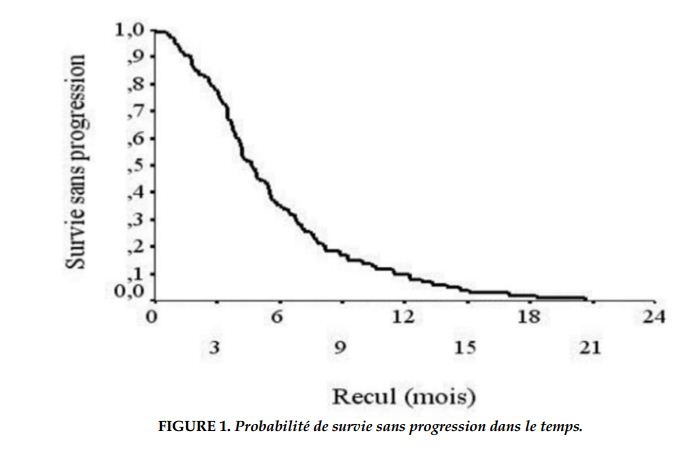
La radiothérapie était réalisée chez 52 patients (36,6%). Il s’agissait d’une radiothérapie thoracique et cérébrale dans respectivement 19% et 16,9% des cas. La chirurgie palliative était indiquée chez 10 patients (pleurodèse chez 9 patients et une métastasectomie cérébrale chez un patient). La médiane de survie sans progression était de 5,15 mois (l’intervalle de confiance IC à 95% [4,2-6]) avec des extrêmes allant de 0,6 mois à 20,7 mois (Figure 1).Les probabilités de survie sans progression à 3 et 6 mois étaient respectivement de 77% et 36%.
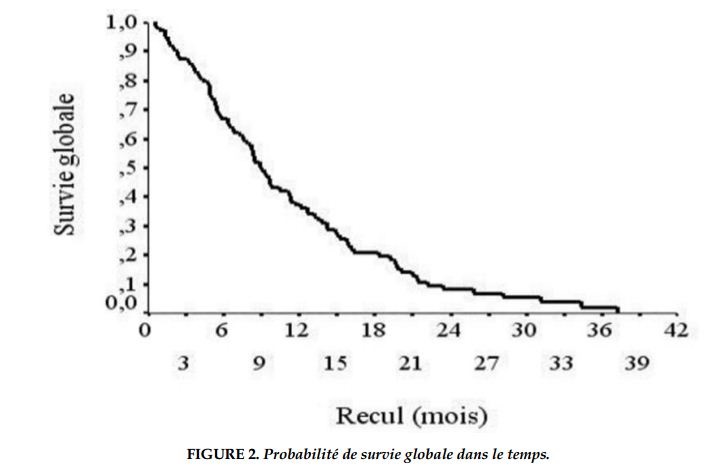
En analyse multivariée, seuls le tabagisme inférieur à 43 PA (HR=2,61; p=0,045) et un nombre de métastases à l’admission inférieur à 2 étaient des facteurs prédictifs indépendants de meilleure survie sans progression (HR=2,9; p=0,0047). Concernant la survie globale, nous n’avons pu obtenir la date de décès que chez 73% des patients. Le reste des patients étaient considérés comme perdus de vue. La médiane de survie globale était de 8,9 mois (IC à 95% [7,75-10,11]) avec des extrêmes allant de 0,5 mois à 37,2 mois (Figure 2).
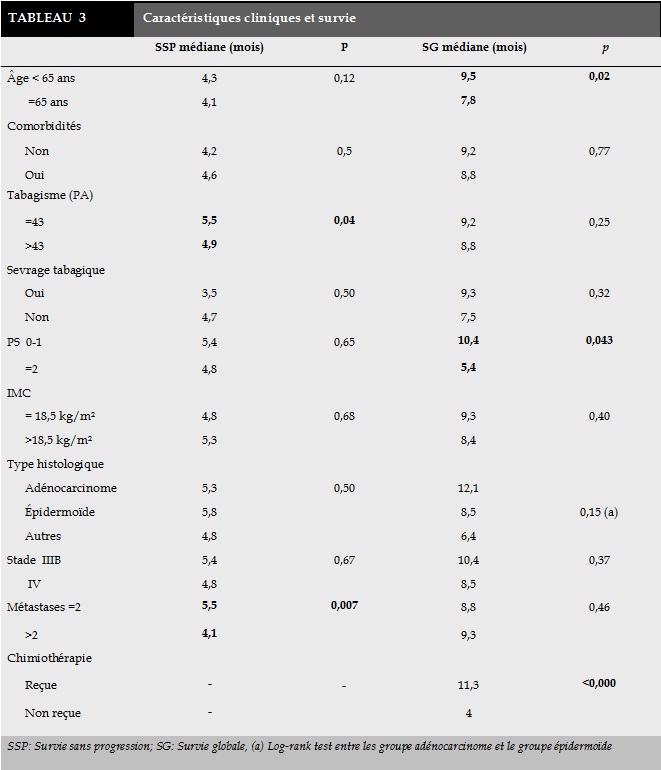
Les probabilités de survie à 6 et 12 mois étaient respectivement estimées à 67% et 36%. L’analyse univariée avait montré une meilleure survie en cas d’âge<65 ans, un PS 0-1 et de traitement par chimiothérapie (Tableau 3). Sur le plan biologique, la médiane de survie globale était de 8,3 mois contre 14,8 mois respectivement chez les patients ayant une CRP inférieure à 10 mg/L et ≥10 mg/L (p=0,002). Une leucocytose normale, un taux de plaquettes normal et une hémoglobine ≤12 n’étaient pas associée à une meilleure survie dans l’analyse univariée.
En analyse multivariée, le PS<2 (HR=2,79; p=0,015), l’âge inférieur à 65 ans (HR=2,05; p=0,012), un taux de CRP inférieur à 10mg/l (HR=2,60; p=0,007) et l’administration de la chimiothérapie (HR=9,85; p<0,0001) étaient retenus comme des facteurs indépendants de meilleure survie.
DISCUSSION
Notre étude avait montré que le PS inférieur à 2, l’âge inférieur à 65 ans, un taux de CRP inférieur à 10mg/l et l’administration de la chimiothérapie étaient retenus comme des facteurs indépendants de meilleur pronostic dans le CBPNPC stade IIIB et IV dans une population tunisienne de patients de sexe masculin. Un tabagisme important en PA et un nombre de site métastatique supérieur à 2 étaient prédictifs d’une mauvaise survie sans progression. Des grandes différences de survie sont observées pour des patients de même stade, incitant à la recherche d’autres facteurs pronostiques afin de mieux guider la stratégie thérapeutique. Plus de 150 facteurs pronostiques se rapportant à la tumeur, au patient ou à l’environnement étaient identifiés dans la littérature [5].
Dans une étude rétrospective de l’International Association for the Study of Lung cancer (IASLC) incluant 12428 patients, l’analyse multivariée avait montré que le stade d’extension de la maladie élevé, l’âge avancé, le PS altéré, le sexe masculin et l’histologie non épidermoïde étaient des facteurs de mauvais pronostic indépendamment du stade du CBPNPC sauf pour l’histologie qui n’était significatif que pour les stades avancés et métastatiques [6]. Dans une étude du Surveillance, Epidemiology, and End results (SEER) registry considérant 52 287 patients ayant un cancer non métastatique, l’âge avancé, le sexe masculin, l’importance de la taille tumorale, l’extension locale/ganglionnaire étaient associés à un pronostic péjoratif [7].
L’histologie était un facteur pronostique cependant les adénocarcinomes s’avéraient de meilleur pronostic que les épidermoïdes et les carcinomes à grandes cellules [7]. Une autre étude rétrospective incluant 11094 patients de stade IV avait montré que l’âge, le sexe et l’histologie étaient des facteurs pronostiques significatifs pour la survie en analyse multivariée [8]. De plus, plus le nombre des sites métastatiques augmentait, plus mauvais était le pronostic: (HR=1,38 ; p<0,001) et (HR=1,97 ; p<0,001) respectivement en cas de 2 ou ≥3 organes atteints dans la même étude [9].
Dans notre étude, l’âge <65 ans s’est avéré un facteur indépendant de meilleur survie globale avec un HR de 2,05. Dans une revue des études publiées entre 2000 et 2010, Cuyun Carter et al avaient relevé trente-neuf études portant sur l’âge dont seules quatre avaient mis en évidence une association significative entre l’âge avancé et une mauvaise survie [9]. Concernant le sexe, dans une revue systématique avec méta analyse incluant 39 publications (86800 patients), un meilleur pronostic était associé au sexe féminin (HR=0,78; p<0,0001) indépendamment du stade d’extension, du sous type histologique ou du statut tabagique [10]. Toutefois, Dans notre étude, la valeur pronostique du sexe n’a pas pu être étudié vu le mode de recrutement exclusivement masculin de notre service. Le PS est l'un des facteurs les plus rapportés et admis dans la littérature. Mesuré par l'échelle de Karnofsky ou de l'ECOG, il demeure encore le gold standard et conditionne la décision thérapeutique selon les guidelines [11].
Un PS ≥ 2 était un facteur indépendant de mauvaise survie globale avec un HR de 2,79 (IC à 95%: [1,29-6,02]) dans cette étude. Dans une revue de la littérature, Cuyun Carter et al avaient relevé 42 études publiées entre 2000 et 2010 évaluant le PS comme facteur pronostique [9]. Trente-six études (soit 73%) avaient rapporté une association significative entre un PS altéré et une survie globale et/ou sans progression moindre. Dans notre étude, le PS n'était pas associé de façon statistiquement significatif à la survie sans progression. Ce résultat dévoile effectivement certaines limites inhérentes au PS. Car bien qu'un PS altéré soit prédictif d'une faible survie à court terme, l'évolution des patients ayant un bon PS initial est plutôt imprévisible. Ces patients peuvent manifester une détérioration rapide de leur PS [12, 13]. Ainsi, sa valeur pronostique est néanmoins limitée dans le temps, et ne permet point d'affiner la stratification au plus long terme pour le sous-groupe de patients ayant un bon PS initial [14].
Le tabagisme est retrouvé dans plusieurs études comme facteur pronostique indépendant pour la survie [15]. Dans notre étude la survie sans progression était significativement écourtée an cas de tabagisme>43 PA (p=0,04). Cependant, le tabagisme n’était pas associé de façon significative à la survie globale. L’extension de la maladie reste un facteur pronostique important et le stade TNM est irréfutablement la référence en matière de pronostic et de prise en charge [10]. Certains travaux se sont proposés d’étudier la différence de survie entre le stade IIIB et IV et avaient noté une meilleure survie pour un stade moins avancé mais, similairement à nos résultats, cette différence n’était pas toujours significative [9]. D’autres facteurs étaient également rapportés tels que le nombre et la localisation des métastases, notamment l’absence de métastases cutanées [9]. Toutefois, dans cette étude, le nombre de métastases s’avérait un facteur indépendant de survie sans progression mais pas de survie globale.
Le rôle de l'histologie en tant que facteur pronostique est hautement débattu dans la littérature. Ainsi la valeur péjorative accordée par certaines études au carcinome épidermoïde et pour d’autres à l’adénocarcinome reste un sujet de controverses [16].
Dans une étude publiée en 2009, les auteurs avaient trouvé une survie moins bonne pour les patients atteints de carcinomes à grandes cellules et une meilleure survie pour les patients atteints de carcinome épidermoïde [17]. D’autres études n’avaient noté aucune association entre le type histologique et la survie [18]. Dans notre étude, les patients ayant un adénocarcinome avaient la meilleure survie globale même si la différence n’était pas statistiquement significative.
A côté des facteurs cliniques, des facteurs biologiques étaient également étudiés pour prédire le pronostic dans les cancers. Un taux de LDH sanguin normal, une leucocytose normale et l’absence d’anémie seraient des éléments de bon pronostic dans la littérature [19]. Plusieurs études suggèrent que des taux circulants élevés de CRP étaient associés à un mauvais pronostic indépendamment du stade de la tumeur, et ceci semble être valable aussi bien chez les patients atteints de cancer opérable que ceux présentant des stades avancés [20, 21]. Dans cette étude, seul le taux de CRP<10mg/L s’avérait un facteur prédictif indépendant de meilleure survie globale.
A côté des facteurs cliniques et biologiques, un facteur métabolique était rapporté dans la littérature à savoir la mesure semi quantitative de la captation d’un analogue du glucose par la tumeur (SUV).
La valeur pronostique de cette mesure dans le CBPNPC était démontrée par une méta-analyse de Berghmans [22]. La réponse métabolique à la chimiothérapie était également rapportée comme étant un facteur pronostique dans le CBPNPC aux stades avancés [23,24]. Cette étude comporte des limites inhérentes essentiellement à son caractère rétrospectif et monocentrique et au biais de sélection avec un recrutement des patients uniquement de sexe masculin. Toutefois ce travail apporte des renseignements utiles sur le pronostic du CBPNPC stade IIIB et IV chez les sujets de sexe masculin en Tunisie.
CONCLUSION
L’administration de chimiothérapie, un PS inférieur à 2, l’âge inférieur à 65 ans et une CRP<10 sont des facteurs prédictifs de meilleure survie globale en cas de CBPNPC stade IIIB et IV chez le sujet de sexe masculin dans cette étude tunisienne. La consommation tabagique dépassant 43 PA et un nombre de métastases supérieur à deux étaient les seuls facteurs indépendants de meilleure survie sans progression. Ces facteurs pronostiques doivent être pris en considération afin de guider le clinicien pour optimiser la prise en charge des patients et sont utiles également dans le cadre des essais thérapeutiques ou dans la comparaison de groupes de patients.
CONFLIT D’INTÉRÊT
Aucun.
RÉFÉRENCES
1. Lazaar Ben Gobrane H, Hajjem S, Aounallah Skhiri H, Achour N, Hsairi M. Mortalité par cancer en Tunisie: Calcul des années de vie perdues. Santé Publique 2011; 23(1):31-40.
2. Fajraoui N, Charfi MR, Khouani H Annabi H, Bouhaouala MH, Boussen H et al. Clinical epidemiology of primary lung cancer in Tunisia.100 cases. Tunis Med 2007; 85(9): 766-72.
3. Chaari A, Ben Nasr S, Labidi S, Afrit M, Boussen H. Cancer non à petites cellules métastatique : étude tunisienne rétrospective à propos de 100 cas. Tunis Med 2015; 93(5): 294-669.
4. Lortet-Tienlent J, Soerjomataram I, Ferlay J, Rutherford M, Weiderpars E, Bray F. International trends in lung cancer incidence by histological subtype: adenocarcinoma stabilizing in men but still increasing in women. Lung Cancer 2014; 84(1): 13-22.
5. Brundage MD, Davies D, Mackillop WJ. Prognostic factors in non-small cell lung cancer: A decade of progress. Chest 2002; 122(3): 1037-57.
6. Sculier JP, Chansky K, Crowly JJ, Van MJ, Goldstraw P. The impact of additional prognostic factors on survival and their relationship with the anatomical extent of disease expressed by the 6th Edition of the TNM Classification of Malignant Tumors and the proposals for the 7th Edition. J Thorac Oncol 2008; 3: 457-66.
7. Zhang J, Gold KA, Lin HY, Swisher SG, Xing Y, Lee JJ et al. Relationship between tumor size and survival in non-small cell lung cancer (NSCLC): an analysis of the Surveillance, epidemiology, and end results (SEER) registry. J Thorac Oncol 2015; 10: 682-90.
8. Hendriks L, Derks J, Postmus PE, Damhuis R, Houben R, Troost E et al. Single organ metastatic disease, a new prognostic factor for overall survival (OS) in stage IV non-small cell lung cancer (NSCLC). Ann Oncol 2015; 26: 35.
9. Cuyun Carter G, Banett A, Kaye J, Liepa A, Winfree K, John W. A comprehensive review of non-genetic prognosis and predictive factors influencing the heterogeneity of outcomes in advanced non-small cell lung cancer. Cancer Manag Res 2014; 437.
10. Nakamura H, Ando K, Shinmyo T, Morita K, Mochizuki A, Kurimoto N et al. female gender is an independent prognostic factor in non small cell lung cancer: a meta-analysis. Ann ThoracCardiovasc Surg 2011; 17: 469-80.
11. Azzoli CG, Temin S, Aliff T, Baker S Jr, Brahmer J, Johnson DH et al. 2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer. J Clin Oncol 2011; 29(28): 3825-31.
12. Glare P. Clinical predictors of survival in advanced cancer. J Support Oncol 2005; 3(5): 331‑9.
13. Yates JW, Chalmer B, McKegney FP. Evaluation of patients with advanced cancer using the karnofsky performance status.Cancer 1980; 45(8): 2220‑4.
14. Kelly K. Challenges in defining and identifying patients with non-small cell lung cancer and poor performance status. Semin Oncol 2004; 31(11 Suppl): 3‑7.
15.Tammemagi CM, Nesland-Dudas C, Simoff M, Kvale P. Smoking and lung cancer survival. The role of comorbidity and treatment. Chest 2004; 125: 27-37.
16.Watawaya H, Okamoto T, Maruyama R, Seto T, Yamazaki K, Tagawa T et al. Prognostic factors in previously treated non-small cell lung cancer patients with and without a positive response to the subsequent treatment with gefitinib. Lung Cancer 2009; 64: 341-5.
17.Grivaux M, Zureik M, Marsal L Asselain B, Peureux M, Chavaillon JM et al. Five years survival for lung cancer patients managed in general hospitals. Rev Mal Respir 2009; 26: 37-44.
18. Hespanhol V, Queiroga H, Magalhaes A, Santos AR, Coelho M, Marques A. Survival predictors factors in advanced non-small cell lung cancer. Lung Cancer 1995; 13(3): 253-67.
19. Sculier JP, Chansky K, Crowley JJ, Van Meerbeeck J, Goldstraw P. The impact of additional prognostic factors on survival and their relationship with the atomical extent of disease expressed by the 6th edition of the TNM classification of malignant tumors and the proposals for the 7th edition. J Thorac Oncol 2008; 5: 457-66.
20. Roxburg CSD, Mc Millan DC. Role of systemic inflammatory response in predicting survival in patients with primary operable cancer. Future Oncol 2010; 6(1): 149-63.
21. Tolia M, Tsoukalas N, Kyrgias G, Mosa E, Maras A, Kokakis Iet al. Prognostic significance of serum inflammatory response markers in newly diagnosed non-small cell lung cancer before chemo irradiation. Bio Med Res Int 2015; 2015: 1-5.
22. Berghmans T, Dusart M, Parsmans M, Hossein Foucher C, Buvat I, Castaigne C et al. European lung cancer working party for the IASLC staging project: Primary tumor standardized up take value (SUV max) measured on fluorodeoxyglucose positron emission tomography (FDG-PET) is of prognostic value for survival in non-small cell lung cancer: a systemic review and meta-analysis by the European Lung Cancer Working Party for the IASLC lung cancer staging project. J Thorac Oncol 2008; 3: 6-12.
23. Parasmans M, Sculier JP, Libert P, Bureau G, Dubois G, Thiriaux J et al. Response to chemotherapy has predictive value for further survival of patients with advanced non-small cell lung cancer. 10 years’ experience of the European Lung Cancer Working Party. Eur J Cancer 1997; 14: 2326-32.
24. Johnson KR, Ringland C, Stokes BJ, Anthony DM, Freemantle N, Irs A et al. Response rate or time to progression as predictors of survival in trials of metastatic colorectal cancer and non-small cell lung cancer: a meta-analysis. Lancet Oncol 2006; 7: 741-6.
TABLES AND FIGURES
REFERENCES
1. Lazaar Ben Gobrane H, Hajjem S, Aounallah Skhiri H, Achour N, Hsairi M. Mortalité par cancer en Tunisie: Calcul des années de vie perdues. Santé Publique 2011; 23(1):31-40.
2. Fajraoui N, Charfi MR, Khouani H Annabi H, Bouhaouala MH, Boussen H et al. Clinical epidemiology of primary lung cancer in Tunisia.100 cases. Tunis Med 2007; 85(9): 766-72.
3. Chaari A, Ben Nasr S, Labidi S, Afrit M, Boussen H. Cancer non à petites cellules métastatique : étude tunisienne rétrospective à propos de 100 cas. Tunis Med 2015; 93(5): 294-669.
4. Lortet-Tienlent J, Soerjomataram I, Ferlay J, Rutherford M, Weiderpars E, Bray F. International trends in lung cancer incidence by histological subtype: adenocarcinoma stabilizing in men but still increasing in women. Lung Cancer 2014; 84(1): 13-22.
5. Brundage MD, Davies D, Mackillop WJ. Prognostic factors in non-small cell lung cancer: A decade of progress. Chest 2002; 122(3): 1037-57.
6. Sculier JP, Chansky K, Crowly JJ, Van MJ, Goldstraw P. The impact of additional prognostic factors on survival and their relationship with the anatomical extent of disease expressed by the 6th Edition of the TNM Classification of Malignant Tumors and the proposals for the 7th Edition. J Thorac Oncol 2008; 3: 457-66.
7. Zhang J, Gold KA, Lin HY, Swisher SG, Xing Y, Lee JJ et al. Relationship between tumor size and survival in non-small cell lung cancer (NSCLC): an analysis of the Surveillance, epidemiology, and end results (SEER) registry. J Thorac Oncol 2015; 10: 682-90.
8. Hendriks L, Derks J, Postmus PE, Damhuis R, Houben R, Troost E et al. Single organ metastatic disease, a new prognostic factor for overall survival (OS) in stage IV non-small cell lung cancer (NSCLC). Ann Oncol 2015; 26: 35.
9. Cuyun Carter G, Banett A, Kaye J, Liepa A, Winfree K, John W. A comprehensive review of non-genetic prognosis and predictive factors influencing the heterogeneity of outcomes in advanced non-small cell lung cancer. Cancer Manag Res 2014; 437.
10. Nakamura H, Ando K, Shinmyo T, Morita K, Mochizuki A, Kurimoto N et al. female gender is an independent prognostic factor in non small cell lung cancer: a meta-analysis. Ann Thorac Cardiovasc Surg 2011; 17: 469-80.
11. Azzoli CG, Temin S, Aliff T, Baker S Jr, Brahmer J, Johnson DH et al. 2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer. J Clin Oncol 2011; 29(28): 3825-31.
12. Glare P. Clinical predictors of survival in advanced cancer. J Support Oncol 2005; 3(5): 331‑9.
13. Yates JW, Chalmer B, McKegney FP. Evaluation of patients with advanced cancer using the karnofsky performance status. Cancer 1980; 45(8): 2220‑4.
14. Kelly K. Challenges in defining and identifying patients with non-small cell lung cancer and poor performance status. Semin Oncol 2004; 31(11 Suppl): 3‑7.
15.Tammemagi CM, Nesland-Dudas C, Simoff M, Kvale P. Smoking and lung cancer survival. The role of comorbidity and treatment. Chest 2004; 125: 27-37.
16.Watawaya H, Okamoto T, Maruyama R, Seto T, Yamazaki K, Tagawa T et al. Prognostic factors in previously treated non-small cell lung cancer patients with and without a positive response to the subsequent treatment with gefitinib. Lung Cancer 2009; 64: 341-5.
17.Grivaux M, Zureik M, Marsal L Asselain B, Peureux M, Chavaillon JM et al. Five years survival for lung cancer patients managed in general hospitals. Rev Mal Respir 2009; 26: 37-44.
18. Hespanhol V, Queiroga H, Magalhaes A, Santos AR, Coelho M, Marques A. Survival predictors factors in advanced non-small cell lung cancer. Lung Cancer 1995; 13(3): 253-67.
19. Sculier JP, Chansky K, Crowley JJ, Van Meerbeeck J, Goldstraw P. The impact of additional prognostic factors on survival and their relationship with the atomical extent of disease expressed by the 6th edition of the TNM classification of malignant tumors and the proposals for the 7th edition. J Thorac Oncol 2008; 5: 457-66.
20. Roxburg CSD, Mc Millan DC. Role of systemic inflammatory response in predicting survival in patients with primary operable cancer. Future Oncol 2010; 6(1): 149-63.
21. Tolia M, Tsoukalas N, Kyrgias G, Mosa E, Maras A, Kokakis I et al. Prognostic significance of serum inflammatory response markers in newly diagnosed non-small cell lung cancer before chemo irradiation. Bio Med Res Int 2015; 2015: 1-5.
22. Berghmans T, Dusart M, Parsmans M, Hossein Foucher C, Buvat I, Castaigne C et al. European lung cancer working party for the IASLC staging project: Primary tumor standardized up take value (SUV max) measured on fluorodeoxyglucose positron emission tomography (FDG-PET) is of prognostic value for survival in non-small cell lung cancer: a systemic review and meta-analysis by the European Lung Cancer Working Party for the IASLC lung cancer staging project. J Thorac Oncol 2008; 3: 6-12.
23. Parasmans M, Sculier JP, Libert P, Bureau G, Dubois G, Thiriaux J et al. Response to chemotherapy has predictive value for further survival of patients with advanced non-small cell lung cancer. 10 years’ experience of the European Lung Cancer Working Party. Eur J Cancer 1997; 14: 2326-32.
24. Johnson KR, Ringland C, Stokes BJ, Anthony DM, Freemantle N, Irs A et al. Response rate or time to progression as predictors of survival in trials of metastatic colorectal cancer and non-small cell lung cancer: a meta-analysis. Lancet Oncol 2006; 7: 741-6.
ARTICLE INFO
DOI: 10.12699/jfvp.7.22.2016.24
Conflict of Interest
Non
Date of manuscript receiving
12/4/2016
Date of publication after correction
15/11/2016
Article citation
Bacha. S, Habibech. S, Cheikhrouhou.S, Racil. H, Haouch. N, Sghaier. A, Chabbou. A; Prognostic factors of non-small cell lung cancer in advanced stages. J Func Vent Pulm 2016; 22(7): 1-59.