
 English
English
 French
French
Clinical characteristics of obstructive sleep apnea
Profil clinique du syndrome d’apnées obstructives du sommeil
S. Bacha, S. Habibech, N. Chaouch
Service de Pneumologie
Pavillon 2, Hôpital Abderrahmane MamiAriana. Tunisie
Corresponding author
Dr. Saoussen BACHA
Service de Pneumologie. Pavillon 2, Hôpital Abderrahmane MamiAriana,Tunisie.
Email: saoussenbacha@yahoo.fr
ABSTRACT
Introduction. The obstructive sleep apnea syndrome (OSA) is a medical condition producing severe morbidity; it is largely undiagnosed in the general population. The aim of this study was to determine the clinical features and the management of patients with OSA.
Methods. It was a retrospective study including all patients with a diagnosis OSA referred to our specialist outpatient sleep medicine clinic over a period of one year. A polygraphy was performed in all cases.
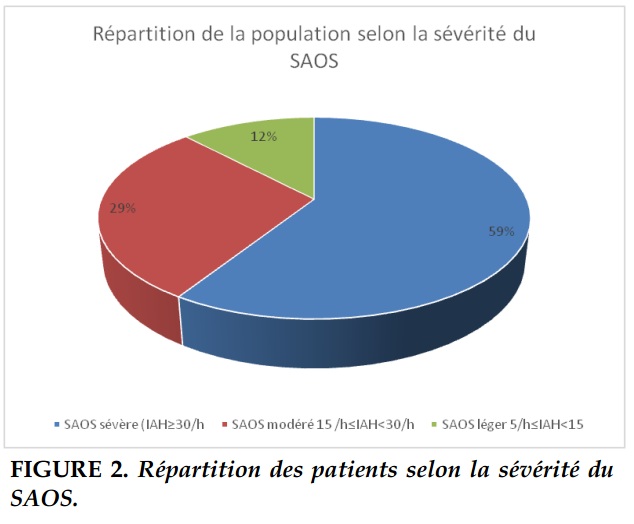
Results. Thirty four patients were included. The mean age was 54.3 years; 77% were males. Mean body mass index was 32.46 kg/m². OSA was severe (apnea hypopnea index AHI ≥30/h) in 59% of the cases. Night snoring and excessive daytime somnolence were the most common symptoms (respectively 100 % and 79% of cases). Obesity was noted in 79% of cases. Chronic obstructive pulmonary disease (COPD) was associated to OSA in 15% of cases. Arterial hypertension, diabetes and dyslipidemia were seen in respectively 65.50% and 53% of the cases. This cardiovascular and metabolic complications were associated with the severity of the OSA (p=0.04). Fifty three percent of the patients were treated with continuous positive airway pressure (CPAP). CPAP was well accepted and tolerated in 70% of the cases. Excessive daytime somnolence was significantly improved by CPAP (p=0.04).
Conclusion. Cardiovascular and metabolic complications of the OSA were frequent and associated with the severity of the disease.
KEYWORDS: Obstructive sleep apnea, polygraphy, continuous positive pressure, complications.
RÉSUMÉ
Introduction. Le syndrome d'apnée obstructive du sommeil (AOS) est une condition médicale produisant une morbidité sévère et largement non diagnostiquée dans la population générale. Le but de cette étude était de déterminer les caractéristiques cliniques et la prise en charge des patients atteints d'AOS.
Méthodes. Il s'agissait d'une étude rétrospective incluant tous les patients ayant un diagnostic d'AOS référé à notre clinique spécialisée en médecine du sommeil ambulatoire sur une période d'un an. Une polygraphie a été réalisée dans tous les cas.
Résultats. Trente-quatre patients ont été inclus. L'âge moyen était de 54,3 ans; 77% étaient des hommes. L'indice de masse corporelle moyen était de 32,46 kg / m². L'AOS était sévère (indice d'apnée hypopnée d'IAH ≥ 30 / h) dans 59% des cas. Le ronflement nocturne et la somnolence diurne excessive sont les symptômes les plus fréquents (respectivement 100% et 79% des cas). L'obésité a été notée dans 79% des cas. La maladie pulmonaire obstructive chronique (MPOC) était associée à l'AOS dans 15% des cas. L'hypertension artérielle, le diabète et la dyslipidémie ont été observés respectivement dans 65, 50% et 53% des cas. Ces complications cardiovasculaires et métaboliques étaient associées à la sévérité de l'AOS (p = 0,04).
Cinquante-trois pour cent des patients ont été traités avec une pression positive continue (PPC). La PPC était bien acceptée et tolérée dans 70% des cas. La somnolence diurne excessive a été significativement améliorée par CPAP (p = 0,04).
Conclusion. Les complications cardiovasculaires et métaboliques de l'AOS étaient fréquentes et associées à la gravité de la maladie.
MOTS CLÉS: Apnée obstructive du sommeil, polygraphie, pression positive continue, complications.
INTRODUCTION
Le SAOS est une affection fréquente concernant près de 4% des hommes et 2% des femmes de la population générale adulte et est largement sous diagnostiquée [1-5]. Sa fréquence élevée, ses complications cardiovasculaires et métaboliques graves en font un véritable problème de santé publique [6-9]. Le SAOS est un trouble respiratoire du sommeil caractérisé par la survenue répétitive de modifications de la collapsibilité des voies aériennes supérieures (VAS) entrainant des obstructions complètes ou partielles des VAS pendant le sommeil, responsables d’interruption complète (apnées) ou partielle (hypopnée) de la ventilation.
Le but de notre travail était d’évaluer le profil clinique et la prise en charge thérapeutique des patients pris en charge à la consultation externe spécialisée du sommeil pour SAOS pendant une année.
METHODES
La population étudiée était composée de tous les patients vus à la consultation externe spécialisée du sommeil pendant une année d’activité allant du 1ier Janvier 2009 au 1ier Janvier 2010. Une polygraphie ventilatoire était réalisée chez tous les patients. Le SAOS est défini par la présence des critères A ou B et du critère C (A: Somnolence diurne excessive non expliquée par d’autres facteurs; B: Deux au moins des critères suivants non expliqués par d’autres facteurs: ronflements sévères et quotidiens, sensations d’étouffements ou de suffocations pendant le sommeil, sommeil non récupérateur, fatigue diurne, difficultés de concentration, nycturie; C: Index d’apnées-hypopnées (IAH)≥5/h) [1]. Les caractéristiques sociodémographiques, le tabagisme, les antécédents familiaux de SAOS, les antécédents médicaux, les données cliniques, l’indice de masse corporelle (IMC) et l’IAH étaient recueillis à partir du dossier médical.
Statistiques
Ces données étaient ensuite analysées au moyen du logiciel SPSS version 19.0. Nous avons effectué une étude statistique descriptive pour chacun des paramètres étudiés. Nous avons calculé des fréquences simples et des fréquences relatives (pourcentages) pour les variables qualitatives. Nous avons calculé des moyennes, des médianes et déterminé l’étendue pour les variables quantitatives. Pour la comparaison des variables qualitatives nous avons utilisé le test de Chi2 ou le test exact de Fisher selon l’effectif théorique. Pour les variables quantitatives nous avons utilisé les tests de Student et l’ANOVA si la distribution suit une loi normale. Dans tous les cas, nous avons utilisé un seuil de signification <5%.
RESULTATS
Parmi les 38 patients adressés à la consultation externe du sommeil pendant l’année de l’étude, 34 patients avaient un SAOS, soit 89% des cas. La moyenne d’âge était de 54,3 ans avec des extrêmes allant de 31 à 73 ans. Une prédominance masculine était notée (26 hommes soit 77%). La moyenne de
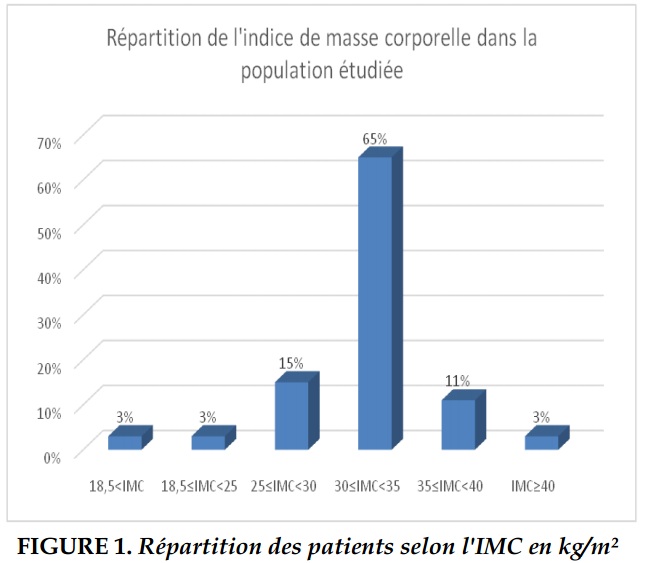
l’IMC était de 32,46 kg/m² avec des extrêmes allant de 17,9 kg/m² à 44,8/m² (Figure 1).
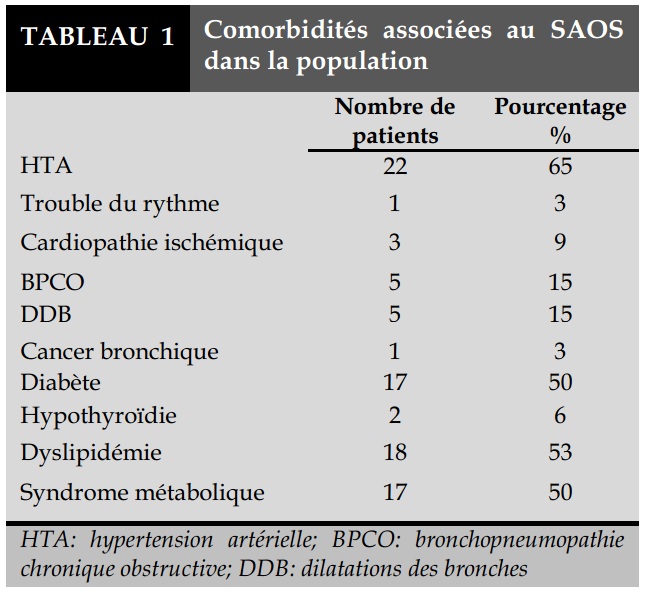
Un IMC ≥30kg/m² était rapporté dans 27 cas (79%) dont 17 cas ayant un IAH≥30/h contre 10 ayant un 5/h≤IAH<30/h; p=0,044). Six patients (18%) avaient une profession à risque dont trois chauffeurs, un soudeur, un maçon et un mécanicien. Le tabagisme était noté chez 22 patients (65%) avec une consommation tabagique moyenne de 22 paquets-années (PA). L’examen ORL avait noté une hypertrophie des amygdales dans six cas. Les comorbidités associées au SAOS dans notre population sont rapportées dans le Tableau 1.
La sévérité du SAOS était associée de façon statistiquement significative avec l’hypertension artérielle (HTA) (16 patients avait un IAH≥30/h contre 7 patients ayant un 5/h≤IAH<30/h; p=0,035). Un diabète était noté dans 17cas dont 13 patients avaient un IAH≥30/h contre quatre patients ayant un 5/h≤IAH<30/h; p=0,04). Une dyslipidémie était notée dans 18 cas dont 13 cas avaient un IAH≥30/H contre cinqcas ayant un 5/h≤IAH<30/h; p=0,04). Un syndrome métabolique était noté dans 17 cas dont 13 patients avaient un IAH≥30/h contre quatre patients ayant un 5/h≤IAH<30/h; p=0,04). Le délai moyen entre les symptômes et le diagnostic de SAOS était de 5 ans avec des extrêmes allant de un à sept ans.
Le ronflement était le symptôme le plus fréquent, retrouvé dans tous les cas (100%). La somnolence diurne était rapportée par 27 patients(79%). Le Tableau 2 résume les signes fonctionnels rapportés par les patients.
Le score d’Epworth avait montré une somnolence significative dans 25 cas (73%) dont 6 cas (18%) de somnolence sévère. La moyenne de ce score était de 11,8 (allant de 2 à 20).L’enregistrement polygraphique avait montré un IAH moyen de 36,4/h avec des extrêmes allant de 5 à 89/h (fig.2). La saturation en oxygène moyenne était de 92,25% avec des extrêmes allant de 82 à 97 mmHg. Les mesures hygiéno-diététiques étaient proposées à tous les patients. La ventilation par pression positive continu (PPC)était administrée chez 53% des patients et une BIPAP était préconisée chez 6% des patients. Le taux d’acceptation initiale était de 90%. La pression efficace moyenne était de 8,5 cm d’eau avec des extrêmes allant de 8 à 10 cm. Le traitement par orthèse d’avancée mandibulaire était indiqué dans 20% des cas mais aucun patient n’avait pu en bénéficier.
Le traitement chirurgical n’était indiqué chez aucun patient. Quatorze patients (70%) étaient adhérents à leur traitement et utilisaient leurs appareils tous les soirs entre 4 et 7 heures par nuit. La tolérance était bonne chez 70% des patients. Six patients avaient rapporté une intolérance à la PPC liée à un problème de masque(3 cas), à une sécheresse buccale (1 cas) et à une rhinite (2 cas). Ces effets secondaires de la PPC étaient corrigés par la mise en place d’un humidificateur et par le changement de masque. Un patient avait présenté une somnolence résiduelle sous PPC secondaire à des fuites importantes ayant bien évolué après sa mise sous masque facial. Le score d’Epworth moyen était passé de 11,8 à 8 après traitement par PPC (p=0,048).
DISCUSSION
Dans cette étude, les complications cardiovasculaires et métaboliques étaient fréquentes et associées à la sévérité du SAOS. L’âge moyen de nos patients était de 54,3 ans. Cette moyenne d’âge correspond à la moyenne d’âge classique des patients atteints de SAOS rapportée dans la littérature [10,11]. Les hommes étaient trois fois plus nombreux que les femmes dans cette étude. Le SAOS est effectivement une pathologie à prédominance masculine dans la littérature. Toutefois, d’autres études avaient rapporté une fréquence plus élevée du sexe féminin variant de 30 à 60%[3,12].Parmi nos patients, 65% étaient tabagiques. Une association positive entre le tabagisme et le SAOS était rapportée dans de nombreuses études [13-17]. Actuellement, le tabagisme est considéré comme un facteur de risque de SAOS [4].L’association BPCO et SAOS étaient retrouvée dans 15% des cas dans notre série et varie de 11 à 20% dans la littérature, cette association aggrave le pronostic avec une mortalité et une morbidité plus élevées. Le ronflement est un symptôme cardinal du SAOS. En effet, 100% des patients dans cette étude avaient un ronflement nocturne; ceci était concordant avec les données de la littérature, ce symptôme est présent chez 81 à 100% des patients atteints de SAOS [18]. Les apnées étaient un facteur prédictif majeur de SAOS dans la littérature [19,20]. Dans notre étude, les apnées étaient rapportées par 50% des patients. La somnolence diurne est un signe fré- quemment observé au cours du SAOS; il fait partie de l’un des critères diagnostiques et est corrélé à la sévérité du SAOS [21,22]. Afin d’évaluer ce symptôme, le score d’Epworth est communément utilisé en raison de sa facilité d’utilisation et de sa reproductibilité [21].
Dans notre série, 73% des patients avaient une somnolence selon l’échelle d’epworth. Les complications métaboliques étaient fréquentes chez nos patients: 79% des patients étaient obèses; 53% des patients avaient une dyslipidémie; 47% des patients étaient diabétiques et 50% des patients avaient un syndrome métabolique. Ceci rejoint les données de la littérature puisque l’obésité était notée dans 60% à 70% des patients ayant un SAOS avec une relation bien établie entre la sévérité du SAOS et l’obésité [19,21-25].Une augmentation de l’ordre de 10% de l’IMC pouvait multiplier le risque d’avoir un SAOS modéré ou sé- vère par un facteur 6 et augmente de 32% l’IAH selon certaines études [26]. Les données de la cohorte de la Sleep Heart Health Study (SHHS) avaient montré que, chez des sujets adultes, le risque de SAOS modéré à sévère défini par un IAH≥15/h était associé demanière indépendante à l’IMC [27]. Le SAOS est également un facteur de risque indépendant de dysfonctionnement du métabolisme glucidique allant de l’intolérance au glucose au diabète type 2[28].
Dans l’étude de Punjabi et al, les sujets avec un IAH≥5/h avaient un risque relatif de présenter une intolérance au glucose de 2,15après ajustement sur l’IMC[29].La prévalence du SAOS chez le diabétique était estimée à 23% et le diabète apparait comme un facteur indépendant de SAOS dans l’étude de West et al[30].La recherche de SAOS chez un patient diabétique type 2 même en l’absence de symptomatologie évocatrice était proposée par certains auteurs. De plus, une association significative entre le SAOS et l’hypercholestérolémie chez l’homme et l’hypertriglycéridémie chez la femme était notée après ajustement pour l’âge et l’IMC dans la cohorte de la étude SHHS [29]. Le taux du high density lipoprotein cholesterol (HDL-C) diminuait avec l’accroissement de l’IAH [29].
La prévalence de l’hypercholestérolémie et de l’hypertriglycéridémie était respectivement de 61,1% et 55,3% chez les patients ayant un SAOS dans l’étude de Chou et al [31]. Différentes études avaient mis en évidence une association entre SAOS et le syndrome métabolique dans la littérature. Le risque de syndrome métabolique est neuf fois plus élevé en pré-sence de SAOS [32].
Sa prévalence augmente avec la sévérité du SAOS [32]. La relation entre SAOS et les complications cardiovasculaires est actuellement bien établie. La pré- valence de l’HTA est plus élevée dans le SAOS que dans la population générale et ce risque est proportionnel à la sévérité du SAOS [33-36]. Dans notre sé-rie une HTA était notée chez 65% des patients présentant un SAOS (IAH≥5/h). La prévalence du SAOS (utilisant un IAH≥10/heure) dans les populations de patients hypertendus est de l’ordre de 30 à 40%[37].
Le risque relatif d’HTA après quatre ans de suivi allait de 1,42 (IAH entre0,1 et 4,9/h) à 2,89 (IAH≥15/h) en comparaison avec les sujets ayant un IAH de 0/ heure [38]. Actuellement, le SAOS est considéré une cause d’HTA. Le SAOS est particulièrement fréquent en cas d’HTA réfractaire non contrôlée par un traitement hypertensif optimal avec une prévalence est de 56 à 85% dans ce groupe de patients [4, 36].
L’association entre le SAOS et les troubles du rythme cardiaque et la maladie coronarienne était également démontrée dans plusieurs études [39-42]. La maladie coronaire était associée de manière indépendante au SAOS. Il y a aussi des données suggérant que chez des patients ayant une maladie coronaire documentée, la prévalence relevée du SAOS a été de 30 à 57%.
Dans notre série, une proportion faible de cardiopathies ischémiques (9%) et de trouble du rythme cardiaque (3%) était notée. Ceci est probablement lié à la faible taille de l’échantillon et à l’absence de pratique systématique de l’holter rythmique. Le traitement du SAOS vise à corriger les symptômes diurnes et nocturnes et à prévenir l’apparition ou l’aggravation des complications liées au SAHOS. La PPC est le traitement dont l’efficacité était démontrée, à partir d’essais randomisés contrôlés, sur les symptômes, la somnolence, le sommeil, les fonctions cognitives, la qualité de vie, l’humeur et l’HTA [32]. Mais ces résultats portent sur les patients symptomatiques ou ayant des complications cardiovasculaires et métaboliques avec un IAH≥15/h. La situation est plus controversée pour les patients avec un SAOS léger ou les bénéfices sur les symptômes sont très modestes avec une faible observance des patients [43,44]. Dans notre étude, le traitement par PPC était indiqué pour 59% des patients.
La compliance à la PPC varie de 36 à 60% selon les études [45]. Les facteurs prédictifs de l’observance à moyen terme dans la littérature sont essentiellement la gravité initiale du SAOS, la rapidité de l’amé-
lioration clinique sous PPC et le suivi régulier du patient [44]. Cette étude présente des limites liées essentiellement à son caractère rétrospectif et à son faible effectif. De ce fait, l’évaluation de l’efficacité de certaines modalités thérapeutiques autre que la PPC comme l’orthèse d’avancée mandibulaire ou la chirurgie n’était pas possible Cependant, nos résultats sont globalement concordants avec les données de la littérature.
CONCLUSION
Le SAOS est source importante de morbidité cardiovasculaire et métabolique qui sont associées à la sévérité de la maladie. Sa prise en charge précoce et adaptée permet d’améliorer les symptômes et la qualité de vie des patients.
CONFLIT D’INTERETS
Non.
REFERENCES
1. Escourou P, Meslier N, Raffestin B, Clavel R, Gomes J, Hazouard E, et al. Quelle approche clinique et quelle procédure diagnostique pour le SAHOS. Rev Mal Res-pir 2010; 27:115-23.
2. Young T, Peppard P, Gottlieb D, Palta M. Epidemiolo- gy of obstructive sleep apnea. Am J Respir Crit Care Med 2002; 165:1217-39.
3. Young T, Palta M, Dempsey J, Weber S, Badr S. The occurrence of sleep-disordered breathing among mid-dle-aged adults. N Eng J Med 1993; 328:1230-5.
4. Sharma SK, Kumpawat S, Bang A, Goel A. Prevalence and risk factors of obstructive sleep apnea syndrome in a population of Delhi, India. Chest 2006; 130:149-56.
5. Young T, Evans L, Finn L, Palta M ; estimation of the clinically diagnosed proportion of sleep apnea syn-drome in middle-aged men and women. Sleep 1997; 20:705-6.
6. Escourou P, Roisman GL. Epidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte et de ses complications. Med Sommeil 2010;7:119-28.
7. Ballivet S, Pons Y, Chabolle F, Clément P, Maurin O, Conessa C. Syndrome d’apnées obstructives du som-meil. Rev Prat Med Gen 2010; 60:669-82.
8. Baguet P, Pépin JL, Hammer L, Lévy P, Mallon JM. Cardiovascular consequences of obstructive sleep ap-nea syndrome. Rev Med Int 2003; 24:530-7.
9. Flemons W. Obstructive sleep apnea. N Eng J Med 2002; 347:498-504.
10. Meslier N, Belkom DF, Gagnadoux M et al. Prévalence des symptômes du syndrome d’apnée du sommeil. Etude dans une population française d’âge moyen. Rev Mal Respir 2007; 24:305-13.
11. Redline S, Kumpk K, Tishler P, Browner J, Ferrette V. Gender differences in sleep-disorder breathing in a community-based sample. Am J Respir Crit Care Med 1994; 149:722-6.
12. Schab RJ. Sex differences and sleep apnea. Thorax 1999; 54:284-5.
13. Wetter D, Young T, Bidwell T, Badr M. Smoking as risk factor for sleep-disorder breathing. Arch inter Med 1994; 154:219-24.
14. Bearpark H, Elliott L, Grunstein R, Cullen S, Schneider H, Althaus W et al. Snoring and sleep apnea a popula-tion study in Australian men. Am J Respir Crit Care Med 1995; 151:1459-64.
15. Duran J, Esnaola S, Rubio R, Iztueta A. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 year. Am J Respir Crit Care Med 2001; 163:685-9.
16. Stradling JR, Crosby GH. Predictors and prevalence of obstructive sleep apnea and snoring in 1001 middle aged men. Thorax 1991; 46:85-90.
17. Jennum P, Sjol A. Epidemiology of snoring and ob- structive sleep apnea in a Danish population, age 30- 60. J sleep Res 1992; 41:571-6.
18. Bearpark H, Elliot L, Grunstein R. Snoring and sleep apnea: a population study in Australian men: prospec-tive study. Am J Respir Crit Care Med 1995; 151:1459-65.
19. Young T, Shahar E, Nieto J Redline S, Newman AB, Gottlieb DJ et al. Predictors of sleep-disordered breath-ing in community-dwelling adults. Arch Intern Med 2002; 162:893-900.
20. Flemons W, Whitelaw W, Brant R, Remmers J. Like hood ratios for a sleep apnea clinical prediction rule. Am J Respir Crit Care Med 1994; 150:1279-85.
21. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1999; 14:540-5.
22. Gottieb D, Whitney C, Bonekat W, Iber C, James GD, Lebowitz M et al. Relation of sleepiness to respiratory disturbance index, the sleep Heart Health study. Am J Respir Crit Care Med 1999; 159:502-7.
23. Durieux P, Neukirch F. Epidémiologie du syndrome d’apnée du sommeil de l’adulte. Rev Mal Respir 1990;7:441-9.
24. Nakano H, Ikeda T, Hayashi M, Ohshima E, Itoh M, Nishikata N et al. Effect of body mass index on overnight oxymetry for the diagnosis of sleep apnea. Res Med 2004; 98:421-7.
25. Sharma H, Sharma SK. Overview and implications of obstructive sleep apnea. Indian J Chest Dis Allied sci 2008; 50:137-50.
26. Bixler EO, Vgontzas AN, Ten Have T, Tyson K, Kales A. Effects of age on sleep apnea In men: I.Prevalence and severity. Am J Respir Crit Care Med 1998; 157:144-8.
27. Newman AB, Foster G, Givelber R, Nieto FJ, Redline S, Young T. Progression and regression of sleep-disordered Breathing with changes in weight: The Sleep Heart Health Study. Arch Intern Med 2005;165:2408-13.
28. Makino S, Handa H, Suzukawa K. Obstructive sleep apnea syndrome, plasma adiponectin levels and insu- lin resistance. Clin Endocrinol 2006; 64:12-9.
29. Punjabi NM, Shahar E, Redline S, Gottlieb DJ, Givelber R, Resnick HE. Sleep-disordered breathing, glucose intolerance, and insulin resistance: The Sleep Heart Health Study. Am J Epidemiol 2004; 160:521.
30. West SD, Nicoll DJ, Stradling JR. Prevalence of ob-structive sleep apnoea in men with type 2 diabetes. Thorax 2006; 61:945-50.
31. Chou YT, Chuang LP, Li HS, Fu JY, Lin SW, Yang CT et al. Hyperlipidaemia in patients with sleep-related breathing disorders: prevalence and risk factors. Indi-an J Med Res 2010; 131:121-5.
32. M.-C Ouayoun. Syndrome d’apnées-hypopnées obs- tructives du sommeil de l’adulte. EMC otorhinolaryn-gologie, volume 10; numéro 3; aout 2015. 20-960-A-10.
33. Lavie P, Here P, Hoffstein V. Obstructive sleep apnea syndrome as a risk factor for hypertension, population study. BMJ 2003; 320:479-82.
34. Levinson P, McGarvey S, Carlisie C, Eveloff S, Herbert P, Millman R. Adiposity and cardiovascular risk fac-tors in men with obstructive sleep apnea. Chest 1993; 103:1336-42.
35. Millman R, Carlisie C, McGarvey S, Eveloff S, Levinson P. Body fat distribution and sleep apnea severity in women. Chest 1995; 107:363-6.
36. Marin JM, Carrizo SJ, Vicenti E, Agusti AG. Long term cardiovascular outcomes in men with obstructive sleep apnea hypopnea with or without treatment with continuous positive airway pressure: an observational study. Lancet 2005; 365:1046-53.
37. Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Javier Nieto F, Et al. Sleep-disordered breathing and cardiovascular disease: Cross sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163:19-25.
38. Peppard PE, Young T, Palta M, Skatrud J. Prospective study of the association between sleep-disordered breathing and hypertension. N Engl J Med 2000; 342:1378-84.
39. Bradely TD, Floras JS. Obstructive sleep apnea and its cardiovascular consequences. Lancet 2009; 373:82-93.
40. Kim SH, Cho GY, Baik I, Kim J, Kim SJ, Lee JB et al. Association of coronary artery calcification with ob-structive sleep apnea and obesity in middle-aged men. Nutr Metab Cardiovasc Dis 2010; 20:575-82.
41. Somers VK, White DP, Amin R, Abraham WT, Costa F, Culebras A et al. Sleep apnea and cardiovascular disease. Circulation 2008; 118:1080-111.
42. Newman A, Nieto J, Guidry U, Lind BK, Redline S, Pickering TG et al. Relation of sleep disordered
breathing to cardiovascular disease risk factors. Am J Epidemiol 2001; 154:50-9.
43. Portier F, Orvoen Frija E, Chavaillon JM, Lerousseau L, Reybet Degat O, Leger D, Et al. Treatment of ob-structive sleep apnea syndrome using continuous positive pressure ventilation. Rev Mal Respir 2010; 27 (Suppl 3):S137-45.
44. Lance Kushida CA, Litter MR, Hirshkowitz M. Prac- tice parameters for the use of continuous and bi-level positive airway pressure devices to treat adult pa-tients with sleep related breathing disorders. Sleep 2006; 29: 375-80.
45. Giles TL, Lasserson TJ, Smith BH, White J, Cates CJ. Continuous positive airway pressure for obstructive sleep apnea in adults. Cochrane Database Syst Rev 2006; 3:1106.
FIGURES / TABLES

REFERENCES
1. Escourou P, Meslier N, Raffestin B, Clavel R, Gomes J, Hazouard E, et al. Quelle approche clinique et quelle procédure diagnostique pour le SAHOS. Rev Mal Respir 2010; 27:115-23.
2. Young T, Peppard P, Gottlieb D, Palta M. Epidemiology of obstructive sleep apnea. Am J Respir Crit Care Med 2002; 165:1217-39.
3. Young T, Palta M, Dempsey J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Eng J Med 1993; 328:1230-5.
4. Sharma SK, Kumpawat S, Bang A, Goel A. Prevalence and risk factors of obstructive sleep apnea syndrome in a population of Delhi, India. Chest 2006; 130:149-56.
5. Young T, Evans L, Finn L, Palta M ; estimation of the clinically diagnosed proportion of sleep apnea syndrome in middle-aged men and women. Sleep 1997; 20:705-6.
6. Escourou P, Roisman GL. Epidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte et de ses complications. Med Sommeil 2010; 7:119-28.
7. Ballivet S, Pons Y, Chabolle F, Clément P, Maurin O, Conessa C. Syndrome d’apnées obstructives du sommeil. Rev Prat Med Gen 2010; 60:669-82.
8. Baguet P, Pépin JL, Hammer L, Lévy P, Mallon JM. Cardiovascular consequences of obstructive sleep apnea syndrome. Rev Med Int 2003; 24:530-7.
9. Flemons W. Obstructive sleep apnea. N Eng J Med 2002; 347:498-504.
10. Meslier N, Belkom DF, Gagnadoux M et al. Prévalence des symptômes du syndrome d’apnée du sommeil. Etude dans une population française d’âge moyen. Rev Mal Respir 2007; 24:305-13.
11. Redline S, Kumpk K, Tishler P, Browner J, Ferrette V. Gender differences in sleep-disorder breathing in a community-based sample. Am J Respir Crit Care Med 1994; 149:722-6.
12. Schab RJ. Sex differences and sleep apnea. Thorax 1999; 54:284-5.
13. Wetter D, Young T, Bidwell T, Badr M. Smoking as risk factor for sleep-disorder breathing. Arch inter Med 1994; 154:219-24.
14. Bearpark H, Elliott L, Grunstein R, Cullen S, Schneider H, Althaus W et al. Snoring and sleep apnea a population study in Australian men. Am J Respir Crit Care Med 1995; 151:1459-64.
15. Duran J, Esnaola S, Rubio R, Iztueta A. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 year. Am J Respir Crit Care Med 2001; 163:685-9.
16. Stradling JR, Crosby GH. Predictors and prevalence of obstructive sleep apnea and snoring in 1001 middle aged men. Thorax 1991; 46:85-90.
17. Jennum P, Sjol A. Epidemiology of snoring and obstructive sleep apnea in a Danish population, age 30-60. J sleep Res 1992; 41:571-6.
18. Bearpark H, Elliot L, Grunstein R. Snoring and sleep apnea: a population study in Australian men: prospective study. Am J Respir Crit Care Med 1995; 151:1459-65.
19. Young T, Shahar E, Nieto J Redline S, Newman AB, Gottlieb DJ et al. Predictors of sleep-disordered breathing in community-dwelling adults. Arch Intern Med 2002; 162:893-900.
20. Flemons W, Whitelaw W, Brant R, Remmers J. Like hood ratios for a sleep apnea clinical prediction rule. Am J Respir Crit Care Med 1994; 150:1279-85.
21. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1999; 14:540-5.
22. Gottieb D, Whitney C, Bonekat W, Iber C, James GD, Lebowitz M et al. Relation of sleepiness to respiratory disturbance index, the sleep Heart Health study. Am J Respir Crit Care Med 1999; 159:502-7.
23. Durieux P, Neukirch F. Epidémiologie du syndrome d’apnée du sommeil de l’adulte. Rev Mal Respir 1990; 7:441-9.
24. Nakano H, Ikeda T, Hayashi M, Ohshima E, Itoh M, Nishikata N et al. Effect of body mass index on overnight oxymetry for the diagnosis of sleep apnea. Res Med 2004; 98:421-7.
25. Sharma H, Sharma SK. Overview and implications of obstructive sleep apnea. Indian J Chest Dis Allied sci 2008; 50:137-50.
26. Bixler EO, Vgontzas AN, Ten Have T, Tyson K, Kales A. Effects of age on sleep apnea In men: I.Prevalence and severity. Am J Respir Crit Care Med 1998; 157:144-8.
27. Newman AB, Foster G, Givelber R, Nieto FJ, Redline S, Young T. Progression and regression of sleep-disordered Breathing with changes in weight: The Sleep Heart Health Study. Arch Intern Med 2005; 165:2408-13.
28. Makino S, Handa H, Suzukawa K. Obstructive sleep apnea syndrome, plasma adiponectin levels and insulin resistance. Clin Endocrinol 2006; 64:12-9.
29. Punjabi NM, Shahar E, Redline S, Gottlieb DJ, Givelber R, Resnick HE. Sleep-disordered breathing, glucose intolerance, and insulin resistance: The Sleep Heart Health Study. Am J Epidemiol 2004; 160:521-30.
30. West SD, Nicoll DJ, Stradling JR. Prevalence of obstructive sleep apnoea in men with type 2 diabetes. Thorax 2006; 61:945-50.
31. Chou YT, Chuang LP, Li HS, Fu JY, Lin SW, Yang CT et al. Hyperlipidaemia in patients with sleep-related breathing disorders: prevalence and risk factors. Indian J Med Res 2010; 131:121-5.
32. M.-C Ouayoun. Syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte. EMC otorhinolaryngologie, volume 10; numéro 3; aout 2015. 20-960-A-10.
33. Lavie P, Here P, Hoffstein V. Obstructive sleep apnea syndrome as a risk factor for hypertension, population study. BMJ 2003; 320:479-82.
34. Levinson P, McGarvey S, Carlisie C, Eveloff S, Herbert P, Millman R. Adiposity and cardiovascular risk factors in men with obstructive sleep apnea. Chest 1993; 103:1336-42.
35. Millman R, Carlisie C, McGarvey S, Eveloff S, Levinson P. Body fat distribution and sleep apnea severity in women. Chest 1995; 107:363-6.
36. Marin JM, Carrizo SJ, Vicenti E, Agusti AG. Long term cardiovascular outcomes in men with obstructive sleep apnea hypopnea with or without treatment with continuous positive airway pressure: an observational study. Lancet 2005; 365:1046-53.
37. Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Javier Nieto F, Et al. Sleep-disordered breathing and cardiovascular disease: Cross sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163:19-25.
38. Peppard PE, Young T, Palta M, Skatrud J. Prospective study of the association between sleep-disordered breathing and hypertension. N Engl J Med 2000; 342:1378-84.
39. Bradely TD, Floras JS. Obstructive sleep apnea and its cardiovascular consequences. Lancet 2009; 373:82-93.
40. Kim SH, Cho GY, Baik I, Kim J, Kim SJ, Lee JB et al. Association of coronary artery calcification with obstructive sleep apnea and obesity in middle-aged men. Nutr Metab Cardiovasc Dis 2010; 20:575-82.
41. Somers VK, White DP, Amin R, Abraham WT, Costa F, Culebras A et al. Sleep apnea and cardiovascular disease. Circulation 2008; 118:1080-111.
42. Newman A, Nieto J, Guidry U, Lind BK, Redline S, Pickering TG et al. Relation of sleep disordered breathing to cardiovascular disease risk factors. Am J Epidemiol 2001; 154:50-9.
43. Portier F, Orvoen Frija E, Chavaillon JM, Lerousseau L, Reybet Degat O, Leger D, Et al. Treatment of obstructive sleep apnea syndrome using continuous positive pressure ventilation. Rev Mal Respir 2010; 27 (Suppl 3):S137-45.
44. Lance Kushida CA, Litter MR, Hirshkowitz M. Practice parameters for the use of continuous and bi-level positive airway pressure devices to treat adult patients with sleep related breathing disorders. Sleep 2006; 29: 375-80.
45. Giles TL, Lasserson TJ, Smith BH, White J, Cates CJ. Continuous positive airway pressure for obstructive sleep apnea in adults. Cochrane Database Syst Rev 2006; 3:1106.