
 English
English
 French
French
Etude des caractéristiques du syndrome d’apnées obstructives chez les patients atteints de BPCO
Study of characteristics of obstructive sleep apnea in patients with COPD
S. Duong-Quy1,2,3, T. Huynh-Anh3, F. Soyez3
1: Collège de Médecine de Lam Dong. Dalat - Vietnam
2: Service de Physiologie - EFR, Hôpital Cochin. Université Paris Descartes - France
3: Association Franco-Vietnamienne de Pneumologie
Corresponding author
Dr. DUONG-QUY Sy
Collège de Médecine de Lam Dong, Dalat - Vietnam. Faculté de Médecine
Paris Descartes - France
E-mail: sduongquy.jfvp@gmail.com
DOI: 10.12699/jfvp.4.11.2013.35
ABSTRACT
Background. Obstructive sleep apnea syndrome (OSA) is often associated with chronic obstructive pulmonary disease (COPD), making sleep disturbances, hypoxemia at night, and daytime hypercapnia are more severe.
Aims of study. This study was planed to evaluate the prevalence of OSA, diagnosed by apnea-hyponea index (AHI) ≥ 5/ hour, in COPD patients in compare to non COPD subjects and its clinical characteristics.
Subjects and methods. 60 smoking males had been included and divided into 2 groups: control group (without COPD; N=30), COPD group (N=30). All subjects underwent clinical examinations, spirometry, and polysomnography. Daytime weakness and drowsiness were evaluated by Pichot (0-32) and Epworth (0-24) scales.
Results. The prevalence of OSA in COPD was higher than non COPD subject (23% vs 10%). The micro arousals and AHI in COPD were higher than non COPD subjects (22±11 and 8±9 vs 8±5 and 5±6; P<0,001, P<0,05). Nadir SpO2 in COPD patients was significantly lower than control subjects (86±9% vs 91±8%). The percentage of COPD patients having snoring at sleep, SpO2 < 90% and < 85% were higher than non COPD group. There were significant correlations between AHI with snoring at sleeps, nocturia, and Epworth scores (R=0,614, P<0,05; R=0,672, P<0,05 ; R=0,526, P<0,01).
Conclusion. The prevalence of OSA is high in COPD than general population. OSA syndrome must be routinely detected in patients with COPD for appropriate treatment.
KEYWORDS: Sleep apnea, COPD, polysomnography, Epworth, Pichot
RESUME
Introduction. Le syndrome d’apnées obstructives du sommeil (SAOS) est souvent associé avec la broncho-pneumopathie chronique obstructive (BPCO), rendant les troubles du sommeil, l’hypoxémie nocturne, et l’hypercapnie diurne plus sévères.
Objectifs. Cette étude était planifiée pour évaluer la prévalence du SAOS, diagnostiqué par l’index d’apnées-hypopnées (IAH), chez les patients atteints de BPCO par rapport au non BPCO et ses caractéristiques.
Sujets et méthodes. 60 fumeurs ont été inclus et répartis en 2 groupes: le groupe de contrôle (non BPCO, N = 30) et le groupe BPCO (N = 30). Tous les sujets bénéficiaient l’examen clinique, la spirométrie, et la polysomnographie. La fatigue et la somnolence diurne ont été évaluées par l’échelle de Pichot (0-32) et Epworth (0-24).
Résultat. La prévalence du SAOS chez les patients BPCO était plus élevée que les non BPCO (23% vs 10%). Les micro-éveils et l’IAH chez les BPCO étaient plus élevés que les non BPCO (22±11 et 8±9 vs 8±5 et 5±6; P<0,001, P<0,05). Le nadir SpO2 chez les patients BPCO était significativement inférieure à celui des non BPCO (86±9% vs 91±8%). Le pourcentage des patients BPCO ayant le ronflement nocturne, la SpO2 < 90% et < 85% était plus élevé que chez les non BPCO. Il y avait une corrélation significative entre l’IAH avec le ronflement, la nycturie, et l’échelle d’Epworth (R=0,614, P<0,05; R=0,672, P<0,05 ; R=0,526, P<0,01).
Conclusion. La prévalence du SAOS dans la BPCO est plus élevée que dans la population générale. Le SAOS doit être systématiquement détecté chez les patients atteints de BPCO pour le traitement approprié.
MOTS CLES: Apnées du sommeil, BPCO, polysomnographie, Epworth, Pichot
INTRODUCTION
L’association entre le SAOS (syndrome d’apnées obstructives du sommeil) et la BPCO (bronchopneumopathie chronique obstructive) est connue sous le nom d’«overlap syndrome» (OLS: overlap syndrome) qui a été décrit pour la première fois dans les années 1980 [1, 2].
Le SAOS se caractérise par des apnées-hypopnées du sommeil avec une désaturation sévère qui entraînent progressivement une hypertension artérielle pulmonaire, un cœur pulmonaire chronique et une hypercapnie diurne. Par conséquent, le sommeil des patients atteints de BPCO est perturbé et la maladie est de plus en plus sévère [3-5].
Les troubles du sommeil sont plus fréquents et remarqués dans l’overlap syndrome que dans la
pathologie BPCO seule. Le coexistence d’un SAOS et d’une BPCO influence sur la structure du sommeil et peut aggraver l’hypercapnie diurne [6]. Donc les patients BPCO atteints de SAOS ont un risque accrue de décompensations respiratoires aigües et une augmentation de la morbidité et la mortalité en raison des pathologies cardiaques.
Des risques augmentés avec une arythmie en association et une hypoxie nocturne chez des patients atteints d’overlap syndrome ont été rapportés [7]. En plus, l’overlap syndrome aggrave également les risques d’hypertension artérielle pulmonaire chez les patients atteints de BPCO au stade moyen et sévère.
Chez les BPCO, la présence de signes cliniques tels que le ronflement, détectés habituellement par les conjoints, la somnolence diurne excessive ou l’hypoxémie disproportionnée par rapport au degré de l’obstruction bronchique sont des indicateurs objectifs en faveur d’un SAHOS.
La polysomnographie est un moyen pour faire le diagnostic d’OLS chez les patients ayant des signes évocateurs. Ce sont les points objectifs qui nous aident à penser à l’OLS chez les patients ayant des signes cliniques et une désaturation nocture. Le traitement habituel par PPC pendant le sommeil grâce au dépistage précoce peut réduire significativement la fréquence des décompensations respiratoires aigües et d’hospitalisation ainsi que la mortalité en général [7].
Au Vietnam, la BPCO est un problème important de santé publique car la prévalence de cette pathologie est élevée en raison de la consommation du tabac. Donc le dépistage précoce de l’OLS est devenue nécessaire et nous aide à mettre en route le traitement convenable.
OBJECTIFS
Cette étude a pour but d’identifier: 1) le pourcentage des BPCO atteints de l’OLS ; 2) les caractéristiques cliniques et fonctionnels de l’OLS chez BPCO.
SUJETS ET METHODES
Populations étudiées
60 hommes adultes, volontaires, habitant dans la ville de Dalat, province de Lam Dong ont été choisis pour participer à notre étude.
Ces participants ont été classés en deux groupes: les contrôles (N = 30) et les cas de BPCO (N = 30). Les contrôles sont des hommes sans BPCO et les cas comprennent des BPCO avec les critères suivants: ATCD tabagiques, signes de BPCO (toux, expectoration, dyspnée à l’effort), troubles de la ventilation obstructive sur EFR selon les critères de sévérité et d’obstruction bronchique de GOLD [8]: le volume expiratoire maximal en premier second (VEMS)/ la capacité vitale forcée (CVF) après test de bronchodilatateurs < 70%.
Les critères d’exclusion pour les deux groupes sont: l’existence d’une maladie aigüe ou chronique sous traitement telle que diabète, l’insuffisance rénale chronique, séquelles d’accidents vasculaires céré- braux, asthme, hypertension artérielle, maladies aigues de rhino-sinus, maladies de cloison nasale ayant des symptômes, insomnie chronique et aigue.
Méthodes
Notre étude était descriptive et transversale. Les données concernant les signes cliniques, fonctionnels et la polysomnographie ont été collectées pour l’analyse. Les sujets ont été examinés cliniquement avec des EFR, ECG et biologie. La sévérité de la somnolence et des fatigues diurnes ont été évaluées par le score d’Epworth (0-24) et Pichot (0-32 points).
Les EFR ont été réalisées par une machine de KoKo nSpire (Etats-Unis). Le test de réversibilité bronchique a été réalisé avec de la Ventoline en aérosol au dosage de 400 µg. Le résultat a été évalué 15 minutes après l’inhalation de la Ventoline.
La polysomnographie (PSG) utilisée est la machine d’Alice PDx (Philippe Respironic, USA). Les paramè-tres enregistrés comprennent l’electroencéphalogramme (EEG) pour les voies: C4-A1, C3-A2, O2-A1 et O1-A2 ; l’électro-myogramme au niveau du menton et de la jambe (EMG), l’électrocardiogramme (ECG) ; les flux aériens (nasal et buccal), la pression expiratoire au niveau nasal ; les mouvements thoraciques et abdominaux ; la position de sommeil ; la saturation en oxygène, l’index de micro-éveils et de ronflements, le temps de sommeil efficace (SE: sleep efficiency). Les paramètres obtenus ont été analysés par le logiciel d’Alice Sleepware (Philippe Respironic, USA). Les stades du sommeil et les index apnées-hypopnées sont classifiés selon les recommandations de l’Association américaine des pathologies du sommeil [9].
Analyses statistiques
Les paramètres obtenus sont présentés sous forme de moyenne ± écart-type (SD). L’analyse statistique a été réalisée par le logiciel SPSS 16.0. Les paramètres qualitatifs ont été comparés par le test de t-Student.
Les résultats sont considérés significatifs quand la valeur de P < 0,05.
RESULTATS
Les caractéristiques cliniques et fonctionnelles
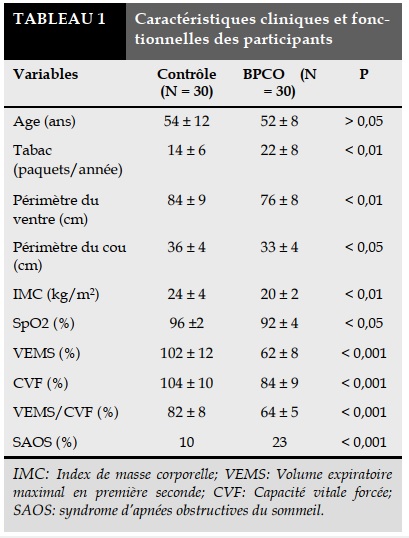
Depuis le mois de juin 2012 jusqu’au mois de décembre 2012, il y a eu 60 participants vivant à Dalat et ayant les critères d’inclusion dont 30 sains et 30 atteints BPCO. Les signes cliniques et fonctionnels des participants sont présentés dans le Tableau 1.
Il n’y a pas de différence d’âges des participants entre les deux groupes. La consommation du tabac dans le groupe BPCO est beaucoup plus importante (P < 0,01).
Les BPCO ayant un périmètre du ventre et du cou, IMC et SpO2 inférieurs que dans les contrôles (P < 0,05). Le pourcentage des SAOS dans le groupe BPCO est plus élevé que dans les contrôles (23% versus 10%).
Caractéristiques de la polysomnographie des participants
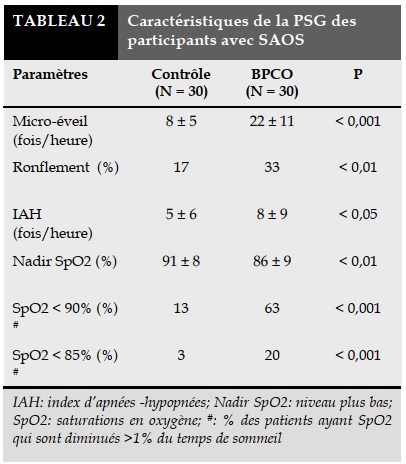
Nous avons réalisé un enregistrement PSG pour tous les participants. Les résultats de la PSG des participants sont présentés dans le Tableau 2.
Les micro-éveils, l’IAH dans les BPCO sont plus élevés par rapport à ceux du groupe de contrôle tandis que les SpO2 sont plus basses que celles du groupe de contrôle. Les pourcentages des ronflements et des désaturations < 90% et < 85% sont plus élevés dans le groupe de contrôle.
Les caractéristiques cliniques concernant le SAOS chez les BPCO
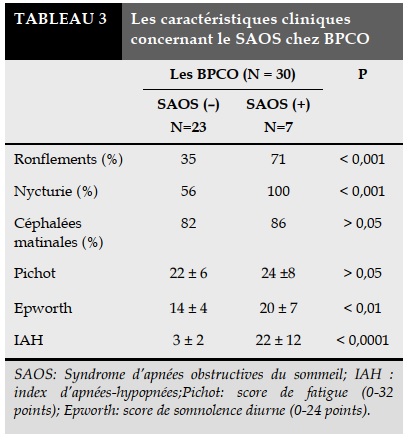
Les caractéristiques cliniques concernant le SAOS des patients BPCO sont montrés dans le Tableau 3.
Le pourcentage des BPCO ayant un SAOS avec ronflement et nycturie est plus élevé significativement par apport aux patients BPCO sans SAOS.
Il n’y a pas de différence significative pour les céphalées matinales, le score de Pichot entre les BPCO avec ou sans SAOS.
Le score d’ Epworth et l’index d’apnées-hypopnées dans les BPCO avec SAOS sont plus élevés que ceux sans SAOS
La corrélation entre l’IAH et les signes cliniques chez BPCO avec SAOS
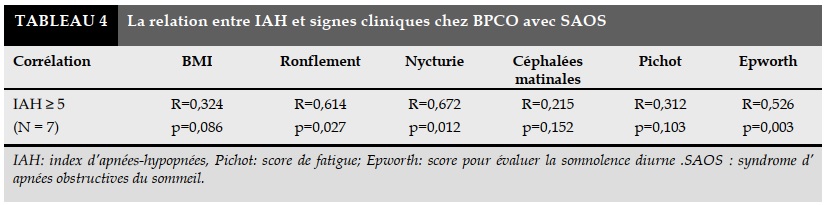
La corrélation entre SAOS (IHA ≥ 5) et les signes cliniques chez BPCO est présentée dans le Tableau 4.
Il n’existe pas de corrélation significative entre l’ index apnées-hypopnées et l’IMC, les céphalées matinales et les scores de fatigue de Pichot chez les patients atteints de BPCO ayant un SAOS. Il y a la corrélation significative entre l’index d’IAH avec le ronflement, la nycturie et le score d’Epworth.
DISCUSSION
Les résultats montrent: 1) Le taux des BPCO atteints d’OLS est plus élevé que celui des patients sans BPCO ; 2) Les BPCO ont des troubles du sommeil qui sont plus sévères que dans le groupe de contrôle.
Cela se manifeste par l’index de micro-éveil, apnéeshypopnées et hypoxémie nocturne ; 3) Il y a une corrélation étroite entre l’index apnées-hypopnées et le ronflement, la nycturie et le score d’Epworth. Le taux des BPCO atteints de SAOS est plus élevé que celui de non-BPCO (23% vs 10% ; Tableau 1).
Malgré la différence non-significative sur l’âge, le sexe, chez les BPCO, l’index de masse corporelle était plus basse que celui du groupe de contrôle.
Cependant, la fréquence du SAOS était très variée selon les études. Dans une étude sur la population nombreuse, Sanders et col. [10] ont montrés qu’il n’y a eu pas de différence de l’IAH entre des patients BPCO moyenne et sévère et dans la population générale. Selon certains auteurs, la prévalence du SAOS est variée selon l’âge des patients sains et même avec les BPCO [11, 12].
Dans une étude récente, Weitzenblum et col. [13] a trouvé que la BPCO n’est pas un facteur en faveur de l’apparition du SAOS et la coexistence des deux pathologies sont un hasard et n’est pas la cause l’une à l’autre. Cependant, plusieurs auteurs recommandent de réaliser une polysomnographie (PSG) chez les patients BPCO ayant des signes évocateurs de SAOS comme une somnolence diurne, une nycturie ou une hypertension artérielle pulmonaire sévère qui n’est
pas équivalent au degré d’obstruction bronchique et désaturations au repos.
Au contraire, il faut réaliser une spirométrie systé-matiquement pour les patients ayant un SAOS,
ayant fumés et ayant des signes évocateurs de BPCO (toux, expectoration, dyspnée à l’effort) afin de faireun éventuel diagnostic d’ OSL au cours de premier mois après la mise en place de la prothèse. Dans notre étude, il y avait 5 cas de déplacement de la prothèse après la mise en place. Parmi eux, il était impossible de remettre la prothèse pour 2 cas ; 4 cas ont été remis les prothèses pendant un mois après la mise en place. Au total, il y avait de 24,13% des cas ayant cette complication qui ont été observés dans notre étude.
D’après notre expérience, cette complication est liée à la trachéomalacie de moyen ou grave sévérité. Notre étude a montré que les BPCO ont une qualité de sommeil mauvaise, manifestée par l’index de micro-éveil qui est plus élevé significativement par rapport au groupe de contrôle (Tableau 2).
Le taux de patients BPCO ayant un ronflement, un index d’apnées-hypopnées (IAH) et des désaturations nocturnes était plus élevé que dans le groupe de contrôle.
Les autres études ont montré que les désaturations nocturnes chez les BPCO avec SAOS sont plus basses que celles sans SAOS ayant le même degré d’obstruction bronchique [14]. Cette caractéristique aggrave les maladies cardiaques ainsi que les complications cardio-vasculaires. Les désaturations qui sont fréquentes chez BPCO ayant un sommeil paradoxal de mauvaise qualité sont considérées comme la cause d’hypertension artérielle pulmonaire . Plusieurs études ont prouvés que la qualité du sommeil est améliorée significativement par une oxygénotherapie de dose faible avec lunettes nasales [15].
En ce qui concerne les signes cliniques, chez les patients BPCO ayant un SAOS, il y a seulement les ronflements, les nycturies et la somnolence diurne évalués par le score d’Epworth ont le taux élevés et sont corrélés avec IAH (Tableaux 3-4). Ce sont des signes très utiles pour détecter un SAOS chez les patients BPCO.
Les autres signes assez fréquents de SAOS dans la population générale tels que obésité, céphalées matinales, fatigue diurne ne sont pas corrélés avec l’IAH des BPCO. Donc il faut effectuer un enregistrement par PSG pour les patients BPCO ayant des signes de suspicion de l’OAS.
Le dépistage précoce de l’OLS et la mise en route d’un traitement convenable, en particulier pour le SAOS sévère (IAH ≥ 30 fois/heure), par la ventilation en pression positive continue (PPC) peuvent améliorer la mortalité et la survie des patients BPCO.
Selon une étude récente, Marin et col. [7] ont montrés que le traitement efficace par CPAP chez les SAOS (228 BPCO de degré moyen) a permis de réduire la fréquence des décompensations respiratoires et le nombre d’hospitalisations ainsi que la mortalité totale comme pour les BPCO de même niveau sans SAOS (210 patients). Cependant l’efficacité de ce traitement doit être vérifiée par la polygraphie ou la polysomnographie.
CONCLUSION
Le syndrome d’apnées obstructives du sommeil est plus fréquent chez les patients BPCO que dans la population générale. L’OLS peut aggraver les complications et augmenter la mortalité chez les BPCO. Il faut dépister en routine cette affection chez les patients BPCO pour envisager un traitement convenable. Cependant, il faut avoir des études avec un nombre de participants beaucoup plus élevés pour identifier les caractéristiques communes de cette pathologie chez les BPCO au Vietnam. Grâce à ces données, une prise en charge convenable et des recommandations multidisciplinaires liées aux soins des troubles du sommeil chez BPCO seront envisagées.
Remerciements
Les auteurs remercient les collègues, membres de l’AFVP et ceux du Collège de Médecine de Lam Dong.
CONFLIT D’INTERÊTS
Aucun.
REFERENCES
1. Flenley D.C. Sleep in chronic obstructive lung disease. Clin Chest Med 1985 ; 6 : 51-61.
2. Guilleminault C., Cummiskey J., Motta J. Chronic obstructive airflow disease and sleep studies. Am Rev Respir Dis 1980 ; 122 : 397-406.
3. Chaouat A., Weitzenblum E., Krieger J., Ifoundza T., Oswald M., Kessler R. Association of chronic obstructive pulmonary disease and sleep apnea syndrome. Am Rev Respir Dis 1995; 151 : 82-86.
4. Cully J.A., Graham D.P., Stanley M.A., Ferguson C.J., Sharafkhaneh A., Souchek J., et al. Quality of life in patients with chronic obstructive pulmonary disease and comorbid anxiety or depression. Psychosomatics 2006 ; 47 : 312-319.
5. Duran J., Esnaola S., Rubio R., Iztueta A. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 years. Am J Respir Crit Care Med 2001; 163: 685-689.
6. Chaouat A, Weitzenblum E, Kessler R, Schott R, Charpentier C, Levi-Valensi P, Zielinski J, Delaunois L, Cornudella R, Moutinho dos Santos J. Outcome of COPD patients with mild daytime hypoxaemia with or without sleep-related oxygen desaturation. Eur Respir J 2001 ; 17 : 848-55.
7. Marin JM, Soriano JB, Carrizo SJ, Boldova A, Celli BR. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med. 2010;182:325-31.
8. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2007;176: 532-55.
9. Lewis C.A., Fergusson W., Eaton T., Zeng I., Kolbe J. Isolated nocturnal desaturation in COPD: prevalence and impact on quality of life and sleep. Thorax 2009 ; 64 : 133-138.
10. Sanders M.H., Newman A.B., Haggerty C.L., Redline S., Lebowitz M., Samet J., et al. Sleep and sleepdisordered breathing in adults with predominantly mild obstructive airway disease. Am J Respir Crit Care Med 2003 ; 167 : 7-14.
11. Bednarek M., Plywaczewski R., Jonczak L., Zielinski J. There is no relationship between chronic obstructive pulmonary disease and obstructive sleep apnea syndrome: a population study. Respiration 2005 ; 72 : 142- 149.
12. Fleetham J.A. Is chronic obstructive pulmonary disease related to sleep apnea-hypopnea syndrome? Am J Respir Crit Care Med 2003 ; 167 : 3-4.
13. Weitzenblum E., Chaouat A., Kessler R., Canuet M., Hirschi S. The Overlap Syndrome: Association of COPD and Obstructive Sleep Apnoea. Rev Mal Respir 2010 ; 27 : 329-340.
14. Vos P.J.E., Folgering H.T.M., Van Herwaarden C.L.A. Predictors for nocturnal hypoxaemia (mean SaO2 <90 %) in normoxic and mildly hypoxic patients with COPD. Eur Respir J 1995 ; 8: 74-77.
15. McNicholas W.T. Chronic obstructive pulmonary disease and obstructive sleep apnea. Am J Respir Crit Care Med 2009 ; 180 : 692-700.
REFERENCES
1. Flenley D.C. Sleep in chronic obstructive lung disease. Clin Chest Med 1985 ; 6 : 51-61.
2. Guilleminault C., Cummiskey J., Motta J. Chronic obstructive airflow disease and sleep studies. Am Rev Respir Dis 1980 ; 122 : 397-406.
3. Chaouat A., Weitzenblum E., Krieger J., Ifoundza T., Oswald M., Kessler R. Association of chronic obstructive pulmonary disease and sleep apnea syndrome. Am Rev Respir Dis 1995; 151 : 82-86.
4. Cully J.A., Graham D.P., Stanley M.A., Ferguson C.J., Sharafkhaneh A., Souchek J., et al. Quality of life in patients with chronic obstructive pulmonary disease and comorbid anxiety or depression. Psychosomatics 2006 ; 47 : 312-319.
5. Duran J., Esnaola S., Rubio R., Iztueta A. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 years. Am J Respir Crit Care Med 2001; 163: 685-689.
6. Chaouat A, Weitzenblum E, Kessler R, Schott R, Charpentier C, Levi-Valensi P, Zielinski J, Delaunois L, Cornudella R, Moutinho dos Santos J. Outcome of COPD patients with mild daytime hypoxaemia with or without sleep-related oxygen desaturation. Eur Respir J 2001 ; 17 : 848-55.
7. Marin JM, Soriano JB, Carrizo SJ, Boldova A, Celli BR. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med. 2010;182:325-31.
8. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2007;176: 532-55.
9. Lewis C.A., Fergusson W., Eaton T., Zeng I., Kolbe J. Isolated nocturnal desaturation in COPD: prevalence and impact on quality of life and sleep. Thorax 2009 ; 64 : 133-138.
10. Sanders M.H., Newman A.B., Haggerty C.L., Redline S., Lebowitz M., Samet J., et al. Sleep and sleepdisordered breathing in adults with predominantly mild obstructive airway disease. Am J Respir Crit Care Med 2003 ; 167 : 7-14.
11. Bednarek M., Plywaczewski R., Jonczak L., Zielinski J. There is no relationship between chronic obstructive pulmonary disease and obstructive sleep apnea syndrome: a population study. Respiration 2005 ; 72 : 142- 149.
12. Fleetham J.A. Is chronic obstructive pulmonary disease related to sleep apnea-hypopnea syndrome? Am J Respir Crit Care Med 2003 ; 167 : 3-4.
13. Weitzenblum E., Chaouat A., Kessler R., Canuet M., Hirschi S. The Overlap Syndrome: Association of COPD and Obstructive Sleep Apnoea. Rev Mal Respir 2010 ; 27 : 329-340.
14. Vos P.J.E., Folgering H.T.M., Van Herwaarden C.L.A. Predictors for nocturnal hypoxaemia (mean SaO2 <90 %) in normoxic and mildly hypoxic patients with COPD. Eur Respir J 1995 ; 8: 74-77.
15. McNicholas W.T. Chronic obstructive pulmonary disease and obstructive sleep apnea. Am J Respir Crit Care Med 2009 ; 180 : 692-700.
ARTICLE INFO
DOI: 10.12699/jfvp.4.11.2013.35
Conflict of Interest
Non
Date of manuscript receiving
12/01/2013
Date of publication after correction
15/4/2013
Article citation
Duong-Quy S, Huynh-Anh T, Soyez F. Study of characteristics of obstructive sleep apnea in patients with COPD. J Func Vent Pulm 2013;04(11):35-40.