
 English
English
 French
French
Epidemiological, clinical and evolutionary profile of obstructive sleep apnea syndrome in Department of Respiratory Diseases of the CHU Ibn Rochd in Casablanca
Profil épidémiologique, clinique et évolutif du syndrome d’apnées obstructives du sommeil au Service des Maladies Respiratoires du CHU Ibn Rochd de Casablanca
N. Zaghba, K. Chaanoun, H. Benjelloun, N. Yassine
Service des Maladies Respiratoires. CHU Ibn Rochd de Casablanca. Maroc
Corresponding author
Dr Chaanoun Khadija
Service des Maladies Respiratoires CHU Ibn Rochd de Casablanca Maroc.
E-mail: chaanounkhadija@gmail.com
DOI: 10.12699/jfvpulm.12.36.2021.47
ABSTRACT
Introduction. Obstructive sleep apnea syndrome (OSAS) is an affection that constitutes a public health problem because of its impact on quality of life and its implication in many cardiovascular pathologies.
Patients and methods. A retrospective study of 343 hospitalized patients in the service of respiratory diseases of Ibn Rochd University Hospital of Casablanca for suspicion of OSAS over a period of 12 years. The diagnosis of OSAS was confirmed in 238 (69%) patients, by ventilatory polygraphy in 60% of the cases and by polysomnography in 9% of the cases.
Results. In the population with OSAS, the mean age was 49.8 years with a female predominance. Obesity was the main risk factor found in 85%, followed by high blood pressure in 67% of cases. A high probability of OSAS with a positive Berlin score was observed in 34% of patients. The middle abdominal perimeter was 102 cm and the middle neck circumference was 42 cm. A facio-truncular adiposity was found in 38% of the patients. SAOS was mild in 63% of the cases, moderate in 23% and severe in 14%. Hygiene and dietary rules were recommended in all our patients. The Continuous Positive Pressure was indicated in 24% of cases. Mandibular was prescribed in 86% of cases. Two percent received an Otorhinolarygological surgery. Bariatric surgery was indicated in 5% of cases.
Conclusion. OSAS is a frequent disease and its prevalence continues to increase with the increase in overweight and obesity, its main risk factor.
KEYWORDS: Obstructive sleep apnea syndrome; Obesity; Metabolic syndrome; Berlin score; Continuous Positive Pressure.
RÉSUMÉ
Introduction. Le syndrome d’apnées hypopnées obstructives du sommeil (SAHOS) est une affection qui constitue un problème de santé publique à cause de son impact sur la qualité de vie et son implication dans plusieurs pathologies cardiovasculaires.
Patients et méthodes. Etude rétrospective sur 343 patients hospitalisés au service des maladies respiratoires du CHU Ibn Rochd de Casablanca pour suspicion de SAHOS sur une période de 12 ans. Le diagnostic de SAHOS était confirmé chez 238 (69%) patients, par polygraphie ventilatoire dans 60% des cas et par polysomnographie dans 9% des cas.
Résultats. Dans la population atteinte de SAHOS, la moyenne d’âge était de 49,8 ans avec une prédominance féminine. L’obésité était le principal facteur de risque retrouvé dans 85 %, suivi de l’hypertension artérielle dans 67% des cas. Une forte probabilité de SAHOS avec un score de Berlin positif était observée dans 34 % des patients. Le périmètre abdominal moyen était de 102 cm et le tour du cou moyen était de 42 cm. Une adiposité facio-tronculaire était retrouvée dans 38 % des cas. Le SAHOS était léger dans 63 % des cas, modéré dans 23 % et sévère dans 14 %.Les règles hygiéno-diététiques étaient préconisées chez tous nos patients. La Pression Positive Continue était indiquée dans 24 % des cas. L'orthèse d’avancée mandibulaire était prescrite dans 86% des cas. Deux pour cent ont bénéficié d’un traitement chirurgical ORL. La chirurgie bariatrique était indiquée dans 5% des cas.
Conclusion. Le SAHOS est une maladie fréquente et sa prévalence continue d’accroître avec l’augmentation du surpoids et de l’obésité, son principal facteur de risque.
MOTS CLÉS: Syndrome d’apnées hypopnées obstructives du sommeil ; Obésité ; Syndrome métabolique ; Score de Berlin ; Pression positive continue
INTRODUCTION
Le syndrome d’apnées obstructives du sommeil (SAOS) est une pathologie dont la prévalence est estimée par la Haute Autorité de la Santé (HAS) à 2% chez la femme et 4% chez l’homme dans la population générale [1]. Les facteurs de risque du SAOS sont multiples Il s'accompagne de morbi-mortalités cardiovasculaire et accidentelle importantes, qui en font toute la gravité. Les conséquences socioprofessionnelles et familiales, liées notamment aux somnolences diurnes excessives, sont importantes : changements plus fréquents d'emplois, chômage de plus longue durée, désintégration de la cellule familiale avec divorces plus fréquents. Ces bouleversements finissent par retentir sur la personnalité des patients pouvant engendrer ou aggraver des troubles névrotiques et/ou dépressifs qui compliquent la prise en charge thérapeutique [2].
MATERIELS ET METHODES
Pour analyser notre expérience au service des maladies respiratoires du CHU Ibn Rochd de Casablanca, nous avons réalisé une étude rétrospective, descriptive et analytique faisant ressortir les aspects épidémiologiques, cliniques, thérapeutiques et évolutifs du syndrome d’apnées obstructives du sommeil. Elle a porté sur tous les patients adressés pour suspicion de SAHOS et ce sur une durée de 12 ans allant de janvier 2008 à octobre 2019.
Notre échantillon était constitué de 343 patients consultant pour suspicion de SAHOS, 60% des patients ont été référés des autres services du Centre Hospitalier Ibn Rochd (32% des patients ont été adressés de la cardiologie, 19% du service d’endocrinologie, 7% de la médecine interne, et 2% de la neurologie) et les 40% restants ont consulté d’eux même.
Tous les patients ont été hospitalisés au service pendant une ou deux nuits. Ils ont tous bénéficié d’un interrogatoire minutieux, d’un examen clinique complet, d’un bilan paraclinique complet ainsi que des enregistrements nocturnes. Les scores cliniques de dépistage du SAHOS : le score de probabilité clinique de Berlin et le score d’évaluation de la somnolence diurne excessive d’Epworth étaient remplis par les patients suspects d’avoir le SAHOS. L’interrogatoire a recherché également les antécédents des patients. Tous ces éléments de dépistage ont permis de recruter 343 patients suspects d’avoir un syndrome d’apnées obstructives du sommeil. Seuls les enregistrements nocturnes au cours du sommeil permettent le diagnostic du SAHOS. La polygraphie ventilatoire (PV) et/ou la polysomnographie (PSG) étaient réalisées chez tous les patients suspects tout en optimisant les conditions du sommeil (chambre calme, lumière éteinte, absence de bruit, sans prise de somnifères ou de sédatifs).
Les informations concernant les patients ont été recueillies et enregistrées sur une fiche d’exploitation qui a simplifié le recueil des différentes données épidémiologiques, cliniques, thérapeutiques et évolutives du SAHOS. L’analyse des résultats a été faite par le logiciel Excel.
RESULTATS
Caractéristiques de la population étudiée
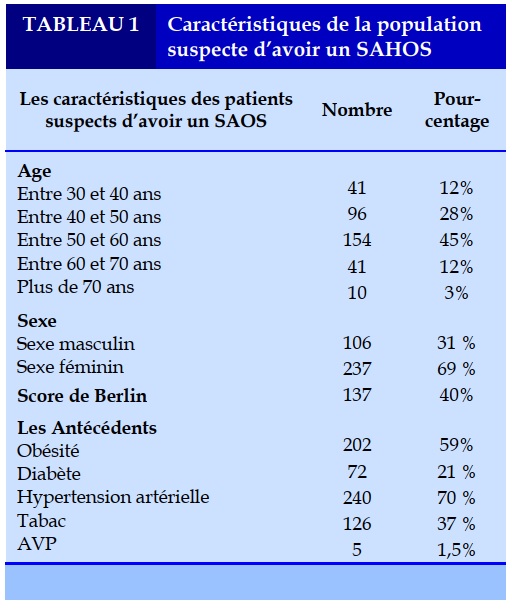
Notre population à l’étude était représentée par 343 patients suspects d’avoir un syndrome d’apnées obstructives du sommeil (SAHOS). Il s’agissait de 105 patients de sexe masculin, soit 31% et 238 patients de sexe féminin, soit 69 % avec un sexe ratio de 2,26. La moyenne d’âge était de 51,6 ans avec des extrêmes allant de 31 à 89 ans. Les tranches d’âge entre 40 et 60 ans sont les plus représentées dans notre étude. L’hypertension artérielle était le principal facteur de risque représenté dans 70% des cas. Le score de probabilité clinique de Berlin a été calculé chez tous nos patients suspects d’avoir un SAHOS, il était positif dans 40% des cas. Le score d’Epworth pour évaluer la somnolence diurne excessive a été calculé chez tous les patients, et il était positif dans 98 % des cas. (Tableau 1).
La confirmation du diagnostic de SAOS
Les enregistrements nocturnes du syndrome d’apnées obstructives du sommeil par la polygraphie ventilatoire (PV) et /ou la polysomnographie (PSG), ont été réalisés chez tous les patients suspects d’avoir un SAOS, et ils nous ont permis de confirmer le diagnostic de SAHOS chez 238 patients, soit 69% de l’ensemble des cas.
Caractéristiques de la population atteinte de SAHOS
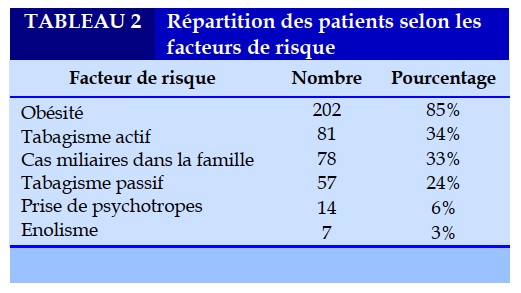
Parmi les patients atteints de SAHOS, on a noté une nette prédominance féminine de 67% (79 hommes et 159 femmes). La moyenne d’âge était de 49,8 ans avec des extrêmes allant de 33 à 78 ans. Les tranches d’âge entre 40 et 60 ans sont les plus représentées (74% des cas). L’obésité était le principal facteur de risque présent dans 85% des cas (Tableau 2).
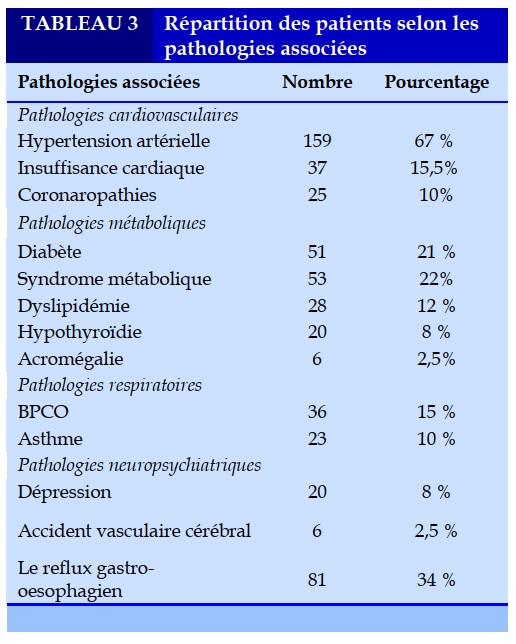
Sur le plan cardiovasculaire, parmi nos 238 patients atteints de SAHOS, 67% avaient une hypertension artérielle (HTA) (159 patients) dont 18% avaient une HTA résistante malgré la trithérapie. Un syndrome métabolique était noté chez 53 (22%) patients. Le SAHOS était aussi associé à des manifestations neuropsychiatriques. Vingt patients avaient une dépression (8%) et six patients avaient déjà fait un accident vasculaire cérébral (2,5%) (Tableau 3).
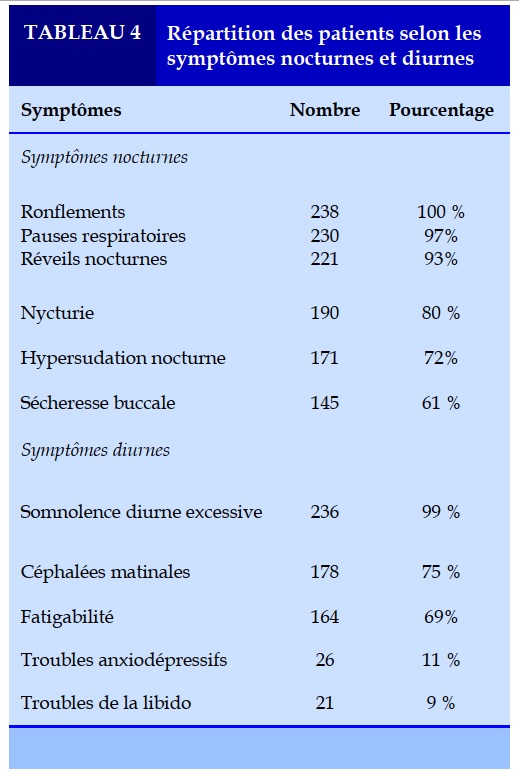
Les ronflements nocturnes ont été notés chez tous nos patients, les pauses respiratoires étaient présentes dans 97% des cas (Tableau IV). La somnolence diurne était évaluée par le score d’Epworth chez tous nos patients, elle était retrouvée dans 99% des cas. Les autres symptômes diurnes sont présentés dans le Tableau 4.
Le score de Berlin est un questionnaire destiné à caractériser la probabilité clinique du SAHOS. Une forte probabilité de SAHOS avec un score de Berlin positif était observée chez 81(34%) patients dont 30 (13 %) patients avaient 2 catégories positives et 51 (21%) patients avaient 3 catégories positives.
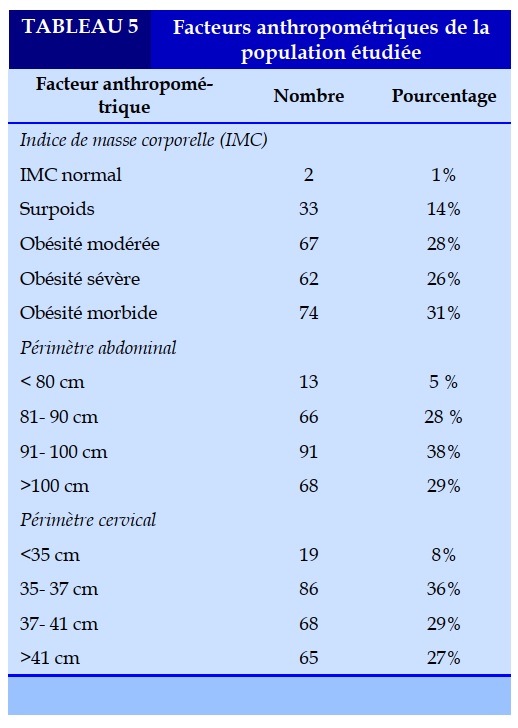
L’index de masse corporelle (IMC) moyen était de 38 Kg/m2 avec des extrêmes entre 26 et 57 kg/m². L’obésité a été noté dans 85% des cas, un IMC normal était observé chez seulement 1% de nos malades.
Le périmètre abdominal (PA) moyen était de 102 cm, avec des extrêmes entre 63 et 160 cm. Soixante-huit (29%) patients avaient un périmètre abdominal supérieur à 100 cm. Le périmètre cervical moyen était de 42 cm, 65 (27%) patients avaient périmètre cervical supérieur à 41 cm. Une adiposité facio-tronculaire a été observée chez 90 (38%) patients (Tableau 5).
Dans notre étude, le diagnostic de SAHOS a été porté par deux types d’enregistrements nocturnes : la polygraphie ventilatoire et la polysomnographie. La polygraphie ventilatoire a été réalisée chez tous nos patients suspects d’avoir un SAHOS. Elle a permis de confirmer le diagnostic de SAHOS dans 60 % des cas. Chez les patients ayant une forte probabilité clinique (Berlin positif) et une polygraphie ventilatoire négative, une polysomnographie a été effectuée confirmant le SAHOS chez 9% des patients.
L’index d’apnée hypopnée (IAH) moyen était de 18,3 événements par heure, avec des extrêmes allant de 0 à 51 événements par heure. L’index de désaturation moyen était de 21,3 (extrêmes entre 6 - 75). Le nombre de désaturation moyen était de 89,2 (extrêmes entre 1,4 - 375). La saturation percutanée en oxygène variait entre 70% et 96% avec une moyenne de SpO2 de 94%.
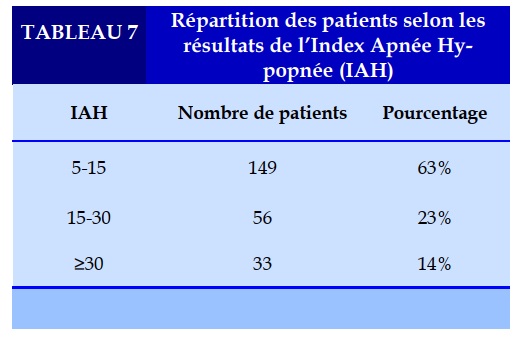
La sévérité du SAHOS prend en compte deux composantes : l’index d’apnée hypopnée (IAH) et l’importance de la somnolence diurne excessive (SDE), cette dernière est évaluée par le score d’Epworth après exclusion d’une autre cause de somnolence, elle était légère dans 29% des cas, modérée dans 62% des cas, et sévère dans 9% des cas. La sévérité du SAHOS selon les résultats de l’Index Apnée Hypopnée (IAH) est représenté dans le Tableau 7.
Tous les patients ayant un SAHOS confirmé, ont bénéficié d’une prise en charge adéquate selon sa sévérité.
Les mesures hygiéno-diététiques ont été préconisées chez tous les patients, notamment une éducation sur l’importance d’observer une hygiène du sommeil, avec des horaires de sommeil relativement stables d’une nuit à l’autre, afin d’éviter toute privation de sommeil qui majore l’apparition de SAHOS et de somnolence diurne excessive.
Pour les patients ayant un index de masse corporelle dépassant 28kg/m2, soit 85% des patients, un régime hypocalorique et une activité physique régulière et adaptée ont été proposés. Ces patients ont été adressés chez le nutritionniste.
Tous les patients tabagiques chroniques (34% des cas) ont bénéficié d’un conseil minimal pour les sensibiliser sur les méfaits du tabac. Vingt-deux (9%) patients étaient prêts à arrêter de fumer et ont été adressés à la consultation d’aide au sevrage tabagique.
Concernant les autres habitudes toxiques (alcool, autres drogues…), 26 (10,5%) patients étaient adressés à la consultation d’addictologie. Onze (5%) patients avaient un SAHOS positionnel, la mise en place d’une balle de tennis attachée dans le dos, évitant le décubitus dorsal leur a été préconisée.
La prise en charge du SAHOS s'est accompagnée d'une prise en charge optimale des comorbidités : cardiovasculaires chez 220 (92,4%) des patients, métaboliques chez 158 (66,3%) des cas avec une prise en charge du RGO dans 34% des cas.
La pression positive continue (PPC) a été indiquée chez 57 (24%) patients dont 33 (14%) patients avaient un SAHOS sévère et 24 (10%) patients avaient un SAHOS modéré avec une comorbidité cardiovasculaire.
L'orthèse d’avancée mandibulaire était indiquée chez 205 (86%) patients, dont 149 (63%) patients avaient un SAHOS léger et 56 (23%) autres avaient un SAHOS modéré. Cependant, seulement six patients y ont adhéré et sont toujours suivis, les autres ont été perdus de vue.
La réduction de la masse corporelle par le biais de la chirurgie bariatrique était indiquée chez 11 (5%) patients ayant une obésité morbide et sévère. Une chirurgie ORL était indiquée chez 16 patients dont 11 (5%) cas pour une hypertrophie amygdalienne et 5 (2%) patients pour une déviation septale. Enfin, une chirurgie d’adénome hypophysaire était préconisée chez cinq (2,5%) patients.
De manière générale, un patient est considéré comme perdu de vue à partir d’un certain délai pour lequel il ne s’est pas présenté en consultation spécialisée de suivi. Malheureusement, la majorité de nos patients ont été perdus de vue (175 patients soit 73,5% des cas), ce qui a rendu leur prise en charge incomplète. Et par conséquent, le suivi à long terme, qui doit être fait de préférence à vie n’a pas pu être réalisé chez la plupart de nos patients.
Encore une fois, nos résultats pointent les difficultés rencontrées dans l’évolution. Ainsi parmi les 57 patients pour lesquels la PPC était indiquée 25 d’entre eux ont refusé la PPC et 20 autres l’ont rejeté, et seulement 12 patients sont toujours suivis sous PPC. Pour les 205 patients pour lesquels l’orthèse d’avancée mandibulaire (OAM) était indiquée seulement six sont suivis et les autres sont perdus de vue.
DISCUSSION
Le syndrome d’apnées du sommeil correspond à des épisodes répétitifs de collapsus partiel ou complet du pharynx survenant au cours du sommeil. Ce collapsus se produit en regard du voile du palais et/ou en arrière de la base de la langue. Au cours de l’inspiration, la perméabilité du pharynx est normalement maintenue par la contraction des muscles dilatateurs du pharynx. Le collapsus va apparaître lors d’un déséquilibre entre la force générée par la contraction de ces muscles dilatateurs et la pression négative inspiratoire qui tend à collaber le pharynx. Il peut s’agir d’un collapsus complet du pharynx responsable d’apnées ou incomplet générant des hypopnées, événements de limitation inspiratoire de débit ou des ronflements [3].
Dans les années ayant suivi la découverte de la maladie, les moyens d’investigations étaient limités ne permettant pas la mise en place d’études de cohorte de grande envergure. Depuis la fin des années 1980, le développement de la polysomnographie (PSG) a permis la constitution de quatre cohortes épidémiologiques, trois américaines et une espagnole, de grande ampleur :
La Wisconsin Sleep Cohort Study (WSCS), débutée en 1989 et ayant inclus 1522 sujets âgés de 30 à 60 ans ;
La Sleep Heart Health Study (SHHS), mise en place en 1994 et portant sur 6342 sujets âgés de 40 à 100 ans ;
La Southern Pennsylvania Cohort (SPC), initiée en 1996 et qui a inclus 1741 sujets entre 20 et 100 ans ;
La Victoria-Gasteiz, Spain Cohort (VGSC), mise en place en 1993 et portant sur 2148 sujets âgés de 30 à 70 ans [4].
La prévalence du SAHOS est de 3,1 à 7,5 % de la population adulte masculine et de 1,2 à 4,5 % de la population adulte féminine. En moyenne, on considère qu'environ 5 % de la population des pays développés ont un SAHOS associant IAH élevé et des symptômes [5].
Les facteurs de risque du SAHOS sont multiples, l’obésité est le facteur le plus important essentiellement en raison de l’infiltration des tissus mous oro-pharyngés, on admet qu’une augmentation de 10 % du poids multiplie par 6 le risque de développer un SAHOS [6]. Dans notre série, ce facteur a été retrouvé chez 85% des patients. L’âge constitue également un facteur de risque, en effet la prévalence du SAHOS augmente avec l’âge, elle dépasse les 20 % chez les personnes âgées de plus de 70 ans. Hinzer [7] a retrouvé que parmi 2121 patients qui ont été diagnostiqués porteurs de SAHOS, 57% (n=1219) étaient âgés entre 40 et 60 ans, et 43% (n=902) étaient de plus de 60 ans. Le SAHOS est deux à trois fois plus fréquent chez les hommes que chez les femmes dans les principales cohortes [8]. Au-delà de 50ans, la prévalence du SAHOS chez les femmes augmente suggérant que la ménopause pourrait être un facteur de risque de SAHOS. Les données des études de la cohorte de Pennsylvanie montrent une prévalence du SAHOS de 3,9 % chez les hommes et de 1,2 % chez les femmes, soit un rapport homme/femme à 3,3/1 [9]. Les autres facteurs de risques sont hormonaux (grossesse, acromégalie, hypothyroïdie), héréditaires (morphologie crânio-faciale), le tabagisme et à la prise d’alcool et de sédatifs.
Le tableau clinique associe principalement des symptômes nocturnes avec un sommeil agité, associé ou non à des éveils fréquents, une nycturie, des ronflements sonores entrecoupés d’arrêts respiratoires et des symptômes diurnes à type de somnolence diurne excessive non expliquée par une autre cause, d’asthénie matinale, de troubles de concentration et d’attention et de céphalées. Des échelles subjectives de somnolence existent pour aider le clinicien à quantifier la sévérité de la somnolence diurne. La plus répandue est l’échelle de somnolence d’Epworth, créé par Johns en 1991 [10], c’est un auto-questionnaire qui évalue de 0 (aucun risque) à 3 (haut risque) le risque de somnoler dans huit situations, principalement passives, de la vie quotidienne.
L’examen clinique repose sur la mesure de l’indice de masse corporelle (IMC) ainsi que les mesures anthropométriques (périmètre cervical, abdominal et le tour de hanche). L’examen oto-rhnio-laryngologique recherche les anomalies morphologiques prédisposant au collapsus des VAS (rétrognathie, taille des amygdales, volume et dorsalisation de la langue, longueur du voile…).
Le critère standard de diagnostic du SAHOS étant la polysomnographie (PSG) mais elle ne peut pas être utilisée largement dans la communauté du fait du manque de machine, de personnel qualifié et de son coût élevé. D’où l’intérêt des questionnaires de dépistage rapides d’utilisation, peu coûteux utiles particulièrement dans les établissements des premiers soins médicaux. Le questionnaire de Berlin, créé en avril 1996 lors de la première Conférence sur le sommeil organisée à Berlin, comprend 10 questions divisées en 3 catégories, l’une portant sur le ronflement et les apnées, l’une sur la somnolence et la dernière sur l’hypertension. Chaque catégorie devient positive si son score est ≥ 2, la positivité d’au moins deux des trois catégories dépiste un sujet à haut risque de SAHOS. Dans notre étude une forte probabilité de SAHOS avec un score de Berlin positif était observée dans 34% des cas, dont 13% avaient 2 catégories positives et 21% avaient 3 catégories positives. Le questionnaire STOP BANG a été élaboré en 2008 et validé pour dépister le SAHOS en consultation pré-anesthésique afin de repérer les patients à risque de complications respiratoires post-opératoires. Sa positivité est établie lorsqu’au moins 3 de ces 8 items sont retrouvés [11].
Le diagnostic de SAHOS repose nécessairement sur un enregistrement nocturne dont le “gold standard” est représenté par la polysomnographie (PSG) en laboratoire de sommeil, c’est un examen dont la complexité est inadaptée à la prévalence élevée du SAOS et contribue à un retard diagnostic évalué entre 2 et 60 mois selon les pays. Confrontée à la PSG en laboratoire, la polygraphie ventilatoire limitée à l’enregistrement des débits aériens, des efforts respiratoires et de la saturation oxyhémoglobinée a une sensibilité de 82 à 94 % et une spécificité de 82 à 100 %. L’oxymétrie seule permet une détection indirecte des apnées et hypopnées à partir des désaturations qu’elles occasionnent. En fonction des performances de l’oxymètre utilisé, et des seuils d’IAH choisis, l’oxymétrie à une sensibilité de 36 à 100 % (87,4± 3,8 %) et une spécificité de 23 à 99 % (64,9± 6,7 %). Elle ne permet pas de différencier les apnées centrales des apnées obstructives.
Le SAHOS est défini à partir des critères de l’American Academy of Sleep Médicine, par la présence des critères A ou B et du critère C :
A : Somnolence diurne excessive non expliquée par d’autres facteurs
B : Deux au moins des critères suivants non expliqués par d’autres facteurs
Ronflements sévères et quotidiens ;
Sensations d’étouffement ou de suffocation pendant le sommeil
Sommeil non réparateur
Fatigue diurne
Difficulté de concentration
Nycturie (plus d’une miction par nuit)
C : Critère polysomnographique ou polygraphique : index d’apnées-hypopnées supérieur ou égal à cinq par heure de sommeil[12].
La sévérité du SAOS prend en compte 2 composantes : l’IAH et l’importance de la somnolence diurne après exclusion d’une autre cause de somnolence. Le niveau de sévérité du SAHOS est défini par la composante la plus sévère [12].
Le SAHOS est associé à de nombreuses complications cardiovasculaires. Il est fréquent chez les patients qui ont une HTA résistante. En 2005, la Haute Autorité de Santé l’a inclus dans les causes potentielles d’HTA réfractaire. La maladie coronaire a été associée de manière indépendante au SAHOS, à la fois dans des études de la population générale et dans les études de populations de clinique de sommeil. La SHHS ‘’Sleep Heart Health Study’’ a documenté une association modeste entre le SAHOS et la maladie coronaire rapportée à l'interrogatoire. Chez des sujets avec un IAH supérieur à 11/heure, un facteur de risque de 1,27 a été observé [13].
Plusieurs cohortes de centres de sommeil ont trouvé une prévalence élevée de SAHOS chez des patients ayant une insuffisance cardiaque et une fonction systolique diminuée [14]. Dans la SHHS, les sujets ayant un IAH supérieur à 11/heure avaient un RR ajusté d'insuffisance cardiaque (diagnostic d'interrogatoire) de 2,38 comparé aux sujets ayant des index inférieurs [15]. Dans notre étude, l’insuffisance cardiaque était présente chez 15,5% des patients atteints de SAHOS.
Le SAHOS est très fréquent parmi les patients ayant un diabète de type II avec une prévalence allant jusqu'à 77 % [16]. L’étude de Reichmuth en 2005 [17] réalisée sur plus de 1300 patients a révélé que 14,7% des sujets avec un IAH ≥ 15/h étaient diabétiques comparativement à 2,8% des sujets ayant un IAH<5/h. L’équipe d’Eva Van Cauter, à Chicago en 2010, a identifié 77% de sujets ayant un SAHOS (IAH ≥ 5/h) parmi 60 diabétiques type 2 après la réalisation d’une polysomnographie (PSG) [18].
De nombreuses études épidémiologiques de populations ont trouvé une association indépendante entre l'AVC et le syndrome d'apnées du sommeil. La cohorte de Wisconsin a révélé un RR ajusté de 4,33 pour un IAH supérieur ou égal à 20/heure versus IAH inférieur à 5/heure. De plus, une étude longitudinale de quatre ans de cette cohorte montre une tendance à l'augmentation du risque d'AVC [19]. Le SAHOS peut causer une somnolence diurne et avoir un impact négatif sur le fonctionnement diurne comme la performance au travail, les fonctions motrices et neurocognitives, ces dysfonctions ont été impliquée comme facteur de risque pour les accidents de véhicule [20]. Plusieurs études ont établi une association entre SAHOS et dépression. Dans l'étude longitudinale de la cohorte du Wisconsin, les sujets ayant un IAH supérieur ou égal à 15/heure avaient un risque multiplié par 2,6 de développer une dépression après ajustement pour les variables confondantes.
Il est illusoire de proposer un traitement spécifique du SAHOS en l'absence de mise en place de règles de vie. Les patients doivent observer une hygiène de sommeil, avec des horaires de sommeil relativement stables d'une nuit à l'autre, afin d'éviter toute privation de sommeil qui majore le risque d'apparition de troubles respiratoires au cours du sommeil [21]. Compte tenu de l'augmentation de la capacité des VAS à se collaber sous l'effet des sédatifs, il est nécessaire d'informer les patients du risque lié à la prise d'hypnotiques au coucher. Il en est de même avec l'alcool, justifiant l'interdiction de prise d'alcool le soir.
Dans 15 à 20 % des cas, le SAHOS est essentiellement positionnel, caractérisé par la survenue quasi exclusive des troubles respiratoires nocturnes lorsque les patients dorment en décubitus dorsal. Il est alors possible de proposer la mise en place d'une prothèse en mousse rigide attachée dans le dos, évitant la station en décubitus dorsal. Cette mesure suffit parfois à normaliser l'index d'apnées/hypopnées et à améliorer la qualité du sommeil [21].
La mise en place de mesures hygiéno-diététiques adaptées doit être proposée dès que l'index de masse corporelle est supérieur à 28 kg/m2, afin d'obtenir un amaigrissement significatif qui sera bénéfique pour la régression des troubles respiratoires nocturnes et pour l'amélioration des facteurs de risque cardiovasculaires [22].
Depuis l'article princeps de C.E. Sullivan en 1981 [23], la ventilation en pression positive continue (PPC) au masque nasal représente toujours le traitement le plus efficace du SAOS. Cette ventilation a pour but de lutter contre le collapsus inspiratoire des VAS en appliquant une véritable attelle pneumatique sur les parois des VAS. Cette pression est délivrée à partir d'un débit d'air provenant d'un générateur d'air sous pression.
La recherche d'une alternative thérapeutique en cas d'intolérance à la PPC a conduit au développement de la prothèse d’avancée mandibulaire, elle constitue une alternative intéressante (refus de PPC, SAOS modéré sans surpoids). Elle consiste à avancer la mandibule et permet un élargissement vélopharyngé et donc une diminution des résistances des voies aériennes. Son efficacité est bien démontrée.
Le but du traitement chirurgical est d'augmenter le calibre des VAS en corrigeant les anomalies anatomiques mises en évidence à l'examen oto-rhino-laryngologique [24]. Il peut agir en favorisant l'antériorisation des structures mandibulaires, en restaurant une position normale de l'appareil hyolingual et/ou en réduisant le contenu oropharyngé. L'avènement de l'uvulo-palato-pharyngoplastie a semblé apporter une solution moins invasive en proposant une réduction de la taille du voile du palais et une remise en tension des parois pharyngées, éventuellement associées à une amygdalectomie. Actuellement, cette technique est progressivement abandonnée au profit de la radiofréquence qui permet de réduire les douleurs et de limiter la dégradation anatomique irréversible. Le seul traitement chirurgical ayant fait la preuve d'une efficacité significative est la chirurgie d'avancée mandibulaire, éventuellement associée à une avancée simultanée du maxillaire supérieur.
Néanmoins, celle-ci ne peut être réalisée que par des équipes entraînées, en cas d'anomalie squelettique crâniofaciale telle qu'un important microrétrognathisme, et après explorations maxillofaciales spécialisées.
Certains traitements médicamenteux ont été proposés tels que les inhibiteurs de la recapture de la sérotonine ou les agonistes sérotoninergiques, ainsi que les antidépresseurs tricycliques tels que l'Anafranil, sans confirmation secondaire de leur efficacité sur la régression des troubles respiratoires au cours du sommeil. En revanche, le traitement d'une acromégalie ou d'une hypothyroïdie, dont la macroglossie associée à la pathologie peut s'accompagner d'un SAOS, permet généralement une normalisation ou une amélioration de l'index d'événements respiratoires obstructifs. Les dilatateurs narinaires ne représentent pas un traitement efficace du SAOS, bien que leur utilisation sous PPC puisse, en augmentant la perméabilité nasale, permettre d'obtenir une amélioration de la tolérance à la PPC associée à une meilleure observance.
La stimulation du nerf hypoglosse à l'aide d'une sonde implantée dans le muscle génioglosse reliée à un stimulateur de type pacemaker est en cours d'évaluation chez l'homme.
CONCLUSION
Le SAHOS est une maladie fréquente et sa prévalence continue d’accroitre avec l’augmentation du surpoids et de l’obésité, son principal facteur de risque. Les vastes études épidémiologiques mises en place ces dernières années ont permis de démontrer une relation statistique indépendante entre le SAHOS et les maladies cardiovasculaires et les troubles métaboliques. S’il existe un rationnel physiopathologique pour expliquer ces relations, l’impact réel du traitement du SAHOS sur ces comorbidités n’est pas clairement démontré à ce jour.
CONFLIT D’INTÉRÊT
Les auteurs déclarent ne pas avoir de liens d’intérêt
REFERENCES
1. Meslier N. Vol S, Balkau B, Gagnadoux F, Cailleau M, Petrella A, Racineux J.L, et al. Prévalence des symptômes du syndrome d’apnées du sommeil. Étude dans une population française d’âge moyen. Rev Mal Respir 2007; 24 : 305-13.
2. Bounhoure JP, Galinier M, Didier A, Leophonte P. Sleep apnea syndromes and cardiovascular disease. Bull Acad Nat Med. 2005 Mar; 189(3) : 445-59.
3. Pépin J-L, Lévy P, Tamisier R. Syndrome d’apnées obstructives du sommeil : diagnostic et modalités de traitement. Médecine des maladies Métaboliques - Mars 2008 - Vol. 2 - N°2.
4. Trzepizur W, Gagnadoux F. Epidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil. Rev Mal Resp (2014) 31, 568-577.
5. Escourrou P, Sériès F, Orvoen-Frija E, Meurice J.C, Birenneau V, Roisman G. Physiopathologie et épidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte. EMC Pneumologie 2015 ; 12(3) : 1-9 [Article 6-040-K-05].
6. Peppard PE, Young T, Palta M. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA 2000 ; 284: 3015–21.
7. Heinzer R, Vat S, Marques-Vidal P, Marti-Soler H. Prevalence of sleep-disordered breathing in the general population: the HypnoLaus study. Lancet Respir Med 2015; 3: 310–18.
8. Strohl K.P, Redline S. Recognition of obstructive sleep apnea Am J Respir Crit Care Med 1996 ;154: 279-289.
9. Bixler E.O, Vgontzas A.N, Lin H.M, et al. Prevalence of sleep-disordered breathing in women: effects of gender. Am J Respir Crit Care Med 2001 ; 163 : 608-613
10. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991 December ; 14(6):540–5.
11. Nagappa, Mahesh MD, Patra. Jayadeep PhD, Wong, Jean FRCPC, et al. Association of STOP-Bang Questionnaire as a Screening Tool for Sleep Apnea and Postoperative Complications: A Systematic Review and Bayesian Meta-analysis of Prospective and Retrospective Cohort Studies. Anesthesia & Analgesia: October 2017; Volume 125 - Issue 4: p 1301–1308.
12. Vishesh Kapur VK, Auckley DH, Chowdhuri S, Kuhlmann DC, Mehra R, Ramar K, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline J Clin Sleep Med. 2017 March 15; 13(3): 479–504.
13. Shahar E, Whitney C.W, Redline S, Lee E.T, Newman A.B, Nieto F.J, et al. Sleep disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163: 19-25.
14. Javaheri S. Sleep disorders in systolic heart failure: a prospective study of 100 male patients. The final report Int J Cardiol 2006 ; 106 : 21-28.
15. Galerneau L.M, Tamisier R, Benmerad M. Rigidité artérielle chez les patients obèses traités par PPC pour un syndrome d’apnées obstructives du sommeil (SAOS) : étude longitudinale prospective sur sept ans. Revue des Maladies Respiratoires January 2018; Volume 35, Supplement: Page A55.
16. Aronsohn R.S, Whitmore H, Van Cauter E, Tasali E. Impact of untreated obstructive sleep apnea on glucose control in type 2 diabetes. Am J Respir Crit Care Med 2010; 181: 507 513
17. Reichmuth KJ, Austin D, Skatrud JB, Young T. Association of sleep apnea and type II diabete : a population-based study. Am. J. Respir. Crit. Care Med., 2005; 172 (12) : 1590-95.
18. Eve Van Cauter, Renee, S. Aronsohn, Harry.Impact of untreated Obstructive Sleep Apnea on Glucose Control in Type 2 Diabetes. Am. J. Respir. Crit. Care., 2010.
19. Arzt M, Young T, Finn L, Skatrud J.B, Bradley T.D. Association of sleep-disordered breathing and the occurrence of stroke. Am J Respir Crit Care Med 2005 ; 172 : 1447-1451.
20. Ellen R.L, Marshall S.C, Palayew M, Molnar F.J, Wilson K.G, Man-Son-Hing M. Systematic review of motor vehicle crash risk in persons with sleep apnea. J Clin Sleep Med 2006 ; 2 : 193-200.
21. Meurice J.C. Démarche diagnostique et thérapeutique devant une suspicion de syndrome d'apnées obstructives du sommeil. EMC - AKOS (Traité de Médecine) 2006 :1-9 [Article 6-0645].
22. Ahari V, Ingrand P, Paquereau J, Levrat V, Neau J.P, Pinon B et al. Effect of a very low-calorie diet-induced weight loss in the treatment of obstructive sleep apnea syndrome. Proc Am Thorac Soc 2005 ; A231.
23. Sullivan CE, Issa FG, Berthon-Jones M, Eves L. ReversaI of obstructive sleep apnea by continuous positive airway pressure applied through the nares. Lancet 19B 1 ; 1 : 862- 865.
24. Chabolle F, Blumen M. Chirurgies et syndrome d'apnées du sommeil Rev Mal Respir 2004; 21 (suppl) : 2S86-2S88.
TABLES

REFERENCES
1. Meslier N. Vol S, Balkau B, Gagnadoux F, Cailleau M, Petrella A, Racineux J.L, et al. Prévalence des symptômes du syndrome d’apnées du sommeil. Étude dans une population française d’âge moyen. Rev Mal Respir 2007; 24 : 305-13.
2. Bounhoure JP, Galinier M, Didier A, Leophonte P. Sleep apnea syndromes and cardiovascular disease. Bull Acad Nat Med. 2005 Mar; 189(3) : 445-59.
3. Pépin J-L, Lévy P, Tamisier R. Syndrome d’apnées obstructives du sommeil : diagnostic et modalités de traitement. Médecine des maladies Métaboliques - Mars 2008 - Vol. 2 - N°2.
4. Trzepizur W, Gagnadoux F. Epidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil. Rev Mal Resp (2014) 31, 568-577.
5. Escourrou P, Sériès F, Orvoen-Frija E, Meurice J.C, Birenneau V, Roisman G. Physiopathologie et épidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte. EMC Pneumologie 2015 ; 12(3) : 1-9 [Article 6-040-K-05].
6. Peppard PE, Young T, Palta M. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA 2000 ; 284: 3015–21.
7. Heinzer R, Vat S, Marques-Vidal P, Marti-Soler H. Prevalence of sleep-disordered breathing in the general population: the HypnoLaus study. Lancet Respir Med 2015; 3: 310–18.
8. Strohl K.P, Redline S. Recognition of obstructive sleep apnea Am J Respir Crit Care Med 1996 ;154: 279-289.
9. Bixler E.O, Vgontzas A.N, Lin H.M, et al. Prevalence of sleep-disordered breathing in women: effects of gender. Am J Respir Crit Care Med 2001 ; 163 : 608-613
10. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991 December ; 14(6):540–5.
11. Nagappa, Mahesh MD, Patra. Jayadeep PhD, Wong, Jean FRCPC, et al. Association of STOP-Bang Questionnaire as a Screening Tool for Sleep Apnea and Postoperative Complications: A Systematic Review and Bayesian Meta-analysis of Prospective and Retrospective Cohort Studies. Anesthesia & Analgesia: October 2017; Volume 125 - Issue 4: p 1301–1308.
12. Vishesh Kapur VK, Auckley DH, Chowdhuri S, Kuhlmann DC, Mehra R, Ramar K, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline J Clin Sleep Med. 2017 March 15; 13(3): 479–504.
13. Shahar E, Whitney C.W, Redline S, Lee E.T, Newman A.B, Nieto F.J, et al. Sleep disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163: 19-25.
14. Javaheri S. Sleep disorders in systolic heart failure: a prospective study of 100 male patients. The final report Int J Cardiol 2006 ; 106 : 21-28.
15. Galerneau L.M, Tamisier R, Benmerad M. Rigidité artérielle chez les patients obèses traités par PPC pour un syndrome d’apnées obstructives du sommeil (SAOS) : étude longitudinale prospective sur sept ans. Revue des Maladies Respiratoires January 2018; Volume 35, Supplement: Page A55.
16. Aronsohn R.S, Whitmore H, Van Cauter E, Tasali E. Impact of untreated obstructive sleep apnea on glucose control in type 2 diabetes. Am J Respir Crit Care Med 2010; 181: 507 513
17. Reichmuth KJ, Austin D, Skatrud JB, Young T. Association of sleep apnea and type II diabete : a population-based study. Am. J. Respir. Crit. Care Med., 2005; 172 (12) : 1590-95.
18. Eve Van Cauter, Renee, S. Aronsohn, Harry.Impact of untreated Obstructive Sleep Apnea on Glucose Control in Type 2 Diabetes. Am. J. Respir. Crit. Care., 2010.
19. Arzt M, Young T, Finn L, Skatrud J.B, Bradley T.D. Association of sleep-disordered breathing and the occurrence of stroke. Am J Respir Crit Care Med 2005 ; 172 : 1447-1451.
20. Ellen R.L, Marshall S.C, Palayew M, Molnar F.J, Wilson K.G, Man-Son-Hing M. Systematic review of motor vehicle crash risk in persons with sleep apnea. J Clin Sleep Med 2006 ; 2 : 193-200.
21. Meurice J.C. Démarche diagnostique et thérapeutique devant une suspicion de syndrome d'apnées obstructives du sommeil. EMC - AKOS (Traité de Médecine) 2006 :1-9 [Article 6-0645].
22. Ahari V, Ingrand P, Paquereau J, Levrat V, Neau J.P, Pinon B et al. Effect of a very low-calorie diet-induced weight loss in the treatment of obstructive sleep apnea syndrome. Proc Am Thorac Soc 2005 ; A231.
23. Sullivan CE, Issa FG, Berthon-Jones M, Eves L. ReversaI of obstructive sleep apnea by continuous positive airway pressure applied through the nares. Lancet 19B 1 ; 1 : 862- 865.
24. Chabolle F, Blumen M. Chirurgies et syndrome d'apnées du sommeil Rev Mal Respir 2004; 21 (suppl) : 2S86-2S88.