
 English
English
 French
French
Pulmonary aspergillosis in all its forms: About 18 cases at the teaching hospital Hassan II of Fez
Aspergillose pulmonaire dans toutes ses formes: À propos de 18 cas au CHU Hassan II de Fès
Jb K. Agai1, P. Efalou2, M. Haloua3, Y. Alaoui Lamrani1, M. Boubbou3, M. Maaroufi1, B. Alami1,4
1: Service de Radiologie de l'hôpital des spécialités du CHU HASSAN II de Fès. Maroc
2: Service de Pneumologie du CHU Kara, Université de Kara. Togo
3: Service de Radiologie de l'hôpital Mère-Enfant du CHU HASSAN II de Fès. Maroc
4: Laboratoire de Biophysique de la Faculté de Médecine et de Pharmacie de l'université Sidi Mohamed Ben Abdellah de Fès. Maroc
Corresponding author
Dr AGAÏ K. Jean-Baptiste
Service de Radiologie de l'Hôpital des Spécialités du CHU HASSAN II
E-mail: akodjojeanbaptiste@gmail.com
DOI: 10.12699/jfvpulm.12.37.2021.43
ABSTRACT
Introduction. The objectives of this study were to identify the different forms of pulmonary aspergillosis at the Hassan II Teaching Hospital in Fez and to describe their main radio-clinical manifestations.
Methodology. Retrospective study on an analysis of the medical files of 18 patients diagnosed with pulmonary aspergillosis from 1st January 2016 to 30th June 2018 at HASSAN II Teaching Hospital in Fez (Morocco). Diagnostic confirmation has been established on radiological aspects, aspergillus serology and endoscopy in some cases.
Results. 18 cases were diagnosed. The mean age of the patients was 41 years with extremes of 20 years and 62 years old. We found a predominance of men with a ratio M / F of 2. The risk factors were dominated by tuberculosis (14 cases) and smoking (10 cases). The clinical signs were dominated by hemoptysis (16 cases) and cough (10 cases). Aspergillus serology carried out in 12 patients was positive in 9 patients. On imaging, these were retractile opacities or heterogeneous opacities. Two patients presented with the image of a "bell-like aspect". Aspergillosis cases were dominated by pulmonary aspergilloma (55.55%). All of our patients received systemic antifungal therapy. Aspergilloma cases also benefited from surgical excision. The outcome was favorable in 15 patients and we reported 3 deaths secondary to cataclysmic hemoptysis.
Conclusion. A good knowledge of aspergillus respiratory pathologies is important in order to evoke them early and to improve their prognosis. Computed tomography plays an important role in diagnosis.
KEYWORDS: Aspergillosis; Aspergilloma; Hemoptysis; Fes
RÉSUMÉ
Introduction. La présente étude avait pour objectifs d’identifier les différentes formes d’aspergillose pulmonaire au CHU Hassan II de Fès et décrire leurs principales manifestations radio-cliniques.
Méthodologie. Etude rétrospective portant sur une analyse des dossiers médicaux de 18 patients diagnostiqués pour aspergillose pulmonaire du 1er janvier 2016 au 30 Juin 2018 au CHU HASSAN II de Fès (Maroc). La confirmation diagnostique a été établie sur l’aspect radiologique, la sérologie aspergillaire et l’endoscopie dans certains cas.
Résultats. 18 cas ont été diagnostiqués. L’âge moyen des patients était de 41 ans avec des extrêmes de 20 ans et 62 ans. Nous avons retrouvé une prédominance masculine avec ratio H/F de 2. Les facteurs de risque étaient dominés par la tuberculose (14 cas) et le tabagisme (10 cas). Les signes cliniques étaient dominés par l’hémoptysie (16 cas) et la toux (10 cas). La sérologie aspergillaire, réalisée chez 12 patients, était positive chez 9 patients. A l’imagerie, il s’agissait d’opacités rétractiles ou d’opacités hétérogènes. Deux patients présentaient l’image d’un « aspect en grelot ». Les cas d’aspergillose étaient dominés par l’aspergillome pulmonaire (55,55%). Tous nos patients ont bénéficié d’un traitement antifongique systémique. Les cas d’aspergillome ont bénéficié en plus d’une exérèse chirurgicale. L’évolution était favorable chez 15 patients et nous avons déploré 3 décès secondaires à une hémoptysie cataclysmique.
Conclusion. Bien connaître les pathologies respiratoires aspergillaires est important afin de les évoquer précocement et d’en améliorer le pronostic. La tomodensitométrie joue un rôle important dans le diagnostic.
MOTS CLÉS: Aspergillose; Aspergillome; Hémoptysie; Fès
INTRODUCTION
L’aspergillose est une infection fongique due à des champignons du genre Aspergillus. On distingue l’aspergillose pulmonaire invasive (API) qui touche en principe un hôte sévèrement immunodéprimé, et l’aspergillose pulmonaire chronique (APC) qui touche des sujets peu ou pas immunodéprimés.
Les critères diagnostiques des différentes atteintes aspergillaires de la sphère broncho-pulmonaires font l’objet de définitions opérationnelles [1]. En effet, le diagnostic de l’aspergillose pulmonaire est souvent difficile à obtenir car les tests biologiques et la microbiologie sont d’un apport limité. L’imagerie représentée essentiellement par la tomodensitométrie (TDM) est devenue la pierre angulaire du diagnostic des aspergilloses pulmonaires. Parfois elle présente certaines limites en cas d’association avec d’autres pathologies et la seule preuve histologique permet de redresser le diagnostic.
Compte tenu de ces difficultés, le diagnostic de cette affection est souvent sous-évoqué, surtout dans nos milieux africains. Peu d’études ce sont intéressé à ces affections en Afrique où c’est affections seraient probablement sous-diagnostiqués.
En effet les principaux facteurs de risque de cette infection mycosique sont dominés par les immunodépressions locales et/ou généralisées notamment en rapport avec la tuberculose et le VIH [2]. Ces deux affections constituent un véritable problème de santé en milieu africain. La présente étude, initiée en vue de faire un état des lieux sur les cas d’aspergillose broncho-pulmonaire pris en charge au CHU Hassan II de Fès, avait pour objectifs de:
• Identifier les différentes formes d’aspergillose pulmonaire.
• Décrire les principales manifestations cliniques des aspergilloses broncho-pulmonaires.
• Décrire les présentations radiologiques des aspergilloses broncho-pulmonaires.
• Décrire les aspects thérapeutiques et évolutifs des aspergilloses broncho-pulmonaires.
METHODES
Il s’est agi d’une étude rétrospective portant sur une analyse des dossiers médicaux de 18 patients ayant été diagnostiqués et traités pour une aspergillose broncho-pulmonaire.
Nous avons eu recours aux dossiers de patients recensés sur une durée de 30 mois allant du 1er janvier 2016 au 30 Juin 2018 dans les services de Radiologie et de Pneumologie du Centre Hospitalier Universitaire HASSAN II de Fès (Maroc).
Tous les patients ont bénéficié d’un scanner thoracique injecté avec des coupes fines de 1,25mm et des reconstructions multiplanaires.
La confirmation diagnostique a été établie pour tous les patients en se basant sur: l’aspect radiologique, la sérologie aspergillaire et les données endoscopiques dans certains cas. Les définitions opérationnelles des différentes formes d’aspergillose pulmonaire se sont basées sur les critères diagnostiques préétablis [1].
Les patients ont été pris en charge dans le service de Pneumologie du centre hospitalisé. Les scanners thoraciques ont été interprétés par le radiologue et/ou le pneumologue. Les diagnostics ont été retenus de façon collégiale et sur la base des définitions opérationnelles.
Les données ont été collectées sur une fiche de collecte établie à cet effet et prenant en compte les données sociodémographiques, cliniques, paracliniques, thérapeutiques et évolutives. Les figures, textes et tableaux ont été établies à l’aide de Microsoft Office Word et Excel 2010.
RESULTATS
Données générales et facteurs de risque
Au total, 18 cas d’aspergillose pulmonaire ont été diagnostiqués durant la période d’étude. L’âge moyen de nos patients était de 41 ans avec des extrêmes de 20 ans et 62 ans. Nous avons retrouvé une prédominance masculine (12 hommes et 6 femmes) avec sex-ratio H/F de 2.
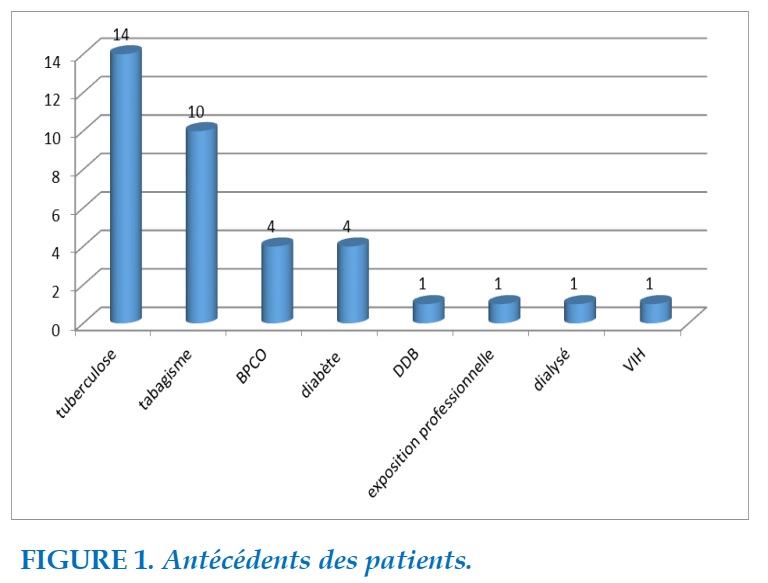
Les facteurs de risque (Figure 1) étaient dominés par la tuberculose (14 cas) et le tabagisme (10 cas).
FIGURE 1. Antécédents des patients.
Aspects cliniques
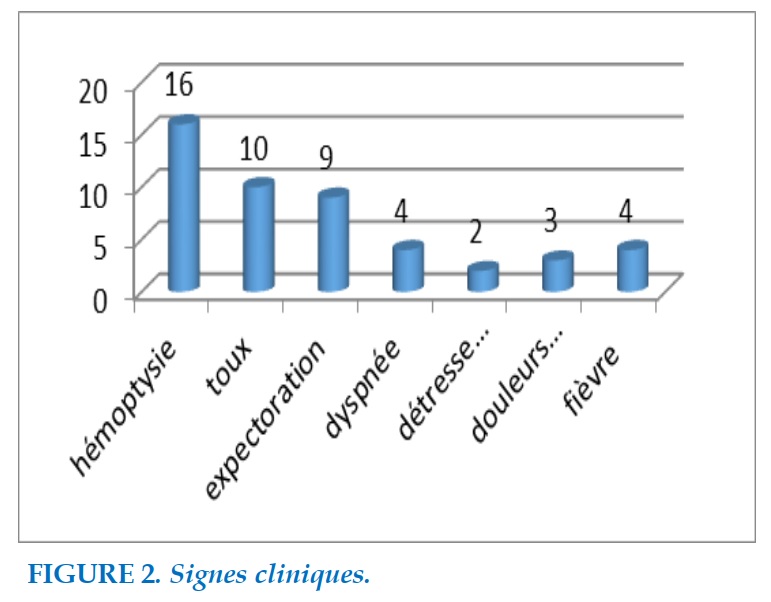
Les signes cliniques (Figure 2) retrouvés étaient dominés par l’hémoptysie (16 cas), la toux (10 cas) et les expectorations mucopurulentes (9 cas).
Données paracliniques
La sérologie aspergillaire a été réalisée chez 12 de nos patients. Elle était revenue positive chez 9 patients et négative chez 3 patients.
La fibroscopie bronchique, systématique dans le cadre du bilan diagnostique d’une hémoptysie, a été réalisée chez 16 patients. Elle a permis de visualiser directement la truffe aspergillaire dans 3 cas. Chez 7 patients, elle a objectivé un saignement provenant du côté de la lésion parenchymateuse par atteinte aspergillaire.
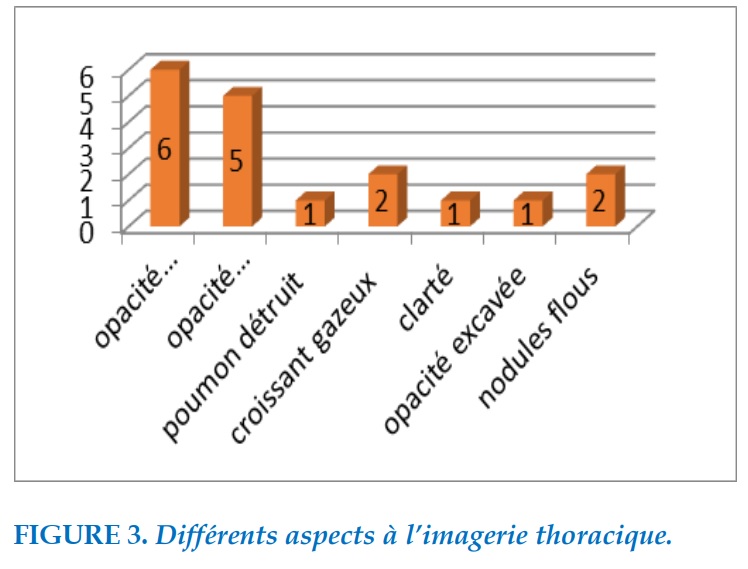
Tous les patients avaient réalisé une radiographie standard du thorax et un scanner thoracique avec injection de produit de contraste. Dans la majorité des cas, il s’agissait d’opacité rétractile ou d’opacité hétérogène. Deux (02) patients présentaient l’image caractéristique du croissant gazeux avec aspect en grelot. Un (01) patient présentait une opacité spiculée à centre excavé. Chez deux (02) patients, l’imagerie thoracique objectivait la présence d’opacités nodulaires intra parenchymateuses non spécifiques. Les différents aspects à l’imagerie thoracique sont représentés par la Figure 3.
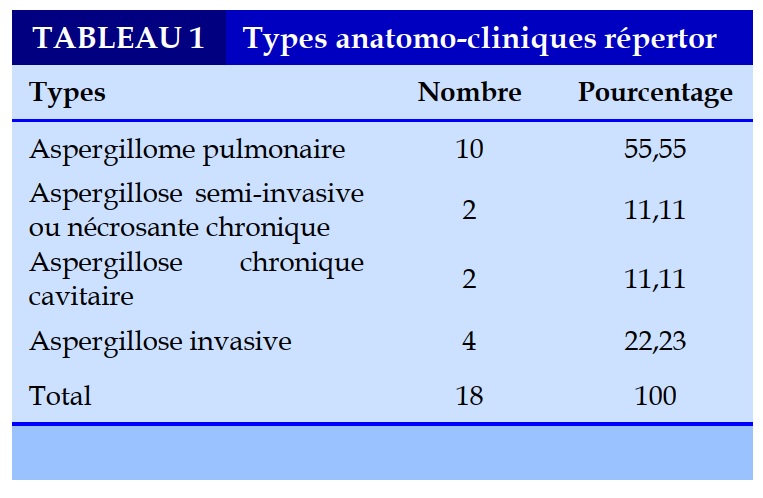
Types anatomo-cliniques d’aspergillose pulmonaire
Les différents cas d’aspergillose identifiés (Tableau 1) étaient dominés par l’aspergillome pulmonaire (55,55% des cas).
Aspects thérapeutiques
Tous nos patients porteurs d’aspergillome ont bénéficié d’une exérèse chirurgicale avec un traitement antifongique à base d’itraconazole en pré et post-opératoire.
Les quatre patients présentant une API ont bénéficié d’un traitement à base d’amphotéricine B.
Les autres patients ont bénéficié d’un traitement antifongique à base d’itraconazole.
La durée du traitement était fonction du type anatomoclinique et de la réponse au traitement initial.
Aspects évolutifs
L’évolution était favorable chez 15 de nos patients et nous avons déploré 3 décès au cours du traitement, tous secondaires à une hémoptysie cataclysmique. Parmi les 15 patients avec évolution favorable, on notait des séquelles radiologiques à type d’image spiculée (08 patients), cavité résiduelle séquellaire (4 patients) et une rémission ad integrum chez 3 patients.
DISCUSSION
La définition des infections aspergillaires broncho-pulmonaires reste vague et de nombreuses entités cliniques, radiologiques et anatomopathologiques ont été décrites avec deux grandes catégories: aspergillose pulmonaire invasive (API) et aspergillose pulmonaire chronique (APC). Une manière de classifier les différents types d’APC a été récemment proposée [1]: l’aspergillome, le nodule aspergillaire, l’APC cavitaire et fibrosante, l’APC nécrosante ou semi-invasive.
Néanmoins ces entités partagent des caractéristiques communes: altération locale ou systémique des défenses anti-infectieuses, expression clinique dépendante de l’exposition aspergillaire et de la sé vérité d’un éventuel déficit immunitaire général associé. Le diagnostic des différentes formes n’est pas toujours facile. La clinique permet d’orienter le diagnostic. La TDM thoracique reste l’examen complémentaire de choix.
L’aspergillome est souvent le résultat de la croissance de filaments mycéliens du genre Aspergillus dans les cavités séquellaires, le plus souvent, d’origine tuberculeuse. C’est ce qui ressort dans notre étude avec 77,77% des patients qui présentent des greffes aspergillaire sur séquelles de tuberculose. Cette fréquence élevée est comparable aux données de la littérature et pourrait être expliquée dans la présente étude par la susceptibilité du jeune-adulte masculin à diverses infections pulmonaires (tuberculose pulmonaire, pneumopathies répétitives parfois nécrosantes, tabagisme…) et en conséquence aux séquelles engendrées sur les structures broncho-pulmonaires, le rendant ainsi prédisposé aux complications infectieuses [2]. En cas d’aspergillose chronique nécrosante, les données de la littérature affirment l’association d’une maladie respiratoire chronique et une immunodépression générale modérée, qu’elle soit d’origine thérapeutique ou liée à un terrain particulier [3]. Il s’agit principalement dans cette série de BPCO et de séquelles de tuberculose.
Cette mycose est révélée principalement par des épisodes d’hémoptysie répétée. C’est ce qui a été rapporté dans notre série avec 16 de nos patients (soit 88.88%) qui présentaient une hémoptysie. Plusieurs études ont rapportés des résultats similaires [2,4,5]
Dans les aspergillomes, le cliché thoracique suffit le plus souvent à évoquer le diagnostic devant des modifications d’une cavité ancienne avec, dans plus de 60% des cas, l’apparition d’une image « en grelot ». La TDM possède un rendement diagnostic bien supérieur à la radiologie conventionnelle [6]. Le mycétome apparaît comme une masse arrondie ou ovalaire, parfois lobulée, bien limitée, dense et homogène, ne prenant pas le contraste, occupant la partie déclive d’une cavité pulmonaire. Des clichés positionnels montrent souvent le caractère mobile de cette masse. Si la masse mycélienne est de petite taille par rapport à la cavité, on retrouve « l’image en grelot » caractéristique de l’aspergillome. Si la masse occupe la presque-totalité de la cavité, la lésion est en général surmontée d’un « croissant gazeux » ou ménisque. Le signe du croissant gazeux peut ne pas être observé, en cas de volumineuse masse fungique remplissant totalement la cavité. Dans ce contexte la comparaison avec les anciens examens d’imagerie est nécessaire et permet de redresser le diagnostic [7]. On observe souvent un épaississement pleural en regard de l’aspergillome. Cet épaississement pleural ou pachypleurite est le siège d’une hypervascularisation systémique transpleurale dont il faudra tenir compte en cas de ponction ou d’embolisation thérapeutique. L’aspergillome est souvent unique. Il peut être multifocal, bilatéral et siège le plus souvent aux lobes supérieurs lié aux localisations préférentiellement apicales des atteintes tuberculeuses. L’aspergillose pulmonaire chronique nécrosante ou subaigüe invasive représente un processus chronique, destructeur du poumon avec formation de nouvelles cavités par une nécrose parenchymateuse ou extension d’une cavité préexistante.
L’aspect radiologique est celui d’une opacité «en foyer », plutôt unique, le plus souvent non ou mal systématisée, plutôt rétractile et touchant volontiers les lobes supérieurs ou les segments apicaux des lobes inférieurs [8]. L’aspergillose pulmonaire chronique cavitaire (APCC) se caractérise par la formation et l’expansion de cavités multiples, certaines contenant des truffes aspergillaires. Dans une phase d’évolution ultérieure, un certain degré de fibrose peut être visible au scanner thoracique et on parlera à ce moment d’APC fibrosante. Les anomalies radiologiques sont la conséquence de l’APCC et de la maladie pulmonaire sous-jacente ou associée. Elles incluent condensations, cavités, épaississement pleural, uni ou bilatéraux à prédominance lobaire supérieure. Les cavités peuvent être à paroi fine ou épaisse et contenir des aspergillomes ou du matériel intra-cavitaire [9]. L’aspergillose pulmonaire invasive (API) est une infection grave essentiellement opportuniste. Elle peut être angio-invasive ou invasive des voies aériennes. Dans l’API du neutropénique, la TDM est devenue un élément du diagnostic précoce avec la mise en évidence d’un halo de densité atténuée périlésionnel dans les cinq premiers jours [10]. A partir du 14ème jour, il permettra de retrouver les signes de nécrose de la lésion, excavation, ou souvent un aspect en croissant gazeux [11]. Elle permet également de préciser le nombre de lésions, leur topographie, de guider les gestes à visée diagnostique et est indispensable pour la discussion du traitement chirurgical [12,13].
Le diagnostic est difficile à établir et repose sur un faisceau d’arguments épidémiologiques, cliniques, biologiques et d’imagerie. Deux signes scannographiques ont été identifiés en tant qu’indicateurs de l’API: le signe du halo qui correspond à une hyperdensité en verre dépoli entourant un nodule ou une masse. Il est aspécifique [14] et se retrouve également dans de nombreuses pathologies [15] dont la tuberculose [16] ; le signe du croissant gazeux. Sur le plan immunologique, la sérologie aspergillaire peut être positive en cas d’aspergillome ou d’aspergillose broncho-pulmonaire allergique. Concernant l’aspergillose invasive sur terrain immunodéprimé, elle est en revanche souvent négative du fait de l’incapacité des sujets à synthétiser des anticorps. Le sérodiagnostic peut alors secondairement se positiver sous traitement. Dans notre série les résultats obtenus étaient conformes à ceux de la littérature [2,4]
Dans le cas de l’aspergillome, le traitement médical est peu ou pas efficace. Le traitement de référence reste la chirurgie. Tous nos patients porteurs d’aspergillome ont bénéficié d’une chirurgie d’exérèse. Dans le cas où un geste chirurgical n’est pas possible, plusieurs alternatives palliatives ont été proposées. L’embolisation de l’artère bronchique a été aussi proposée à visée hémostatique en cas d’hémoptysie, permettant d’arrêter le saignement et de préparer le patient pour un geste ultérieur [17]. La chirurgie d’exérèse peut assurer la guérison, mais elle n’est pas toujours possible [18]. L’injection percutanée d’amphotéricine B provoque une sclérose au sein de la cavité permettant d’arrêter le saignement et de stabiliser la lésion. La radiothérapie externe a été aussi rapportée comme dernier recours pour les malades présentant des hémoptysies menaçantes ou présentant des localisations multiples avec de bons résultats. Le traitement de l’aspergillose chronique nécrosante est basé sur les antifongiques systémiques, la chirurgie et l’administration d’Amphotéricine B intra cavitaire percutanée [3]. La première ligne de traitement en cas d’API consiste en une monothérapie aspergillaire. L’embolisation ou la chirurgie peuvent être proposées dans les lésions proches d’une structure vasculaire.
L’évolution de l’aspergillome est lente. Des calcifications sont possibles, habituellement punctiformes. L’apparition d’un niveau liquide est rare, généralement le témoin d’une surinfection à germes pyogènes.
La disparition spontanée est rare, mais possible. Le pronostic de l’aspergillome est celui de la maladie sous-jacente, de l’augmentation en taille ou du nombre des lésions, des facteurs généraux.
La complication la plus fréquente et la plus grave reste l’hémorragie, responsable des trois décès dans notre série. Le taux de mortalité en cas d’API est élevé et dépend de la maladie sous-jacente.
CONCLUSION
Bien connaître les différentes pathologies respiratoires aspergillaires est important afin de les évoquer précocement et d’en améliorer la prise en charge. L’imagerie, notamment la tomodensitométrie joue un rôle important en mettant en évidence des signes évocateurs d’aspergillose facilitant l’obtention d’un diagnostic plus précoce.
La TDM permet également de faire un bilan précis des lésions thoraciques, de guider les actes à visée diagnostique: fibroscopie, ponction-aspiration transpariétale ; thérapeutique: chirurgie; et dans le suivi évolutif. Enfin elle assure le contrôle post-thérapeutique dans l’optique de détecter d’éventuelles complications ou récidives.
CONFLITS D’INTÉRÊTS
Aucun
REFERENCE
1. Gianella P, Gasche-Soccal P et Van Delden. Aspergillose pulmonaire invasive et aspergillose pulmonaire chronique. Rev Med Suisse 2014; 10:2202-7.
2. Zait H et Hamrioui B. Aspergillome pulmonaire: à propos de 39 cas. J Mycol Med 2011 ; 21 : 138-141.
3. Saraceno JL, Phelps DT and Ferro TJ. Chronic necrotizing pulmonary aspergillosis. Approach to management. Chest 1997;112:541-8.
4. Mimouni I, Lezar S et Essodegui F. L’aspergillome intracavitaire pulmonaire: à propos de 24 cas. J Radiol 2009; 90:1591.
5. Rakotomizao J, Rajaoarifetra J et Rakotoson J. Profil épidémio-clinique de l’aspergillome dans l’unité de pneumologie du CHU d’Antananarivo. Rev Mal Respir 2006; (23 No HS1):51.
6. Sansom HE, Baque-Juston M and Wells AU. Lateral cavity wall thickening as an early radiographic sign of mycetoma formation. Eur Radiol 2000;10:387-390.
7. Koren L, Alonso S and Sanchez-Nistal MA. Pulmonary aspergillosis; a spectrum of CT findings. ECR 2012; 10: 1-22.
8. Costello P and Rose RM. CT findings in pleural aspergillosis. J Comput Assist Tomogr 1985; 9:760
9. Denning DW, Riniotis K, Dobrashian R and Sambatakou H. Chronic cavitary and fibrosing pulmonary and pleural aspergillosis: case series, proposed nomenclatured changed, and review. Clin Infect Dis 2003; 37 Suppl 3:265-280
10. Latge JP. The pathobiology of Aspergillus fumigatus. Trends Microbiol 2001;9:382-9.
11. Germaud P and Haloun A. Invasive nosocomialpulmonary aspergillosis. Rev Pneumol Clin 2001;57:157-163.
12. Henwick S, Hetherington SV and Patrick CC. Complement binding to Aspergillus conidia correlates with pathogenicity. J Lab Clin Med 1993;122:27-35.
13. Bouchara JP, Tronchin G and Chabasse D. Mechanisms and implications of the adhesion phenomenon in Aspergillus fumigatus. Pathol Biol (Paris) 1994; 42:640-646.
14. Buckingham SJ and Hansell DM. Aspergillus in the lung: diverse and coincident forms. Eur Radiol 2003;13:1786-1800.
15. Gaeta M, Blandino A and Scribano E. Computed tomography halo sign in pulmonary nodules: frequency and diagnostic value. J Thorac Imaging 1999; 14:109-113.
16. Primack SL, Hartman TE, Lee KS and Muller NL. Pulmonary nodules and the CT halo sign. Radiology 1994; 190:513-515.
17. Gaeta M, Volta S and Stroscio S. CT « halo sign » in pulmonary tuberculoma. J Comput Assist Tomogr 1992; 16827-828.
18. Marghlia A, Zairi S et Osmena M. Place de la chirurgie conservatrice dans l’aspergillome pulmonaire. Rev Mal Respir 2012; 29: 384-390.
FIGURES - TABLE
REFERENCE
1. Gianella P, Gasche-Soccal P et Van Delden. Aspergillose pulmonaire invasive et aspergillose pulmonaire chronique. Rev Med Suisse 2014; 10:2202-7.
2. Zait H et Hamrioui B. Aspergillome pulmonaire: à propos de 39 cas. J Mycol Med 2011 ; 21 : 138-141.
3. Saraceno JL, Phelps DT and Ferro TJ. Chronic necrotizing pulmonary aspergillosis. Approach to management. Chest 1997;112:541-8.
4. Mimouni I, Lezar S et Essodegui F. L’aspergillome intracavitaire pulmonaire: à propos de 24 cas. J Radiol 2009; 90:1591.
5. Rakotomizao J, Rajaoarifetra J et Rakotoson J. Profil épidémio-clinique de l’aspergillome dans l’unité de pneumologie du CHU d’Antananarivo. Rev Mal Respir 2006; (23 No HS1):51.
6. Sansom HE, Baque-Juston M and Wells AU. Lateral cavity wall thickening as an early radiographic sign of mycetoma formation. Eur Radiol 2000;10:387-390.
7. Koren L, Alonso S and Sanchez-Nistal MA. Pulmonary aspergillosis; a spectrum of CT findings. ECR 2012; 10: 1-22.
8. Costello P and Rose RM. CT findings in pleural aspergillosis. J Comput Assist Tomogr 1985; 9:760
9. Denning DW, Riniotis K, Dobrashian R and Sambatakou H. Chronic cavitary and fibrosing pulmonary and pleural aspergillosis: case series, proposed nomenclatured changed, and review. Clin Infect Dis 2003; 37 Suppl 3:265-280
10. Latge JP. The pathobiology of Aspergillus fumigatus. Trends Microbiol 2001;9:382-9.
11. Germaud P and Haloun A. Invasive nosocomialpulmonary aspergillosis. Rev Pneumol Clin 2001;57:157-163.
12. Henwick S, Hetherington SV and Patrick CC. Complement binding to Aspergillus conidia correlates with pathogenicity. J Lab Clin Med 1993;122:27-35.
13. Bouchara JP, Tronchin G and Chabasse D. Mechanisms and implications of the adhesion phenomenon in Aspergillus fumigatus. Pathol Biol (Paris) 1994; 42:640-646.
14. Buckingham SJ and Hansell DM. Aspergillus in the lung: diverse and coincident forms. Eur Radiol 2003;13:1786-1800.
15. Gaeta M, Blandino A and Scribano E. Computed tomography halo sign in pulmonary nodules: frequency and diagnostic value. J Thorac Imaging 1999; 14:109-113.
16. Primack SL, Hartman TE, Lee KS and Muller NL. Pulmonary nodules and the CT halo sign. Radiology 1994; 190:513-515.
17. Gaeta M, Volta S and Stroscio S. CT « halo sign » in pulmonary tuberculoma. J Comput Assist Tomogr 1992; 16827-828.
18. Marghlia A, Zairi S et Osmena M. Place de la chirurgie conservatrice dans l’aspergillome pulmonaire. Rev Mal Respir 2012; 29: 384-390.
ARTICLE INFO
DOI: 10.12699/jfvpulm.12.37.2021.43
Conflict of Interest
Non
Date of manuscript receiving
15/6/2020
Date of publication after correction
15/7/2021
Article citation
Agai JB K., Efalou P., Haloua M., Alaoui Lamrani Y., Boubbou M., Maaroufi M., Alami B. Pulmonary aspergillosis in all its forms: About 18 cases at the teaching hospital Hassan II of Fez. J Func Vent Pulm 2021;37(12):43-48