
 English
English
 French
French
Adverse effects of treatment for multidrug-resistant tuberculosis
Les effets indésirables du traitement de la tuberculose multi-résistante
FZ. Yousfi, N. Boutahiri, I. Ouredja, N. Rguig, S. Nader, M. Aharmim, JE. Bourkadi
Hôpital Moulay Youssef Ibn Sina Rabat. Maroc
Corresponding author
Dr. FZ. Yousfi
Hôpital Moulay Youssef Ibn Sina Rabat. Maroc
E-mail: yousfifatimazahra112@gmail.com
DOI: 10.12699/jfvpulm.12.37.2021.49
ABSTRACT
Introduction. Multi-drug resistant tuberculosis is a worldwide public health problem, its treatment is based on second-line anti-tuberculosis drugs. These anti-tuberculosis drugs are not devoid of side effects and may be responsible for minor side effects that are reversible after symptomatic treatment, but sometimes severe, requiring the drug to be permanently discontinued or the treatment protocol changed.
Methods. We conducted a retrospective study spanning a 2-year period from 01/01/2018 to 12/30/2019, which involved 109 patients hospitalized at Moulay Youssef Hospital.
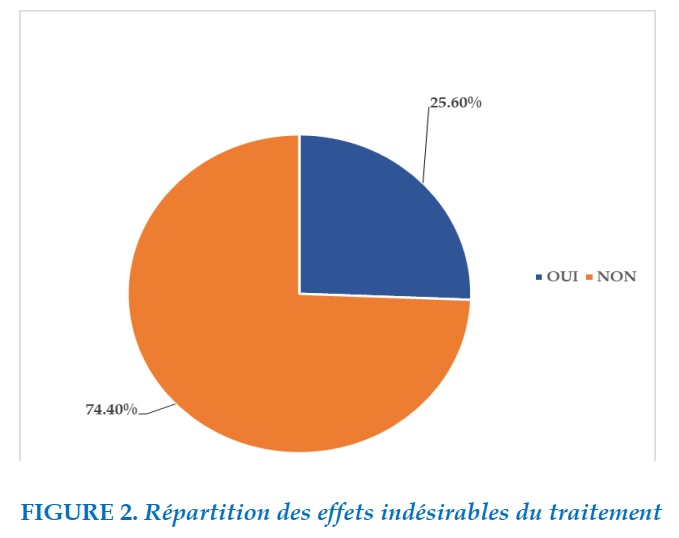
Results. Among 109 patients, 28 patients (25.6%) developed side effects, the average age was 34 years, we counted 17 men and 11 women The digestive effects were the most frequent occurring in 13 cases of our patients (11.9%) of which 10 were minor effects such as nausea, vomiting, and epigastralgia and 3 major effects (pancreatitis, hepatic cytolysis) requiring the definitive discontinuation of the incriminated molecule and a change in the therapeutic protocol. The molecules incriminated (according to the result of the reintroduction test) were Prothionamide and Pyrazinamide. Psychiatric disorders such as depression (3 cases), psychosis (1 case), insomnia (2 cases) were observed in second position in 6 cases, including major depression in culminates in a suicide attempt. Neurological effects were demonstrated in 5 cases of peripheral sensory motor neuropathy of toxic origin confirmed by neurological examination and electromyogram. The molecules implicated in the neuropsychiatric effects were Cyclocerine and Isoniazid. Regarding the ophthalmologic effects were present in 2.75% (3 cases) of which 2 patients were diabetic, a decrease in visual acuity was observed in one patient and retrobulbar optic neuropathy (NORB) in the other two. In view of the functional prognosis, linezolid was stopped in 3 cases and Ethambutol in 2 patients. Hearing effects were also noted in 2.75%, 3 cases, 2 patients presented irreversible bilateral deafness with placement of hearing aids and hearing loss in the last case, amikacin was stopped in all patients. The haematological effects were found in a deep anemia type in one patient and hyper eosinophilia in another case, Linezolid was implicated.
Conclusion. The treatment of multidrug-resistant tuberculosis requires rigorous monitoring throughout the duration of treatment, it is necessary to underline the importance of respecting the dosage of drugs, knowledge of their adverse effects, and insisting on education and participation of the patient to make him an actor in his treatment.
KEYWORDS: Multidrug-resistant tuberculosis; Second-line antituberculosis; Undesirable effects
RÉSUMÉ
Introduction. La tuberculose multi-résistante est un problème de santé publique à l’échelle mondiale, son traitement repose sur les antituberculeux de seconde ligne. Ces antituberculeux ne sont pas dénués d’effets secondaires et peuvent être responsables d’effets indésirables mineurs réversibles après traitement symptomatique mais parfois sévères nécessitant l’arrêt définitif de la molécule ou changement de protocole thérapeutique.
Méthodes. Nous avons mené une étude rétrospective étalée sur une période de 2 ans allant du 01/01/2018 au 30 /12/2019 qui porte sur 109 patients hospitalisés à l’hôpital Moulay Youssef.
Résultats. Parmi 109 patients, 28 patients (25,6%) ont développés des effets indésirables, la moyenne d’âge était de 34 ans, nous avons dénombré 17 hommes et 11 femmes.Les effets digestifs étaient les plus fréquents survenant chez 13 cas de nos patients (11,9%) dont 10 étaient des effets mineurs à type de nausées, vomissements, et des épigastralgies et 3 effets majeurs (pancréatite, cytolyse hépatique) ayant imposés l’arrêt définitif de la molécule incriminé et changement de protocole thérapeutique. Les molécules incriminées (selon le résultat du test de réintroduction) étaient le Prothionamide et le Pyrazinamide. Les troubles psychiatriques à type de dépression (3cas), psychose (1 cas), insomnie (2 cas) étaient constatés en deuxième position chez 6 cas, dont une dépression majeure à aboutit à une tentative de suicide. Les effets neurologiques étaient objectivés chez 5 cas à type de neuropathie périphérique sensitivomotrice d’origine toxique confirmé par l’examen neurologique et l’électromyogramme. Les molécules incriminées dans les effets neuropsychiatriques étaient la Cyclocérine et l’Isoniazide. En ce qui concerne les effets ophtalmologiques étaient présents dans 2 ,75 % (3 cas) dont 2 patients étaient diabétique, une baisse de l’acuité visuelle était constatée chez un patient et une neuropathie optique rétrobulbaire (NORB) chez les deux autres. Vu le pronostic fonctionnel le linezolide était arrêté chez 3 cas et Ethambutol chez 2 patients. Les effets auditifs étaient notés également dans 2,75 %, 3 cas, 2 patients présentaient une surdité bilatérale irréversible avec mise en place de prothèse auditive et une hypoacousie chez le dernier cas l’amikacine était arrêtée chez tous les patients. Les effets hématologiques étaient retrouvés à type d’anémie profonde chez un patient et une hyper éosinophilie chez un autre cas, le Linezolide était incriminé.
Conclusion. Le traitement de la tuberculose multi-résistante impose une surveillance rigoureuse tout au long de la durée du traitement, il faut souligner l’intérêt du respect des posologies des médicaments, la connaissance de leurs effets indésirables, et insister sur l’éducation et la participation du patient pour le rendre acteur de son traitement.
MOTS CLÉS: Tuberculose multi résistante; Antituberculeux de deuxième ligne; Effets indésirable
INTRODUCTION
La tuberculose multi-résistante est un problème de santé publique à l’échelle mondiale, son traitement repose sur les antituberculeux de seconde ligne.
Ces antituberculeux ne sont pas dénués d’effets secondaires et peuvent être responsables d’effets indésirables mineurs réversibles après traitement symptomatique mais parfois sévères nécessitant l’arrêt définitif de la molécule ou changement de protocole thérapeutique
METHODES
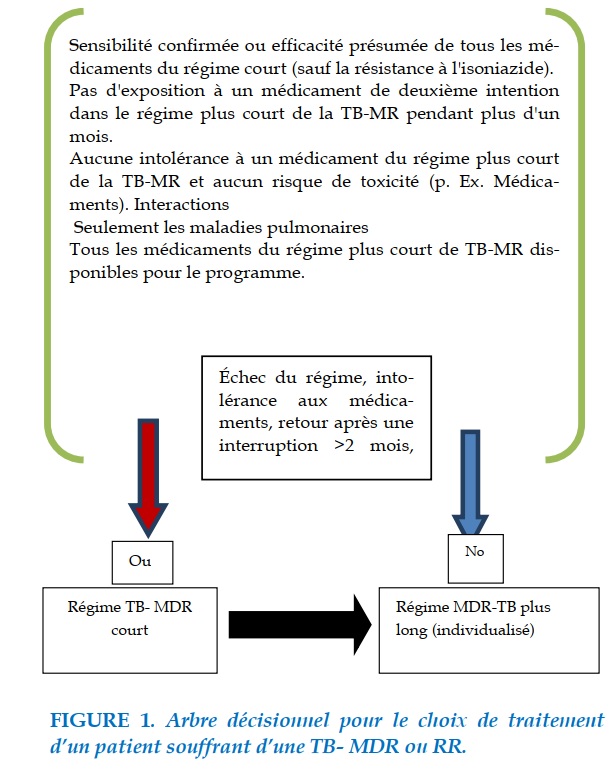
Nous avons mené une étude rétrospective étalée sur une période de 2 ans allant du 01/01/2018 au 30 /12/2019 qui porte sur 109 patients hospitalisés à l’hôpital Moulay Youssef pour tuberculose multi-résistante qui étaient mis sous traitement antituberculeux court et long de deuxième ligne afin de décrire les différents effets indésirables et les facteurs de risque de leurs survenu (Figures 1).
RESULTATS
Parmi 109 patients, 28 patients (25,6%) ont développés des effets indésirables (Figures 2), la moyenne d’âge était de 34 ans, nous avons dénombré 17 hommes et 11 femmes.
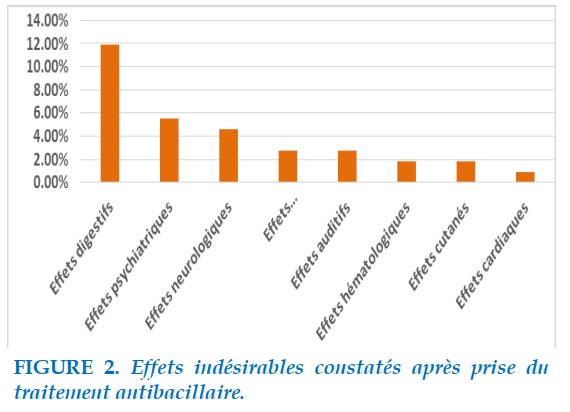
Les effets digestifs étaient les plus fréquents survenant chez 13 cas de nos patients (11,9%) dont 10 étaient des effets mineurs à type de nausées, vomissements, et des épigastralgies et 3 effets majeurs (pancréatite, cytolyse hépatique) ayant imposés l’arrêt définitif de la molécule incriminé et changement de protocole thérapeutique.
Les molécules incriminées (selon le résultat du test de réintroduction) étaient le Prothionamide et le Pyrazinamide.
Les troubles psychiatriques à type de dépression (3cas), psychose (1 cas), insomnie (2 cas) étaient constatés en deuxième position chez 6 cas, dont une dépression majeure à aboutit à une tentative de suicide. Les effets neurologiques étaient objectivés chez 5 cas à type de neuropathie périphérique sensitivomotrice d’origine toxique confirmé par l’examen neurologique et l’électromyogramme.
Les molécules incriminées dans les effets neuropsychiatriques étaient la Cyclocérine et l’Isoniazide.
En ce qui concerne les effets ophtalmologiques étaient présents dans 2 ,75 % (3 cas) dont 2 patients étaient diabétique, une baisse de l’acuité visuelle était constatée chez un patient et une neuropathie optique rétrobulbaire (NORB) chez les deux autres.
Vu le pronostic fonctionnel le linezolide était arrêté chez 3 cas et Ethambutol chez 2 patients.
Les effets auditifs étaient notés également dans 2,75 %, 3 cas, 2 patients présentaient une surdité bilatérale irréversible avec mise en place de prothèse auditive et une hypoacousie chez le dernier cas l’amikacine était arrêtée chez tous les patients.
Les effets hématologiques étaient retrouvés à type d’anémie profonde chez un patient et une hyper éosinophilie chez un autre cas, le Linezolide était incriminé.
Les effets cutanés étaient rapportés chez 2 cas avec prurit, éruptions prurigineuse généralisé, ayant régressé après traitement antihistaminique.
La Figure 3 montre des différents effets indésirables observés chez les patients de notre série.
DISCUSSION
En 1997, l’Organisation mondiale de la santé (OMS) a émis des recommandations concernant la prise en charge des tuberculoses multi résistantes.
Elle encourage la mise en place d’une ou de quelques, selon la taille et l’organisation du pays des équipes pluridisciplinaires expérimentées dans la prise en charge des tuberculoses multi résistantes et pouvant y consacrer du temps.
L’équipe doit maitriser les outils du diagnostic et de l’antibiogramme des souches multi résistantes, la prescription des antituberculeux de seconde ligne, et savoir peser une éventuelles indication chirurgicale. La décision de commencer un traitement antibiotique chez un patient atteinte tuberculose multi-résistante est lourde de conséquence puisque comme il est souligné dans le document de l’OMS, la prise méticuleuse du schéma thérapeutique de réserve constitue la dernière possibilité du patient d’échapper à la mort [1].
Tout comme le traitement en première intention de la tuberculose, le traitement de la tuberculose multi-résistante vise à:
• Guérir le patient et restaurer une bonne qualité de vie et sa productivité.
• Prévenir la mort.
• Réduire la transmission de la tuberculose aux autres
Et surtout parvenir à l’ensemble de ces résultats en générant le moins possible de toxicité [2].
L’élaboration du régime thérapeutique repose sur quatre éléments: la connaissance des antécédents du patient en particulier des médicaments qu’il a déjà reçus, le profil de sensibilité de la souche bactérienne, la connaissance des principes élémentaires de la chimiothérapie antituberculeuse ainsi que des caractéristiques des antituberculeux disponibles pour traitement le respect des posologies des médicaments, la connaissance de leurs effets indésirables.
L'état sérologique du patient doit être établi, et traitement antirétroviral initié chez tous les patients infectés par le VIH [3].
En fonction des antécédents du patient, un traitement standard peut être prescrit ou un traitement individualisé.
Dans notre étude 13 cas étaient mis sous schéma court et 15 étaient mis sous schéma prolongé (traitement individualisé).
Critères d'exclusion : Résistance aux médicaments de 2e ligne, les maladies extra pulmonaires et la grossesse [4].
L’OMS recommande un traitement court de 9 – 12 mois dit le « régime Bangladesh » qui consiste en phase intensive avec la gatifloxacine ou Moxifloxacine M, Kanamycine Km, prothionamide Pto, Clofazimine C, l’isoniazide H à forte dose (max. 600 mg par jour), l’éthambutol E et le pyrazinamide Z pendant 4-6 mois, suivi d'une phase continue de maintenance de 5 mois avec la gatifloxacine/Moxifloxacine M, Clofazimine C, éthambutol E et pyrazinamide Z : 4 – 6 Km Cfz Mfx Pto EHZ/5Mfx Cfz EZ [5, 6].
En fonction de l’antibiogramme de la souche infectante, des antécédents de traitement antituberculeux et des antécédents de contacts du patient, un régime individualisé peut être prescrit en respectant les étapes de la constitution d’un schéma thérapeutique suivantes :
Ajouter une nouvelle génération de fluoro-quinolone groupe A.
Levofloxacine (Lfx) Moxifloxacine (Mfx) Gatifloxacine (Gfx)
Ajouter un agent injectable de deuxième ligne groupe B.
Amikacine (Am) Capreomycine (Cm) Kanamycin (Km) Streptomycine (S)
Ajouter deux agents de deuxième ligne ou plus groupe C.
Ethionamide/ prothionamide (Eto/Pto) Cyclosérine /Térizidone (Cs/Trd) Linézolide (Lzd) Clofazimine (Cfz).
Ajouter le pyrazinamide et tout autre agent de première ligne. (S’ils peuvent aider à renforcer le régime) Groupe D1.
Pyrazinamide (Z) Éthambutol (E) Isoniazide à dose élevée (H).
Ajouter un agent du groupe D
Bédaquiline (Bdq) Délamanide (Dlm)
Ajouter l'un ou l'autre de ces agents (si le régime ne peut pas être composé autrement) Acide para-amino-salicylique (PAS) Imipenème-Cilastatine (Ipm-Cln) Meropeneme (Mpm) Amoxicilline-clavulanate (Amx-Clv) (Thioacétazone).
Le statut VIH doit être testé et confirmé comme étant négatif avant le début de la thioacétazone [7].
Les durées de traitement sont fonction du régime choisi, pour le régime court, la phase intensive est de durée: 4-6 mois contre 8 mois pour le régime long alors que la phase de poursuite est de 5 mois pour le régime court et 12 mois ou plus pour le régime long [7].
Les effets indésirables sont très fréquents lors de l’utilisation de ces antituberculeux de seconde ligne.
Les plus fréquemment citées dans les études sont des troubles digestifs, une toxicité cochléo-vestibulaire, des manifestations cutanées, une neuropathie périphérique ou des manifestations psychiatriques diverses.
Ces effets indésirables entrainent l’interruption du médicament incriminé dans 12 à 39 % des cas [8,9].
Parmi les effets indésirables spécifiques de chaque molécule de deuxième ligne utilisée dans le traitement de la tuberculose multi résistante décrit dans la littérature on trouve:
Pour les anciens antituberculeux
Les médicaments antituberculeux d’ancienne génération sont encore utilisés dans les pays émergents; ce sont des médicaments de seconde ligne face à des bacilles résistants (MDR) et multi-résistants (XDR). Ils ont des effets indésirables, parfois redoutables.
Aminosides et polypeptides [10-13]
La Kanamycine, l’amikacine, (la viomycine n’est plus disponible)
Ces médicaments ont des toxicités cochléo-vestibulaires et rénales supérieures à celles de la SM.
La Capréomycine à une toxicité hépatique.
Thioamides [10-13]
L’éthionamide et prothionamide sont deux molécules
qui provoquent des troubles gastro-intestinaux quasi constants.
Ils possèdent une toxicité hépatique et peut occasionner des syndromes pellagroïdes prévenus par l’administration associée de vitamines PP (vitamine B3).
Les effets digestifs étaient les plus fréquents survenant chez 13 cas de nos patients (11,9%) dont 10 étaient des effets mineurs à type de nausées, vomissements, sans perturbation du bilan biologique et des épigastralgies et 3 effets majeurs (Pancréatite, cytolyse hépatique).
Les molécules incriminées (selon le résultat du test de réintroduction) étaient le Prothionamide et le Pyrazinamide.
Cyclosérine [10-13]
Les effets toxiques s’exercent principalement sur le système nerveux central à l’origine de convulsions ou de manifestations psychiatriques et neurologique notamment céphalées, irritabilité, troubles du sommeil, agressivité et tremblements, gingivite, pâleur, dépression, confusion, vertiges, agitation, anxiété, cauchemars, céphalées sévères, somnolence diurne.
Occasionnels: modifications de la vue, éruption cutanée, engourdissement, fourmillement ou sensation de brûlure au niveau des doigts et des pieds, ictère, douleurs oculaires.
Rares : convulsions, psychose aiguë avec risque de suicide.
Dans notre étude un patient était mis sous cyloocerine était victime d’une une dépression majeure ayant abouti à une tentative de suicide.
Les effets secondaires de la TZ ( thioacétazone) sont similaires à ceux de la Cyclocerine, mais dix fois moins fréquents, excepté la tendance suicidaire.
Acide para-amino-salicylique (PAS) [10-13].
Il provoque de fréquentes manifestations gastro-intestinales (30 % des cas) avec dyspepsies, vomissements, diarrhées, ainsi que des réactions d’hypersensibilité (10 % des cas) cutanée et des accidents hémolytiques rares liés à des composés phénoliques toxiques, enfin des troubles endocriniens, en particulier hypothyroïdie
Nouveaux antituberculeux
Dans le contexte de double pandémie tuberculeuse et d’infection par le VIH, le clinicien doit disposer de molécules actives sur les bacilles tuberculeux multi résistants avec une action rapide, une demie vie longue, permettant des administrations intermittentes comme capables de stériliser les sites où persistent des bactéries dormantes [14,15].
Des antituberculeux de nouvelle génération sont d’ores et déjà disponibles, quels sont leurs effets indésirables.
Nouvelles fluoroquinolones antituberculeuses
Moxifloxacine (MXF), gatifloxacine (GTX)
Cette classe thérapeutique présente un triple intérêt: une action inhibitrice stable de l’ADN gyrase, des paramètres pharmacocinétiques et dynamiques favorables, enfin une bonne tolérance sur le long terme [14].
La moxifloxacine (MXF) et la gatifloxacine (GTX) n’ont pas montré de toxicité cardiaque (rythmie, torsade de pointes) ou de photo toxicité lors des études cliniques [14], il convient cependant d’utiliser avec prudence les fluoroquinolones chez des patients qui présentent un risque d’allongement du segment QT [16].
La moxifloxacine (MXF) occasionne parfois des nausées et diarrhées ; elle reste bien tolérée sur le long court [17].
Peut induire des troubles de la glycémie (0,65 %) [18] sur des terrains à risques (diabète non insulinodépendant pour l’hypoglycémie ; corticothérapie et âge avancé pour l’hyperglycémie) [18]. Il n’existe actuellement pas de données sur la tolérance au long court de la GTX.
Ces médicaments exposent aux autres effets indésirables habituels des fluoroquinolones : ruptures tendineuses.
Oxazolidinones: linézolide (LZD)
Les propriétés antibactériennes de cette classe sont réelles mais l’efficacité de leur chef de file, le LZD pour stériliser les tuberculoses résistantes (MDR et XDR) est limitée par ses fréquents effets secondaires (75 % des cas) qui peuvent conduire à son interruption [14].
Ils apparaissent à partir du premier mois sous forme de neuropathies périphériques ou optiques (45,8 %) partiellement réversibles et de cytopénie d’origine centrale avec anémie profonde (40 à 50 %) réversible totalement à l’arrêt du traitement.
Une acidose lactique et des troubles gastro-intestinaux ont été rapportés [19,20]. De récentes publications soulignent l’importance de cette molécule qui ne connaît pratiquement pas d’interaction médicamenteuse chez les patients XDR pourvu qu’un monitorage régulier clinique et biologique soit réalisé facilitant son observance et sa tolérance générale
Nouvelles Rifamycines: rifabutine (RFB), rifapentine (RFP).
Le profil de tolérance de la RFP et de la RFB sont analogues celui de la RMP [21,22].
La RFB expose au risque d’uvéites doses dépendantes mais aussi d’arthralgies, de décoloration cutanée et leucopénie [22,23]; elle peut remplacer la RMP dans une quadrithérapie antituberculeuse chez un patient infecté par le VIH en raison de sa moindre interférence avec l’anti protéases [24,25].
Le traitement de la tuberculose multi résistante nécessite également l’utilisation de certains antituberculeux majeures notamment le pyrazinamide (PZA), Isoniazide, et etambutol (ETB) et dont les effets indésirables sont fréquents et bien connus:
Pyrazinamide
Cet antituberculeux d’action intracellulaire, qui avait été abandonné dans les années 1950 en raison des effets secondaires importants induits par son utilisation à forte dose, été réintroduit dans les années 1980. Il s’avère beaucoup mieux toléré à une posologie inférieure à 30 mg/kg par jour.
Effets indésirables hépatiques: l’hépatite cytolytique est l’effet secondaire le plus sérieux; elle est dose dépendante mais la seule responsabilité du PZA est difficile à affirmer compte tenu de l’habituelle association du médicament à l’INH et à la RMP.
La fréquence de l’hépatite est évaluée à 0,5 à 10 % pour une durée de traitement de deux mois et selon les associations médicamenteuses [26].
Des cas d’hépatites fulminantes mortelles ont été rapportés en cas de traitement d’infections tuberculeuses latentes par association RMP- PZA [27]. Un cas d’hépatite granulomateuse faisant suite à l’administration du PZA a été décrit [28].
Effets digestifs apparaissent dans moins de 10 % des cas à type de nausées, vomissements, diarrhées, douleurs abdominales [29,30].
Autres effets indésirables.
Effets indésirables articulaires
Des arthralgies sont signalées dans 1 à 7 % des cas pour des doses inférieures à 2 g par jour [31]. Elles paraissent être en rapport avec l’hyper uricémie induite par la résorption dans le tube contourné distal du rein de l’acide urique et à son absence de sécrétion conduisant à une augmentation de sa concentration sérique [26].
Effets cutané
Des rashs urticariens diffus et parfois un choc anaphylactique peuvent apparaître dans l’heure qui suit la prise de PZA ce qui évoque un mécanisme d’hypersensibilité immédiate et conduit aux mêmes investigations allergologues que celles déjà décrites pour la RMP [32].
Des réactions de photo toxicité, érythèmes polymorphes, acné, voire pellagre, sont connues qui régressent à l’arrêt du traitement [30].
Effets digestifs apparaissent dans moins de 10 % des cas à type de nausées, vomissements, diarrhées, douleurs abdominales [29,30].
Effets indésirables rares
Des fièvres isolées et des bouffées vasomotrices sont possibles [29,30]. Des thrombopénies sévères ont été décrites, nécessitant l’arrêt du médicament [33].
Isoniazide
L’INH a des effets toxiques, principalement hépatiques et neurologiques. Cette fréquence est évaluée à 5 % [11]. Son hépato toxicité est potentiellement mortelle, elle est majorée par l’association à la RMP [10].
Des neuropathies périphériques doses dépendantes touchent 0,2 % des patients [10].
Elles se localisent essentiellement sur les membres inférieurs dans un tableau de polynévrite. Elles sont partiellement liées à un déficit en vitamine B6,un apport de pyridoxine permet de réduire leur risque de survenue.
Éthambutol
Cet antituberculeux bactériostatique est globalement bien toléré. Il induit un risque de toxicité sur le nerf optique qui justifie un suivi attentif.
Effets indésirables oculaires
La névrite optique rétrobulbaire (NORB)
Elle peut apparaître dans un délai variant entre 40 et 360 jours après le début du traitement et 20 à 30 jours après son arrêt, mais en moyenne cet événement survient dans les deux mois qui suivent le début de la prise médicamenteuse [26].
Dans notre étude la névrite optique rétrobulbaire étaient constatées chez 2 patients qui étaient mis sous éthambutol.
L’atteinte est dose dépendante avec une incidence de18 % chez des patients recevant 30 mg/kg par jour et de 2 %pour 25 mg/kg par jour [29].
Le risque est très faible mais possible pour des posologies inférieures à 15 mg/kg par jour.
Le tableau clinique se constitue de la façon suivante : dyschromatopsie (rouge-vert), puis baisse de l’acuité visuelle, scotome central, altération du potentiel évoqué visuel, enfin atrophie optique.
Parfois, l’atteinte initiale résume à un rétrécissement du champ visuel périphérique ou à une hémianopsie bitemporale [34].
Le trouble est réversible en trois à douze mois si l’arrêt du médicament intervient sur un nerf optique fonctionnel [34,36].
La surveillance ophtalmologique est indispensable en cas d’utilisation de l’EMB. Elle comprend un examen ophtalmologique de référence avant l’instauration du traitement (acuité visuelle, champ visuel, vision des couleurs, fond d’œil), renouvelé à un ou deux mois et ultérieurement en cas d’anomalie clinique: acuité visuelle, vision des couleurs (test d’Ichihara) [34,35].
Le mécanisme de la névrite optique rétrobulbaire est imparfaitement élucidé: il implique l’effet toxique direct de l’EMB sur les cellules ganglionnaires et/ou bipolaires [36]; une prédisposition génétique est envisagée [37]. Par ailleurs, le fréquent surdosage en EMB est souligné chez les sujets obèses [38], et l’association EMB—INH accroît la toxicité sur le nerf optique [39].
Autres effets indésirables
Des neuropathies sensitivomotrices et des troubles neuropsychiques avec vertiges et céphalées sont possibles comme une élévation transitoire de la bilirubinémie et des cas de néphropathies tubulo-interstitielles de mécanisme toxique [26]. Des réactions allergiques cutanées prurigineuses ou pur-puriques sont rares [30].
L’association de rashs cutanés à une hyper-éosinophilie et à des infiltrats pulmonaires a été décrite. L’hyper-uricémie induite par l’EMB est exceptionnelle [42].
CONCLUSION
La tuberculose multi-résistante est une forme grave de tuberculose par la complexité de son traitement et aussi par son caractère invalidant pour le patient.
Les médicaments antituberculeux de seconde ligne sont responsables d’effets indésirables fréquents généralement mineurs et parfois sévères.
Le respect de la posologie des médicaments, la connaissance de leurs effets secondaires, la mise en œuvre des mesures destinées à l’éducation du patient pour le rendre acteur de son traitement, comme de sa guérison, concourent ensemble à la prévention des événements indésirables.
CONFLIT D’INTERETS
Non.
REFERENCES
1. Crofton J, Chaulet P, Maher D. Guidelines for the management of drug resistant tuberculosis. World Health Organization ed. Proceedings of the World Health Organization, ed. WHO. 1997, Geneva: WHO. 1-40.
2. Organization WH. Treatment of tuberculosis: Guidelines. 4 ed2010.
3. Dheda K, Gumbo T, Maartens G, Dooley KE, McNerney R, Murray M, et al. The epidemiology, pathogenesis, transmission, diagnosis, and management of multidrug resistant, extensively drug-resistant, and incurable tuberculosis. The Lancet Respiratory Medicine. 2017; 5(4):291-360.
4. Falzon D, Schünemann HJ, Harausz E, González-Angulo L, Lienhardt C, Jaramillo E, et al. World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. The European Respiratory Journal. 2017; 49(3):1602308.
5. Tiberi S, Muñoz-Torrico M, Duarte R, Dalcolmo M, D’Ambrosio L, Migliori GB. New drugs and perspectives for new anti-tuberculosis regimens. Pulmonology. 2018; 24(2):86- 98
6. Kwon Y-S. Clinical Implications of New Drugs and Regimens for the Treatment of Drug-resistant Tuberculosis. Chonnam Med J. 2017; 53(2):103-9.
7. Falzon D, Schünemann HJ, Harausz E, González-Angulo L, Lienhardt C, Jaramillo E, et al. World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. The European Respiratory Journal. 2017; 49(3):1602308.
8. Furin JJ et al. Occurrence of serious adverse effects in patients receiving community-based therapy for multidrug-resistant tuberculosis. Int J TubercLung Dis 2001 ; 5, 7 : 648-55.
9. Tahaoglu K et al. The treatment of multidrug-resistant tuberculosis inTurkey. N Engl J Med 2001; 345, 3: 170-4.
10. Blumberg HM, Burman WJ, Chaisson RE, et al. American Thoracic Society/Centers for Disease Control and Prevention/Infectious Discases Society of America treatment of tuberculosis. Am J Respir Crit Care Med 2003;167: 603—62.
11. Yee D, Valiquette C, Pelletier M, et al. Incidence of seriousside effects from first-line antituberculosis drugs among patients treated for active tuberculosis. Am J Respir Crit Care. Med 2003;167: 1472—7.
12. Dautzenberg B, Dekimeche. Chimiothérapie antitubercu-leuse. Encycl Med Chir (Paris, France). Pneumologie,6-019-A-35; 1995. 10 p.
13. Leophonte P, Didier A, Carré Ph, et al. Modalités thé-rapeutiques de la tuberculose pulmonaire. Rev Prat1990;40:719—24.
14. Marigot-Onttandy D, Perronne C. Les nouveaux antitubercu-leux. Reanim 2009;18:332—42.
15. Van der Boogaard J, Kibiki GS, Kisanga ER, et al. Newdrugs against turberculosis: problems, progress, and evaluation agents in clinical development. Antimicrob Chemotherap 2009; 53:849—62.
16. Sherazi S. Moxifloxacine induced torsades de pointes. CardiolJ 2008;15:71—3.
17. Owens RS. Antimicrobial safety: focus fluoroquinolones. ClinInfect Dis 2005;41:S144—57
18. Hoerian H. Gatifloxacin produces both hypoglycemia and hyperglycemia: a retrospective study. Am J Med Sci 2008; 335:95—8
19. Ntziora F, Falagas ME. Linezolid for the treatment of patientswith mycobacterial infections review. Int J Tuberc Lung Dis 2007; 11:606—11.
20. Fortun J, Martin-Davila P, Navas E, et al. Linezolid for thetreatment of multi-resistant tuberculosis. J Antimicrob Che-mother 2005; 56:180—5.
21. Davies G, Cerri S, Richeldi L. Rifabutin for treating pulmonary tuberculosis. Cochrane Database Syst Rev 2007; 4: CD005159.
22. Mitnick CD, Mc Gee, Peloquin CA. Tuberculosis pharmaco-therapy: strategies to optimize patient care. Expert Opin Pharmacother 2009; 10:381—401.
23. Griffith DE, Brown BA, Girard WM, et al. Adverse events associated with high dose rifafutin in macrolid-containgingregiments for mycobacterium arium intracellulare lung disease Clin Infect Dis 1995;21:594—8.
24. Recommandations de la Société de pneumologie de langue Française pour la prise en charge de la tuberculose en France. Rev Mal Respir 2004;21(3):3S4—104
25. Center for Disease Control Prevention (CDC). Updated guide-lines for the use of rifabutin or rifampin for the treatment and prevention of tuberculosis among HIV-infected patient’s taking protease inhibitors or monnucleoside reverse transcriptase inhibitors. MMWR Morb Mortal Wkly Rep 2000; 49:185—9.
26. Aouam K, Chaabane A, Loussaief C, et al. Les effets indésirables des antituberculeux : épidémiologie, mécanismes et conduite à tenir. Med Mal Inf 2007;37:253—61.
27. Castro KG, Jereb JA, Koppaka VR, et al. Fatal liver injuryassociated with rifampicin-pyrazinamide treatment of latent tuberculosis infection. Chest 2003; 23:967.
28. Knobel B, Buyanowsky G, Dan M, et al. Pyrazinamide-induced granulomatous hepatitis. J Clin Gastroenterol1997; 24:264—6
29. Blumberg HM, Burman WJ, Chaisson RE, et al. AmericanThoracic Society/Centers for Disease Control and Preven-tion/Infectious Discases Society of America treatment of Tuberculosis. Am J Respir Crit Care Med 2003; 167:603—62
30. Ribi C, Hauser C. Adverse reactions to pyrazinamide. Allergy2002;57:964
31. Gonzales J, Dautzenberg B. Incidents et accidents du traitement antituberculeux. Rev Prat Med Gen 1996;10:11—15.
32. Lafourcade MP, Martin M, Revolte X, et al. Réaction allergique aux antituberculeux majeurs. Rev Fr Allergol 2009;49:496—9.
33. Roseau JB, Berars H, N’Guyen Huy Thuy G, et al. Uneffet secondaire grave du traitement antituberculeux : la thrombopénie induite au pyrazinamide. Rev Mal Respir 2008;25:1142—4
34. Maalouf T, Trechot P, Raspiller A. Latrogenicié oculaire des traitements systémiques. EMC (Elsevier, Paris), Traité deMédecine. AKOS, 6-0350; 1998.
35. Menon V, Jain D, Saxena R, et al. Prospective evaluation of visual function for early detection of ethambutol toxicity. BrJ Ophtalmol 2009;93:1251—4.
36. Herchline TE. Ocular ethambutol toxicity. Mayo Clin Proc2004;79:701
37. Heng JE, Vorwerk CK, Lessell E. Ethambutol is toxic to retinal ganglion cells via an excitotoxic pathway. Invest OphthalmolVis Sci 1999;40:190—6.
38. Pradhan M, Sharp D, Best S, et al. Drug-induced Optic Neuro- pathy, TB or Not TB. Surv Ophthalmol 2010;55(4):378—85.
39. Hasenbosch RE, Alffenaar, Koopmans SA, et al. Ethambutol-induced optical neuropathy: risk of overdosing in obesesubjects. Int J Tuberc Lung Dis 2008; 12:967—71.
40. Lai TYY, Chan WM, Lam DCS, et al. Multifocal elec-troretinogram demonstrated maculae toxicity associatedwith ethambutol related optic neuropathy. Br Ophthalmol 2005;89: 774—5.
41. Vistamehr S, Walsh TJ, Adelman RA. Ethambutol neuroretino-pathy. Semin Ophtalmol 2007; 22:141—6.
42. Wong PC, Yew WW, Wong CF, et al. Ethambutol-induced pul-monary infiltrates with eosinophilia and skin involvement. EurRespir J 1995;8:866—8.
FIGURES
REFERENCES
1. Crofton J, Chaulet P, Maher D. Guidelines for the management of drug resistant tuberculosis. World Health Organization ed. Proceedings of the World Health Organization, ed. WHO. 1997, Geneva: WHO. 1-40.
2. Organization WH. Treatment of tuberculosis: Guidelines. 4 ed2010.
3. Dheda K, Gumbo T, Maartens G, Dooley KE, McNerney R, Murray M, et al. The epidemiology, pathogenesis, transmission, diagnosis, and management of multidrug resistant, extensively drug-resistant, and incurable tuberculosis. The Lancet Respiratory Medicine. 2017; 5(4):291-360.
4. Falzon D, Schünemann HJ, Harausz E, González-Angulo L, Lienhardt C, Jaramillo E, et al. World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. The European Respiratory Journal. 2017; 49(3):1602308.
5. Tiberi S, Muñoz-Torrico M, Duarte R, Dalcolmo M, D’Ambrosio L, Migliori GB. New drugs and perspectives for new anti-tuberculosis regimens. Pulmonology. 2018; 24(2):86- 98
6. Kwon Y-S. Clinical Implications of New Drugs and Regimens for the Treatment of Drug-resistant Tuberculosis. Chonnam Med J. 2017; 53(2):103-9.
7. Falzon D, Schünemann HJ, Harausz E, González-Angulo L, Lienhardt C, Jaramillo E, et al. World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. The European Respiratory Journal. 2017; 49(3):1602308.
8. Furin JJ et al. Occurrence of serious adverse effects in patients receiving community-based therapy for multidrug-resistant tuberculosis. Int J TubercLung Dis 2001 ; 5, 7 : 648-55.
9. Tahaoglu K et al. The treatment of multidrug-resistant tuberculosis inTurkey. N Engl J Med 2001; 345, 3: 170-4.
10. Blumberg HM, Burman WJ, Chaisson RE, et al. American Thoracic Society/Centers for Disease Control and Prevention/Infectious Discases Society of America treatment of tuberculosis. Am J Respir Crit Care Med 2003;167: 603—62.
11. Yee D, Valiquette C, Pelletier M, et al. Incidence of seriousside effects from first-line antituberculosis drugs among patients treated for active tuberculosis. Am J Respir Crit Care. Med 2003;167: 1472—7.
12. Dautzenberg B, Dekimeche. Chimiothérapie antitubercu-leuse. Encycl Med Chir (Paris, France). Pneumologie,6-019-A-35; 1995. 10 p.
13. Leophonte P, Didier A, Carré Ph, et al. Modalités thé-rapeutiques de la tuberculose pulmonaire. Rev Prat1990;40:719—24.
14. Marigot-Onttandy D, Perronne C. Les nouveaux antitubercu-leux. Reanim 2009;18:332—42.
15. Van der Boogaard J, Kibiki GS, Kisanga ER, et al. Newdrugs against turberculosis: problems, progress, and evaluation agents in clinical development. Antimicrob Chemotherap 2009; 53:849—62.
16. Sherazi S. Moxifloxacine induced torsades de pointes. CardiolJ 2008;15:71—3.
17. Owens RS. Antimicrobial safety: focus fluoroquinolones. ClinInfect Dis 2005;41:S144—57
18. Hoerian H. Gatifloxacin produces both hypoglycemia and hyperglycemia: a retrospective study. Am J Med Sci 2008; 335:95—8
19. Ntziora F, Falagas ME. Linezolid for the treatment of patientswith mycobacterial infections review. Int J Tuberc Lung Dis 2007; 11:606—11.
20. Fortun J, Martin-Davila P, Navas E, et al. Linezolid for thetreatment of multi-resistant tuberculosis. J Antimicrob Che-mother 2005; 56:180—5.
21. Davies G, Cerri S, Richeldi L. Rifabutin for treating pulmonary tuberculosis. Cochrane Database Syst Rev 2007; 4: CD005159.
22. Mitnick CD, Mc Gee, Peloquin CA. Tuberculosis pharmaco-therapy: strategies to optimize patient care. Expert Opin Pharmacother 2009; 10:381—401.
23. Griffith DE, Brown BA, Girard WM, et al. Adverse events associated with high dose rifafutin in macrolid-containgingregiments for mycobacterium arium intracellulare lung disease Clin Infect Dis 1995;21:594—8.
24. Recommandations de la Société de pneumologie de langue Française pour la prise en charge de la tuberculose en France. Rev Mal Respir 2004;21(3):3S4—104
25. Center for Disease Control Prevention (CDC). Updated guide-lines for the use of rifabutin or rifampin for the treatment and prevention of tuberculosis among HIV-infected patient’s taking protease inhibitors or monnucleoside reverse transcriptase inhibitors. MMWR Morb Mortal Wkly Rep 2000; 49:185—9.
26. Aouam K, Chaabane A, Loussaief C, et al. Les effets indésirables des antituberculeux : épidémiologie, mécanismes et conduite à tenir. Med Mal Inf 2007;37:253—61.
27. Castro KG, Jereb JA, Koppaka VR, et al. Fatal liver injuryassociated with rifampicin-pyrazinamide treatment of latent tuberculosis infection. Chest 2003; 23:967.
28. Knobel B, Buyanowsky G, Dan M, et al. Pyrazinamide-induced granulomatous hepatitis. J Clin Gastroenterol1997; 24:264—6
29. Blumberg HM, Burman WJ, Chaisson RE, et al. AmericanThoracic Society/Centers for Disease Control and Preven-tion/Infectious Discases Society of America treatment of Tuberculosis. Am J Respir Crit Care Med 2003; 167:603—62
30. Ribi C, Hauser C. Adverse reactions to pyrazinamide. Allergy2002;57:964
31. Gonzales J, Dautzenberg B. Incidents et accidents du traitement antituberculeux. Rev Prat Med Gen 1996;10:11—15.
32. Lafourcade MP, Martin M, Revolte X, et al. Réaction allergique aux antituberculeux majeurs. Rev Fr Allergol 2009;49:496—9.
33. Roseau JB, Berars H, N’Guyen Huy Thuy G, et al. Uneffet secondaire grave du traitement antituberculeux : la thrombopénie induite au pyrazinamide. Rev Mal Respir 2008;25:1142—4
34. Maalouf T, Trechot P, Raspiller A. Latrogenicié oculaire des traitements systémiques. EMC (Elsevier, Paris), Traité deMédecine. AKOS, 6-0350; 1998.
35. Menon V, Jain D, Saxena R, et al. Prospective evaluation of visual function for early detection of ethambutol toxicity. BrJ Ophtalmol 2009;93:1251—4.
36. Herchline TE. Ocular ethambutol toxicity. Mayo Clin Proc2004;79:701
37. Heng JE, Vorwerk CK, Lessell E. Ethambutol is toxic to retinal ganglion cells via an excitotoxic pathway. Invest OphthalmolVis Sci 1999;40:190—6.
38. Pradhan M, Sharp D, Best S, et al. Drug-induced Optic Neuro- pathy, TB or Not TB. Surv Ophthalmol 2010;55(4):378—85.
39. Hasenbosch RE, Alffenaar, Koopmans SA, et al. Ethambutol-induced optical neuropathy: risk of overdosing in obesesubjects. Int J Tuberc Lung Dis 2008; 12:967—71.
40. Lai TYY, Chan WM, Lam DCS, et al. Multifocal elec-troretinogram demonstrated maculae toxicity associatedwith ethambutol related optic neuropathy. Br Ophthalmol 2005;89: 774—5.
41. Vistamehr S, Walsh TJ, Adelman RA. Ethambutol neuroretino-pathy. Semin Ophtalmol 2007; 22:141—6.
42. Wong PC, Yew WW, Wong CF, et al. Ethambutol-induced pul-monary infiltrates with eosinophilia and skin involvement. EurRespir J 1995;8:866—8.
ARTICLE INFO
DOI: 10.12699/jfvpulm.12.37.2021.49
Conflict of Interest
Non
Date of manuscript receiving
15/6/2020
Date of publication after correction
15/7/2021
Article citation
Yousfi FZ., Boutahiri N., Ouredja I., Rguig N., Nader S., Aharmim M., Bourkadi JE. Adverse effects of treatment for multidrug-resistant tuberculosis. J Func Vent Pulm 2021;37(12):49-56