
 English
English
 French
French
Management of spontaneous hemothorax and hemo-pneumo thorax
Conduite à tenir devant les hémothorax et hémopneumothorax spontanés
S. Rabiou1, S. Ghazwani2, N. Patrick3, M. Lakranbi1, R. Sani4,6, M. Serraj5,7, A. Elbouazzaoui3,7, Y. Ouadnouni1,7, M. Smahi1,7
1; Service de Chirurgie Thoracique, CHU Hassan II-Fes, Maroc
2; Service de Chirurgie Générale et Digestive CHU de Montpellier, Montpellier-France
3; Service d’Anesthésie et de Réanimation Polyvalente A4, CHU Hassan II-Fes, Maroc
4; Service de Chirurgie Générale, HNN-Niamey, Niger
5; Servie de Pneumologie, CHU Hassan II -Fes, Maroc
6; Faculté des Sciences de la Santé, Université Abdou Moumouni, Niamey, Niger
7; Faculté de Médecine et Pharmacie, Université Sidi Mohamed Ben Abdellah, Fes, Maroc
Corresponding author
Dr. Sani RABIOU
Service de Chirurgie Thoracique. CHU Hassan II de Fes - Maroc
Email : rabiousani2@icloud.com
ABSTRACT
Spontaneous hemothorax corresponds to an accumulation of blood in the pleural cavity outside of any traumatic context. It is a rare clinical entity whose etiologies are generally reported in the form of clinical cases or series of sporadic cases especially in Anglo-Saxon literature. The clinical presentation varies from a completely asymptomatic patient to a haemorrhagic shock. Indeed, the consequences of the respiratory and hemodynamic dysfunction that accompany these hemothorax are likely to lead to the prognosis and/or aggravate the prognosis of the underlying pathology. This justifies a rapid response with the adoption of a comprehensive therapeutic strategy combining an assessment of severity, appropriate guidance, symptomatic management (oxygen therapy, transfusion) and etiologic management. The majority of these etiologies are poorly known not only to pulmonologists but also to thoracic surgeons who must nevertheless be the main actors in the management of these haemothoraxes whose diagnosis and management will be described along this article.
KEYWORDS: Hemothorax, hemopneumothorax, exostose, thoracic endometriosis, thoracic drainage.
RÉSUMÉ
L’hémothorax spontané correspond à une accumulation du sang dans la cavité pleurale en dehors de tout contexte traumatique. Il s'agit d'une entité clinique rare dont les étiologies sont généralement rapportées sous forme de cas clinique ou de séries des cas sporadique surtout dans la littérature anglo-saxonne. La présentation clinique est variable allant d'un patient totalement asymptomatique au tableau d'un état de choc hémorragique. En effet, les conséquences de la dysfonction respiratoire et hémodynamique qui accompagnent ces hémothorax sont susceptibles d’engager le pronostic vital et/ou d’aggraver le pronostic de la pathologie sous-jacente. Ce qui justifie une réponse rapide avec l’adoption d'une stratégie thérapeutique complète associant une évaluation de la gravité, une orientation adaptée, une prise en charge symptomatique (oxygénothérapie, transfusion) et étiologique. La majorité de ces étiologies sont mal connues non seulement des pneumologues mais aussi des chirurgiens thoraciques qui doivent pourtant être les principaux acteurs dans la prise en charge de ces hémothorax dont le diagnostic et la prise en charge seront décrits le long de cet article.
MOTS CLÉS: Hémothorax, hémopneumothorax, exostose, endométriose thoracique, drainage thoracique.
INTRODUCTION
Dans la littérature on trouve qu'environ 5% des patients admis pour pneumothorax spontanés ont un hémothorax concomitant. La présentation clinique peut varier entre les patients qui sont complètement asymptomatiques et ceux qui présentent d’emblée un état de choc hémorragique. La quantité de sang dans la cavité pleurale peut varier de plusieurs centaines de millilitres à plus de 1,5 litres [1]. La source de ce saignement spontané est variable, mais dans la majorité des cas il s'agit d'une rupture des adhérences vascularisées entre la plèvre pariétale et viscérale, chez des patients ayant au préalable un pneumothorax spontané. Cependant, il existe d'autres pathologies qui peuvent entraîner un hémothorax. Les données de la littérature concernant ces hémothorax dits ''spontanés'' sont limitées à quelques cas cliniques sporadiques. Malgré leur rareté, le pneumologue et le chirurgien thoracique doivent être familier à la gestion de ces hémothorax dont les étiologies et la prise en charge seront décrites le long de cet article.
DÉFINITION
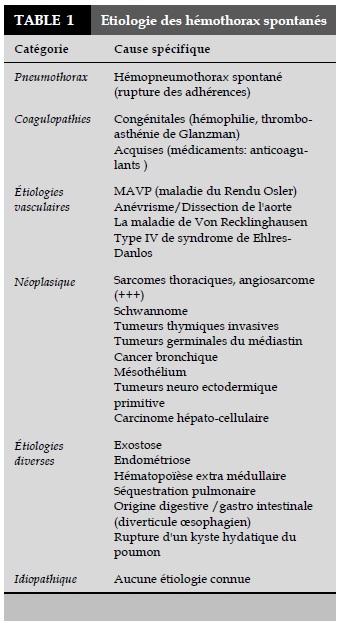
Devant un épanchement pleural hémorragique, il est important de faire la distinction entre une pleurésie sérohématique et un hémothorax vrai. L’évaluation du taux de l'hématocrite après ponction pleurale permet d'orienter vers une pleurésie sérohématique si le l'hématocrite dans le liquide pleural est inférieur à 5% de l’hématocrite sanguin du patient. L’hémothorax est défini comme un épanchement sanguin dans la cavité pleurale avec un hématocrite dépassant 50% du taux de l’hématocrite sanguin [2]. Les causes les plus fréquentes d'un hémothorax sont les traumatismes thoraciques, les suites postopératoires, ou lors de la mise en place d'un cathéter de voie centrale. Cependant, il existe d'autres pathologies qui peuvent entraîner un hémothorax (Tableau 1). Les données de la littérature concernant ces hémothorax dits ''spontanés'' sont limitées à quelques cas cliniques sporadiques.
Les étiologies des hémothorax spontanés
Hémopneumothorax spontané
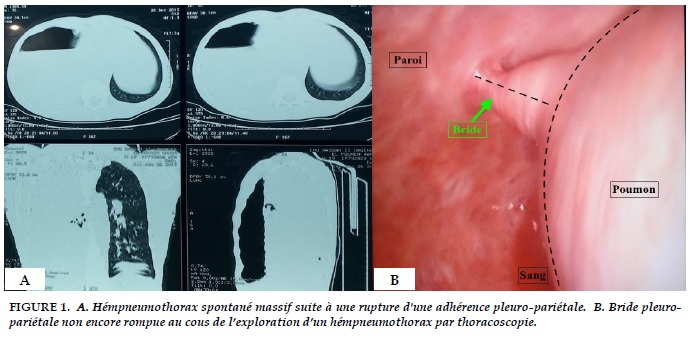
Le premier cas d' hémopneumothorax spontané revient à Laennec, qui l'a décrit en 1828 au cours d'une autopsie. Les premières observations cliniques ont été publiées indépendamment en 1900 par Pitt [3] et Rolleston [4]. En 1950, Myers et al. [5] effectua une thoracotomie d'hémostase pour traiter un hémopneumothorax spontané. Depuis cette description initiale, plus de 17 nouveaux cas de thoracotomie d'urgence pour hémopneumothorax spontané ont été rapportés dans la littérature anglo-saxonne [6,7-18]. La source du saignement est liée à une rupture des adhérences vascularisées entre la plèvre pariétale et viscérale, chez des patients ayant au préalable un pneumothorax spontané (Figure 1A et B ). La rupture est favorisée par la décompression brutale du poumon qui s'affaisse en créant une force de tension sur les adhérences pleuro-pariétales contenant des vaisseaux fragiles. C'est le défaut de ré-expansion pulmonaire qui empêche le tamponnement du saignement par le poumon et permet au sang sous pression de s'accumuler dans l'espace pleural. La prise en charge dépend de l’état hémodynamique du patient. Chez des patients d’emblée instable une thoracotomie d'urgence s'impose afin d'identifier puis de traiter la cause. Il s'agit dans la majorité des cas de petits vaisseaux systémiques de petit calibre mais avec un débit et une pression importante rendant toute hémostase spontanée illusoire. Pour les patients qui sont stables ou stabilisés sur le plan hémodynamique, un traitement par chirurgie thoracique vidéo assistée peut être proposer.
Étiologies vasculaires
Les étiologie d'origine vasculaires des hémothorax sont de loin dominées par la dissection aortique et la rupture d’un anévrisme de l'aorte thoracique. Le signe clinique inaugural est généralement une douleur thoracique aiguë devant laquelle la tomodensitométrie thoracique avec injection de produit de contraste permet de mettre aisément en évidence l'anomalie aortique. Des cas d’hémothorax suite à une rupture spontanée de l'artère mammaire interne, une hémorragie artérielle pulmonaire ont été rapportés [19-21]. Ces derniers rentrent dans le type IV de syndrome d'Ehlers-Danlos qui correspond à un défaut de production de fibres de collagène de type III, donnant des vaisseaux à parois minces et ectasiques sensibles à la dilatation et donc à la rupture. Les malformations artério-veineuses pulmonaires (MAVP) sont définis comme une communication vasculaire anormale entre une artère pulmonaire et une veine pulmonaire, entraînant un shunt droit-gauche. Il s'agit d'une maladie héréditaire à transmission autosomique dominante responsable des télangiectasies hémorragiques au niveau de la peau, les muqueuses et les autres viscères. Pour les localisations pulmonaires, la taille de la malformation peut varier de quelques millimètres à plusieurs centimètres localisés généralement au sein du parenchyme pulmonaire, dont la rupture entraine des hémoptysies plus que des hémothorax. C'est la rupture des malformations artério-veineuses à localisation sous pleurale qui sont responsable d'un hémothorax souvent de grande abondance. Des études dans la littérature ont trouvés des cas de rupture accélérée des malformations artério-veineuses avec la grossesse en rapport avec l'augmentation du volume sanguin pendant cette période [22,23]. La prise en charge des hémothorax liés à une malformation artério-veineuse comporte d'abord un drainage thoracique. Chez les malades stables après drainage, une embolisation par voie endo-vasculaire est envisageable si non une prise en charge par thoracotomie ou par chirurgie thoracique vidéo assistée s'impose afin de traiter effectivement la ou les lésions en cause.

Les exostoses costales
L’hémothorax tout comme l'hémopéricarde spontané est une complication exceptionnelle des exostoses costales. Il s'agit d'une maladie héréditaire à transmission autosomique dominante avec une prévalence de 1 sur 50000 habitants pouvant être isolée ou rentrée dans le cadre d'une maladie des exostoses multiples [24]. Deux grands mécanismes physiopathologiques peuvent expliquer la survenue des hémothorax spontanés dans le cadre d'une maladie exostosante costale. D’une part, la rupture de vaisseaux dilatés de la paroi thoracique: ces dilatations sont la résultante, soit d’une inflammation chronique par friction entre l’exostose et la paroi, soit d’une simple compression mécanique de petits vaisseaux [25,26]; d’autre part, la présence d’une ou de plusieurs plaies au niveau du diaphragme, de la plèvre ou du poumon de façon plus ou moins chroniques [27,28]. La conduite du traitement consiste au contrôle de l'hémorragie par l'évacuation de l' hémothorax, puis la résection des exostoses pour prévenir la survenue d'autres épisodes d' hémothorax.

Endométriose thoracique
L’hémothorax spontané peut être secondaire à une implantation de tissus endomètriaux sur la surface pleurale. Il répond aux changements hormonaux cycliques observés chez les femmes pendant les cycles menstruels. L'implantation de l'endomètre au niveau thoracique fait suite à la migration du tissu endométrial à travers des fenestrations dans le diaphragme ou encore une micro-embolisation d'endomètre par voie hématogène [29]. Connu sous le nom d’hémothorax cataménial, il peut être isolé ou rarement s'accompagner d'un pneumothorax et concerne le côté droit dans 90% des cas [30,31]. Le diagnostic est avant tout histologique au moyen d'une biopsie, car le bilan radiologique n'est pas spécifique. La radiographie et la tomodensitométrie thoracique peuvent montrer un épaississement voire une masse focale de la plèvre [32,33]. L’évolution est généralement favorable sous traitement hormonal visant à limiter la sécrétion d'œstrogènes ou de produire une aménorrhée. En cas d'échec d'une thérapie hormonale ou en présence des épisodes récurrents d'hémothorax cataménial, l'exploration chirurgicale de la cavité pleurale s'impose. Elle permettra la résection des implants endométriaux permettant de poser le diagnostic histologique mais aussi la ré-expansion pulmonaire dans le cas où l’hémothorax est associé à un pneumothorax spontanée [34,35].

Causes néoplasiques
Plusieurs processus néoplasiques peuvent être responsables d'un hémothorax. Le cancer du poumon au stade avancé peut se traduire souvent par un épanchement pleural malin, mais l'hémothorax spontané associé au cancer du poumon est exceptionnel [36]. La neurofibromatose de Von Recklinghausen, soit par envahissement des structures vasculaires par le neurofibrome, soit par dysplasie artérielle a souvent donné lieu à un hémothorax [21,37-39]. Les métastases pulmonaires des sarcomes particulièrement l'angiosarcome, est une cause fréquente des hémothorax et témoigne le degré de malignité de la tumeur [40]. L'association d'un sarcome thoracique à un hémothorax laisse présager un mauvais pronostic, avec un taux de mortalité à 8 mois de plus de 80% [21]. Des tumeurs extra-thoraciques comme le carcinome hépatocellulaire peuvent envahir le poumon et s'associe souvent à un hémothorax concomitant [41]. De même les tumeurs médiastinales telles le thymome ou tumeurs germinales ont été rapportés comme cause d’hémothorax suite à une rupture dans la plèvre [42,43].

Les coagulopathies
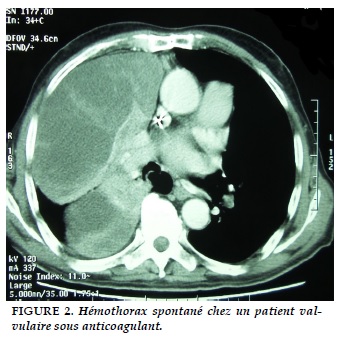
Des hémothorax suite à l'utilisation d'un traitement anticoagulant ont été rapportés (Figure 2).
L’accumulation du sang dans la cavité pleurale peut être secondaire à un traumatisme généralement minime chez les patients présentant une anomalie de l’hémostase. De nombreux cas d’hémothorax sous anticoagulant ont été documentés dans la littérature, le plus souvent dans le cadre du traitement de la maladie thromboembolique. Le saignement peut également se produire après administration de thrombolytiques par voie systémiques ou en intra-pleurale direct. Certaines coagulopathies héréditaires telles que l’hémophilie sont aussi incriminées dans la genèse des hémothorax spontanés [44,45]. La base de la prise en charge de cette entité repose sur la correction de trouble de la coagulation en cause suivie par l'évacuation de l'hémothorax au moyen d'un drainage thoracique. L’évacuation de la cavité pleurale avec l’arrêt du saignement est généralement obtenue, une fois la coagulopathie corrigée.
Les étiologies rares
Il s'agit en réalité de quelques cas cliniques rapportés comme le cas d’un hémothorax suite à un anévrisme de la veine inférieure chez une femme de 47 ans [46]. Des hémothorax suite à une perforation d'un diverticule œsophagiens [47], ou une rupture de kyste hydatique [48] dans la cavité pleurale ont été rapportés dans la littérature.
Les hémothorax spontanés dits idiopathiques
Dans la plupart des hémothorax, l'enquête étiologique couplé aux examens complémentaires précise la cause permettant ainsi d’entreprendre un traitement spécifique. Si à cette étape préliminaire aucune étiologie n'est identifiable, une thoracotomie exploratrice pourra être indiquée permettant ainsi de vérifier l’ensemble de la cavité thoracique. Souvent c'est l'examen à l’autopsie qui trouve la cause de saignement chez les patients n'ayant pas survécu [49]. Il est donc très rare de nos jours de passer à côté sans identifier l'origine du saignement et seulement 3 à 4 cas de ces hémothorax spontanés dits vraiment idiopathiques ont été rapporté dans la littérature jusqu'à l’année 2008 [50-52].

Conduite à tenir devant un hémothorax spontané
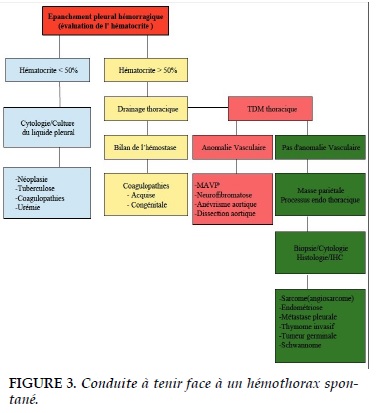
La première étape de la prise en charge devant un épanchement pleural hémorragique consiste à réaliser une ponction pleurale afin de comparer son hématocrite par rapport à l'hématocrite sanguin du patient (Figure 3).
On parle d’hémothorax quand le taux d'hématocrite dépasse 50% et une recherche étiologique doit être menée. Il est important de préciser que même dans un hémothorax on peut avoir un taux d’hématocrite très bas, lié à une dilution après 3 à 4 jours d’évolution d'autant plus que le tableau clinique d'un hémothorax n'est pas toujours aiguë, en particulier chez un sujet jeune sans pathologie respiratoire sous-jacente. Outre les paramètres biologiques, une tomodensitométrie thoracique avec injection de produit de contraste peut orienter vers une étiologie comme une rupture d'un anévrisme notamment des gros vaisseaux médiastinaux. La recherche d'une malformation artério-veineuse pulmonaire nécessite la réalisation d'une échocardiographie Doppler par un examinateur entraîné. La recherche des étiologies néoplasiques sur la cytologie pleurale présente un rendement très aléatoire. Il est donc difficile de faire un diagnostic sans équivoque des étiologies néoplasiques habituelles tels que l'angiosarcome, uniquement sur la base de la cytologie du liquide pleural, mais des marqueurs immuno-chimiques peuvent améliorer la sensibilité et la spécificité de cet examen. L'identification des cellules endomètriales dans le liquide de ponction serait illusoire car le diagnostic est avant tout histologique. Devant un patient qui présente un hémothorax spontané, un interrogatoire approfondi et bien conduit constitue une étape fondamentale permettant de faire le lien entre les symptômes et la possibilité d'un diagnostic étiologique (Tableau 2).
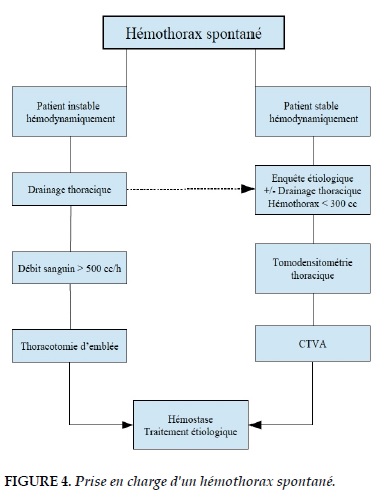
La prise en charge d'un hémothorax spontané nécessite avant tout la mise en place d'un drain thoracique de calibre adapté, permettant ainsi l'évacuation du sang de la cavité pleurale et donc une bonne ré-expansion pulmonaire. La suite de la prise en charge n'est pas codifiée et dépend essentiellement de l’état hémodynamique du patient. Dans une série de 71 patients traités pour hémo-pneumothorax spontané, un traitement conservateur était satisfaisant dans 22,5% des cas. 39% des patients étaient admis dans un état de choc et la prise en charge avait nécessité une intervention chirurgicale immédiate. Pour les autres patients la prise en charge était dicté selon des critères comme la persistance de l’hémothorax ou la présence d’un caillot malgré le drainage, le défaut de ré-expansion pulmonaire nécessitant la résection d'une bulle d’emphysème responsable d'un pneumothorax associé [53].
Le choix de la voie d'abord dépend de l'habitude de chaque équipe. Certains auteurs préfèrent la chirurgie thoracique vidéo assistée (CTVA). En effet la CTVA permet une exploration approfondie de toute la cavité pleurale. Elle permet aussi l'évacuation complète de l’hémothorax, le contrôle du saignement en cours, mais aussi le traitement étiologique de l’hémothorax et la cure du pneumothorax souvent
associé. Toute fois, chez un patient ayant un hémothorax de faible abondance (< 300 millilitres), stable sur le plan hémodynamique, avec une ré-expansion pulmonaire complète après drainage, un traitement conservateur avec surveillance du patient est raisonnable. Le traitement étiologique comme la correction d'un trouble de l’hémostase induit par les anticoagulants doit être de mise afin d'optimiser les résultats de la prise charge (Figure 4).
CONCLUSION
Bien que rare, les étiologies des hémothorax spontanés sont fréquentes et variées et doivent être connues par tous les praticiens impliqués dans la prise en charge de cette entité. Le diagnostic clinique et difficile devant des signes cliniques qui sont non spécifiques. L’enquête étiologique doit être conduite de façon rigoureuse chez un patient stable sur le plan hémodynamique. En cas d’hémothorax massif responsable d'un état de choc hémorragique, l'indication chirurgicale ne doit souffrir d'aucun retard.
CONFLIT D’INTÉRÊT
Tous les auteurs déclarent n'avoir aucun conflit d’intérêt en rapport avec ce manuscrit.
RÉFÉRENCES
1. Hsu NY, Shis CS, Hsu CP, et al. Spontaneous hemop-neumothorax revisited: clinical approach and systemic review of the literature. Ann Thorac Surg 2005;80:1859-63.
2. Ali HA, Lippmann M, Mundathaje U, Khaleeq G. Spontaneous hemothorax: a comprehensive review. Chest 2008;134:1056-65.
3. Pitt G. A case of rapidly fatal haemothorax apparently due to the rupture of an emphysematous bulla. Trans Clin Soc Lond 1900; 33: 95.
4. Rolleston HD. A case of fatal haemopneumothorax of unexplained origin. Trans Clin Soc Lond 1900; 33: 90.
5. Myers RT, Johnston FR, Bradshaw HH. Spontaneous haemopneumothorax. Ann Surg 1951; 133: 413-416.
6. Borrie J. Emergency thoracotomy for massive sponta-neous haemopneumothorax. Br Med J 1953; 2:16-18.
7. Rydell JR. Emergency thoracotomy for massive spon-taneous pneumothorax. J Thorac Cardiovasc Surg 1959; 37: 382-386.
8. Ross CA. Spontaneous haemopneumothorax. J Thorac Surg 1953; 23: 582-592.
9. Beatty JA, Frelick RW. Haemopneumothorax: re-evaluation of treatment. Ann Intern Med 1952; 36: 845.
10. Clyne AJ, Hutter FHD. Spontaneous haemopneumo-thorax, a surgical emergency. Br Med J 1955;1:1058-1060.
11. Hinton JP. Spontaneous haemopneumothorax. Proc RoySoc Med 1964; 57: 329-330.
12. Clarke CP, Cole DS. The management of spontaneous haemopneumothorax. Aust NZ J Surg 1966; 35: 212.
13. Schwartzman PS. Spontaneous haemothorax. J Am Col Emerg Phys 1979; 8: 235-237.
14. Eastridge CE. Spontaneous haemopneumothorax re-quiring thoracotomy. South Med J 1955; 78: 1392-1393.
15. Deaton WR, Greensboro NC, Winston-Salem NC, Johnson FR. Spontaneous haemopneumothorax. J Tho-rac Cardiovasc Surg 1962; 43: 413-415.
16. Gerard FP, Sabety AM. Spontaneous haemopneumo-thorax. J Med Soc New Jersey 1966; 3: 506–508.
17. Mayo P. Spontaneous haemopneumothorax. Dis Chest 1961; 40: 539–542.
18. Whitford P, Russell CFJ. Spontaneous haemopneumo-thorax. Ulster Med J 1985; 54: 72–74.
19. Phan TG, Sakulsaengprapha A, Wilson M, et al. Rup-tured internal mammary artery aneurysm presenting as massive spontaneous haemothorax in a patient with Ehlers-Danlos syndrome. Aust N Z J Med 1998;28:210–1.
20. Hasan RI, Krysiak P, Deiranyia AK, et al. Spontaneous rupture of the internal mammary artery in Ehlers-Danlos syndrome. J Thorac Cardiovasc Surg 1993;106:184-5.
21. Ali HA, Lippmann M, Mundathaje U, et al. Sponta-neous hemothorax: a comprehensive review. Chest 2008;134:1056-65.
22. Ference BA, Shannon TM, White RI, et al. Life-threatening pulmonary hemorrhage with pulmonary arteriovenous malformations and hereditary hemor-rhagic telangiectasia. Chest 1994;106:1387-90.
23. Martinez FJ, Villaneuna AG, Pickering R, et al. Sponta-neous hemothorax: report of six cases and review of the literature. Medicine 1992;71:354 -68.
24. Vanhoenacker FM, Van Hul W, Wuyts W,et al. Here-ditary multiple exostoses: from genetics to clinical syndrome and complication. Eur J Radiol 2001;40:208-17.
25. Uchida K, Kurihara Y, Sekiguchi S, et al. Spontaneous hemothorax caused by costal exostosis. Eur Respir J 1997 ; 10 : 735-6.
26. Cowles RA, Rowe DH, Arkovitz MS. Hereditary mul-tiple exostoses of the ribs: an unusual cause of hemo-thorax and pericardial effusion. J Pediatr Surg 2005 ; 40 : 1197-200.
27. Simansky DA, Paley M, Werczberger A, et al. Exostosis of rib causing laceration of the dia-phragm : diagnosis and management. Ann Thorac Surg 1997 ; 63 : 856-7.
28. Hajjar WM, El-Medany YM, Essa MA, et al. Unusual presentation of rib exostosis. Ann Thorac Surg 2003 ; 75 : 575-7.
29. Nunes H, Bagan P, Kambouchner M, et al. Endomé-triose thoracique Rev mal respir 2007;24:1329-40
30. Joseph J, Sahn AS : Thoracic endometriosis: new ob-servations from an analysis of 110 cases. Am J Med 1996 ; 100 : 164-70.
31. Alifano M, Trisolini R, Cancellieri A, et al. Thoracic endometriosis: current knowledge. Ann Thorac Surg 2006 ; 81 : 761-9.
32. Alifano M, Venissac N, Mouroux J : Recurrent pneu-mothorax associated with thoracic endometriosis. Surg Endosc 2000 ; 14 : 680.
33. Rossi NP, Goplerud CP : Recurrent catamenial pneu-mothorax. Arch Surg 1974 ; 109 : 173-6.
34. Joseph J, Sahn SA. Thoracic endometriosis syndrome: new observations from an analysis of 110 cases. Am J Med 1996;100:164-70.
35. Bagan P, Le Pimpec Barthes F, Assouad J, et al. Cata-menial pneumothorax: retrospective study of surgical treatment. Ann Thorac Surg 2003;75:378-81.
36. Ausín P, Gómez-Caro A , Pérez Rojo R, et al. Sponta-neous Hemothorax Caused by Lung Cancer, Arch Bronconeumol. 2005;41(7):400-1
37. MiuraH, Taira O,UchidaO, et al. Spontaneous hae-mothorax associate with Von Recklinghausen’s di-sease: review of occurrence in Japan. Thorax 1997;52:577-8.
38. Yoshida K, Tobe S. Dissection and rupture of the left subclavian artery presenting as hemothorax in a pa-tient with Von Recklinghausen’s disease. Jpn J Thorac Cardiovasc Surg 2005;53:117-9.
39. Tatebe S, Asami F, Shinohara H, et al. Ruptured aneu-rysm of the subclavian artery in a patient with von Recklinghausen’s disease. Circ J 2005;69: 503–6.
40. Liu SF, Wu CC, Lai YF, et al. Massive hemoptysis and hemothorax caused by pleuropulmonary angiosarco-ma. Am J Emerg Med 2002;20:374-5.
41. Sohara N, Takagi H, Yamada T, et al. Hepatocellular carcinomacomplicated by hemothorax. J Gastroente-rol 2000;35:2400-4.
42. Caplin JL, Gullan RW, Dymond DS, et al. Hemotho-rax due to rupture of a benign thymoma. Jpn Heart J.1985;26:123-5.
43. Yang WM, Chen ML, Lin TS. Traumatic hemothorax resulting from rupture of a mediastinal teratoma: a case report. Int Surg 2005;90:241-4.
44. Hsiao CW, Lee SC, Chen JC, et al. Massive sponta-neous haemopneumothorax in a patient with hae-mophilia. ANZ J Surg 2001;71:770-1.
45. Morecroft JA, Lea RE. Haemothorax: a complication of anticoagulation for suspected pulmonary embo-lism. Br J Clin Pract 1988;42:217-8.
46. Lawand Q, Yildirim Imren V, Emrah E, et al. Ané-vrysme de la veine cave inférieure avec hémotho-rax:Une présentation rare Ann Vasc Surg 2010;24:823.e11-e14.(DOI:10.1016/.acvfr.2011.01.016 ).
47. Etsuko W, Yoshiro M, Yasuharu N, et al. A case of hemothorax resulting from perforation of an eso-phageal diverticulum Respiratory Medicine CME 2011;4 :198-200.
48. Figen T, Gokhan Y, Cansel A et al. Hydatid cyst, an unusual cause of spontaneous hemothorax and dia-gnostic thoracoscopy: Case report , heart & lung. 2012;41:192-195.
49. Ke HY, Lee SC, Tzao C, et al. Spontaneous massive haemothorax caused by rupture of an intercostal vein. Emerg Med J 2006; 23:e49.
50. Garcıa-Talavera I, Perez Negrın L, Casanova Macario C. Idiopathic spontaneous hemothorax Arch Bronco-neumol 2000; 36:59–60.
51. Yung CM, Bessen SC, Hingorani V, et al. Idiopathic hemothorax. Chest 1993; 103:638–639.
52. Dimitri WR. Massive idiopathic spontaneous hae-mothorax: case report and literature review. Eur J Car-diothorac Surg 1987; 1:55–58.
53. Kakaris S, Athanassiadi K, Vassilikos K, et al. Sponta-neous hemopneumothorax: a rare but lifethreatening entity. Eur J Cardiothorac Surg 2004; 25:856–8.
FIGURES - TABLES

RÉFÉRENCES
1. Hsu NY, Shis CS, Hsu CP, et al. Spontaneous hemop-neumothorax revisited: clinical approach and systemic review of the literature. Ann Thorac Surg 2005;80:1859-63.
2. Ali HA, Lippmann M, Mundathaje U, Khaleeq G. Spontaneous hemothorax: a comprehensive review. Chest 2008;134:1056-65.
3. Pitt G. A case of rapidly fatal haemothorax apparently due to the rupture of an emphysematous bulla. Trans Clin Soc Lond 1900; 33: 95.
4. Rolleston HD. A case of fatal haemopneumothorax of unexplained origin. Trans Clin Soc Lond 1900; 33: 90.
5. Myers RT, Johnston FR, Bradshaw HH. Spontaneous haemopneumothorax. Ann Surg 1951; 133: 413-416.
6. Borrie J. Emergency thoracotomy for massive sponta-neous haemopneumothorax. Br Med J 1953; 2:16-18.
7. Rydell JR. Emergency thoracotomy for massive spon-taneous pneumothorax. J Thorac Cardiovasc Surg 1959; 37: 382-386.
8. Ross CA. Spontaneous haemopneumothorax. J Thorac Surg 1953; 23: 582-592.
9. Beatty JA, Frelick RW. Haemopneumothorax: re-evaluation of treatment. Ann Intern Med 1952; 36: 845.
10. Clyne AJ, Hutter FHD. Spontaneous haemopneumo-thorax, a surgical emergency. Br Med J 1955;1:1058-1060.
11. Hinton JP. Spontaneous haemopneumothorax. Proc RoySoc Med 1964; 57: 329-330.
12. Clarke CP, Cole DS. The management of spontaneous haemopneumothorax. Aust NZ J Surg 1966; 35: 212.
13. Schwartzman PS. Spontaneous haemothorax. J Am Col Emerg Phys 1979; 8: 235-237.
14. Eastridge CE. Spontaneous haemopneumothorax re-quiring thoracotomy. South Med J 1955; 78: 1392-1393.
15. Deaton WR, Greensboro NC, Winston-Salem NC, Johnson FR. Spontaneous haemopneumothorax. J Tho-rac Cardiovasc Surg 1962; 43: 413-415.
16. Gerard FP, Sabety AM. Spontaneous haemopneumo-thorax. J Med Soc New Jersey 1966; 3: 506–508.
17. Mayo P. Spontaneous haemopneumothorax. Dis Chest 1961; 40: 539–542.
18. Whitford P, Russell CFJ. Spontaneous haemopneumo-thorax. Ulster Med J 1985; 54: 72–74.
19. Phan TG, Sakulsaengprapha A, Wilson M, et al. Rup-tured internal mammary artery aneurysm presenting as massive spontaneous haemothorax in a patient with Ehlers-Danlos syndrome. Aust N Z J Med 1998;28:210–1.
20. Hasan RI, Krysiak P, Deiranyia AK, et al. Spontaneous rupture of the internal mammary artery in Ehlers-Danlos syndrome. J Thorac Cardiovasc Surg 1993;106:184-5.
21. Ali HA, Lippmann M, Mundathaje U, et al. Sponta-neous hemothorax: a comprehensive review. Chest 2008;134:1056-65.
22. Ference BA, Shannon TM, White RI, et al. Life-threatening pulmonary hemorrhage with pulmonary arteriovenous malformations and hereditary hemor-rhagic telangiectasia. Chest 1994;106:1387-90.
23. Martinez FJ, Villaneuna AG, Pickering R, et al. Sponta-neous hemothorax: report of six cases and review of the literature. Medicine 1992;71:354 -68.
24. Vanhoenacker FM, Van Hul W, Wuyts W,et al. Here-ditary multiple exostoses: from genetics to clinical syndrome and complication. Eur J Radiol 2001;40:208-17.
25. Uchida K, Kurihara Y, Sekiguchi S, et al. Spontaneous hemothorax caused by costal exostosis. Eur Respir J 1997 ; 10 : 735-6.
26. Cowles RA, Rowe DH, Arkovitz MS. Hereditary mul-tiple exostoses of the ribs: an unusual cause of hemo-thorax and pericardial effusion. J Pediatr Surg 2005 ; 40 : 1197-200.
27. Simansky DA, Paley M, Werczberger A, et al. Exostosis of rib causing laceration of the dia-phragm : diagnosis and management. Ann Thorac Surg 1997 ; 63 : 856-7.
28. Hajjar WM, El-Medany YM, Essa MA, et al. Unusual presentation of rib exostosis. Ann Thorac Surg 2003 ; 75 : 575-7.
29. Nunes H, Bagan P, Kambouchner M, et al. Endomé-triose thoracique Rev mal respir 2007;24:1329-40
30. Joseph J, Sahn AS : Thoracic endometriosis: new ob-servations from an analysis of 110 cases. Am J Med 1996 ; 100 : 164-70.
31. Alifano M, Trisolini R, Cancellieri A, et al. Thoracic endometriosis: current knowledge. Ann Thorac Surg 2006 ; 81 : 761-9.
32. Alifano M, Venissac N, Mouroux J : Recurrent pneu-mothorax associated with thoracic endometriosis. Surg Endosc 2000 ; 14 : 680.
33. Rossi NP, Goplerud CP : Recurrent catamenial pneu-mothorax. Arch Surg 1974 ; 109 : 173-6.
34. Joseph J, Sahn SA. Thoracic endometriosis syndrome: new observations from an analysis of 110 cases. Am J Med 1996;100:164-70.
35. Bagan P, Le Pimpec Barthes F, Assouad J, et al. Cata-menial pneumothorax: retrospective study of surgical treatment. Ann Thorac Surg 2003;75:378-81.
36. Ausín P, Gómez-Caro A , Pérez Rojo R, et al. Sponta-neous Hemothorax Caused by Lung Cancer, Arch Bronconeumol. 2005;41(7):400-1
37. MiuraH, Taira O,UchidaO, et al. Spontaneous hae-mothorax associate with Von Recklinghausen’s di-sease: review of occurrence in Japan. Thorax 1997;52:577-8.
38. Yoshida K, Tobe S. Dissection and rupture of the left subclavian artery presenting as hemothorax in a pa-tient with Von Recklinghausen’s disease. Jpn J Thorac Cardiovasc Surg 2005;53:117-9.
39. Tatebe S, Asami F, Shinohara H, et al. Ruptured aneu-rysm of the subclavian artery in a patient with von Recklinghausen’s disease. Circ J 2005;69: 503–6.
40. Liu SF, Wu CC, Lai YF, et al. Massive hemoptysis and hemothorax caused by pleuropulmonary angiosarco-ma. Am J Emerg Med 2002;20:374-5.
41. Sohara N, Takagi H, Yamada T, et al. Hepatocellular carcinomacomplicated by hemothorax. J Gastroente-rol 2000;35:2400-4.
42. Caplin JL, Gullan RW, Dymond DS, et al. Hemotho-rax due to rupture of a benign thymoma. Jpn Heart J.1985;26:123-5.
43. Yang WM, Chen ML, Lin TS. Traumatic hemothorax resulting from rupture of a mediastinal teratoma: a case report. Int Surg 2005;90:241-4.
44. Hsiao CW, Lee SC, Chen JC, et al. Massive sponta-neous haemopneumothorax in a patient with hae-mophilia. ANZ J Surg 2001;71:770-1.
45. Morecroft JA, Lea RE. Haemothorax: a complication of anticoagulation for suspected pulmonary embo-lism. Br J Clin Pract 1988;42:217-8.
46. Lawand Q, Yildirim Imren V, Emrah E, et al. Ané-vrysme de la veine cave inférieure avec hémotho-rax:Une présentation rare Ann Vasc Surg 2010;24:823.e11-e14.(DOI:10.1016/.acvfr.2011.01.016 ).
47. Etsuko W, Yoshiro M, Yasuharu N, et al. A case of hemothorax resulting from perforation of an eso-phageal diverticulum Respiratory Medicine CME 2011;4 :198-200.
48. Figen T, Gokhan Y, Cansel A et al. Hydatid cyst, an unusual cause of spontaneous hemothorax and dia-gnostic thoracoscopy: Case report , heart & lung. 2012;41:192-195.
49. Ke HY, Lee SC, Tzao C, et al. Spontaneous massive haemothorax caused by rupture of an intercostal vein. Emerg Med J 2006; 23:e49.
50. Garcıa-Talavera I, Perez Negrın L, Casanova Macario C. Idiopathic spontaneous hemothorax Arch Bronco-neumol 2000; 36:59–60.
51. Yung CM, Bessen SC, Hingorani V, et al. Idiopathic hemothorax. Chest 1993; 103:638–639.
52. Dimitri WR. Massive idiopathic spontaneous hae-mothorax: case report and literature review. Eur J Car-diothorac Surg 1987; 1:55–58.
53. Kakaris S, Athanassiadi K, Vassilikos K, et al. Sponta-neous hemopneumothorax: a rare but lifethreatening entity. Eur J Cardiothorac Surg 2004; 25:856–8.
ARTICLE INFO
DOI: 10.12699/jfvpulm.9.28.2018.1
Conflict of Interest
Non
Date of manuscript receiving
Date of publication after correction
Article citation
Rabiou S, Ghazwani S, Patrick N, Lakranbi M, Sani R, Serraj M, Elbouazzaoui A, Ouadnouni Y, Smahi M. Management of spontaneous hemothorax and hemo-pneumo thorax. J Func Vent Pulm 2018;28(9):1-8.