
 English
English
 French
French
Multidrug-resistant tuberculosis of children and adolescents in Conakry
La tuberculose multi-résistante de l’enfant et de l’adolescent à Conakry
BD. Diallo1, MH. Camara2, OH. Diallo2, A. Camara2, AO. Barry2 , TH. Diallo1, LM. Camara1, OY. Sow1
1 : Faculté des Sciences et Techniques de la Santé. Université Gamal Abdel Nasser de Conakry
2 : Service de Pneumologie-Phtisiologie. CHU Ignace Deen Conakry Guinée
Corresponding author
Dr. DIALLO BOUBACAR Djelo
Faculté des Sciences et Techniques de la Santé. Université Gamal Abdel Nasser de Conakry
E-mail: diallodjelo@yahoo.fr
ABSTRACT
Introduction. The objective of this study was to report the experience of the three multidrug-resistant tuberculosis management centers in the city of Conakry in the management of multidrug-resistant tuberculosis cases in children and teens.
Methods. This was a retrospective study of the descriptive type over a period of 4 years, concerning all the records of children under 16 years of age followed for multidrug-resistant tuberculosis in the three sites of care of the city of Conakry.
Results. Ten files of children and adolescents under 16 years of age followed for multidrug-resistant tuberculosis; a female predominance with 7 girls for 3 boys and a ratio F/M of 2.3 was noted with an average age of 13 years, extremes of 8 months and 15 years. Two patients had family contact with a multidrug-resistant patient and 9 out of 10 patients had a history of antituberculous treatment including 5 cases of primary treatment failure and 4 cases of relapse. The diagnosis of multi-resistance was made for all patients using the Xpert MTB/RIF test, the results of sensitivity tests for other first-line anti-TB drugs confirmed the multi-resistance in the 10 patients. VIH serology was positive in 2 patients who were already on ARVs during multidrug resistance testing. Six patients were treated with the 24-month long regime (6km-Lfx-Cs-PtoZ/18 Lfx-Cs-Pto-Z) and 4 patients with the 9-month short regime (4km-Mfx-Cfz-Pto -ZHE/5 Mfx-Cfz-Z-E). At the end of the study, there was a therapeutic success in 6 patients 2 noted deaths and 2 patients were under treatment.
Conclusion. Multidrug-resistant tuberculosis remains serious in children; better screening of pediatric contacts of MDR-TB patients and strengthening of first-line treatment could reduce the impact of this disease in children and adolescents.
KEYWORDS: Tuberculosis; Multidrug-resistant; Conakry.
RÉSUMÉ
Introduction. L’objectif de cette étude était de rapporter l’expérience des trois centres de prise en charge de la Tuberculose multi résistante de la ville de Conakry dans la gestion des cas de tuberculose multi-résistante chez les enfants et adolescents.
Méthodes. Il s’agissait d’une étude rétrospective de type descriptif sur une période de 4ans, concernant tous les dossiers des enfants âgés de moins de 16ans suivis pour une tuberculose multi-résistante dans les trois sites de prise en charge de la ville de Conakry.
Résultats. 10 dossiers d’enfants et adolescents âgés de moins de 16 ans suivis pour tuberculose multi-résistante; une prédominance féminine avec 7 filles pour 3 garçons et un ratio F/H de 2,3 a été notée avec un âge moyen de 13ans, des extrêmes de 8 mois et de 15 ans. Deux patients avaient un contact familial avec un malade multi-résistant et 9 patients sur 10 avaient un antécédent de traitement antituberculeux dont 5 cas d’échec du primo traitement et 4 cas de rechute. Le diagnostic de la multi-résistance a été fait pour l’ensemble des patients au moyen du test Xpert MTB/RIF, les résultats des tests de sensibilité aux autres antituberculeux de première ligne avaient confirmé la multi-résistance chez les 10 malades. La sérologie VIH était positive chez 2 patients qui étaient déjà sous ARV au cours du dépistage de la multirésistance. Six patients ont été traités avec le régime long de 24 mois (6km-Lfx-Cs-Pto-Z/18 Lfx-Cs-Pto-Z) et 4 patients avec le régime court de 9 mois (4km-Mfx-Cfz-Pto-Z-H-E/5 Mfx-Cfz-Z- E). A la fin de l’étude, on notait un succès thérapeutique chez 6 patients 2 décès notés et 2 patients étaient sous traitement.
Conclusion. La tuberculose multi-résistante demeure grave chez l’enfant, un meilleur dépistage des contacts pédiatriques des patients TB-MR et le renforcement du traitement de première ligne pourraient réduire l'impact de cette maladie chez les enfants et adolescents.
MOTS CLÉS: Tuberculose; Multimédicament-résistant; Conakry.
INTRODUCTION
La tuberculose multi-résistante (TB-MR) représente une menace majeure pour la lutte contre la tuberculose à l'échelle mondiale. La TB-MR est définie comme une maladie causée par une souche de Mycobacterium tuberculosis résistant au moins à l’isoniazide et à la rifampicine, les deux médicaments antituberculeux les plus puissants. Comme toutes formes de tuberculose, la TB-MR peut affecter les gens de toutes tranches d'âge, y compris les enfants de moins de 15 ans [1]. Cependant elle demeure grave chez l’enfant du fait de la difficulté du contrôle de la maladie et de l’absence de l’adaptation thérapeutique en pédiatrie [2].
A l'échelle mondiale, la plupart des cas de TB-MR restent non détectés et non traités à cause de la capacité limitée des laboratoires pour conduire des tests sur la résistance médicamenteuse et l'accès limité au traitement de la deuxième ligne, qui est très long (20 mois recommandé pour la plupart des cas selon les directives de l’OMS) toxique et couteux [1].
Parmi les 12 millions cas de tuberculose répandus dans le monde évalué par l'Organisation Mondiale de la Santé (OMS) en 2011, 630000 (5.3 %) avait la TB -MR(1). Les enfants âgés de moins de 15 ans représentent à eux seuls 15 à 20 % des cas dans les pays où l’incidence est très élevée [1]. Deux millions d'enfants ont été infectés par un Mycobacterium tuberculosis et 25 000 enfants ont développé la tuberculose multi-résistante (TB-MR) en 2014 [3].
Le traitement de la TB-MR est difficile, nécessitant l'utilisation de médicaments de deuxième intention dans des schémas thérapeutiques beaucoup plus longs que dans le cas des maladies sensibles aux médicaments. Ces régimes sont souvent difficiles à tolérer, en particulier chez les enfants, en raison de la durée du traitement, de la toxicité médicamenteuse et du manque de formulations adaptées aux enfants [4].
La proportion des enfants tuberculeux dans les pays ayant une faible incidence, comme la France, est d’environ 5 % [5].
Le diagnostic de TB-MR est bactériologique par définition, basé sur l'isolement de souches résistantes aux médicaments. Bien que l'isolement de M. tuberculosis chez les adultes atteints de tuberculose pulmonaire soit généralement une procédure facile (à l'exception des patients qui sont très immunodéprimés), les enfants ont principalement un déficit paucibacillaire ce qui signifie que les spécimens pour la culture et le test de sensibilité de médicament sont souvent difficiles à obtenir, particulièrement chez le plus jeune qui ne peut pas expectorer le crachat [1]. Dans la plupart des cas, les adultes représentent la source d'infection chez les enfants mais les enquêtes de contact dans les ménages sont rarement effectuées dans le cadre de la routine des activités de surveillance dans les pays à ressources limitées, où la prévalence de la tuberculose est élevée et tendent à confiner à des projets de recherche spéciaux. Par conséquent, les résultats de test de sensibilité de médicament des cas sources adultes ne sont pas systématiquement utilisés pour étudier la résistance médicamenteuse chez les enfants [1]. Le traitement utilise les mêmes principes et les mêmes molécules que chez les adultes [6].
Un programme de Prise en charge des patients TBMR existe en Guinée depuis 2006, et la situation épidémiologique évolue, dans ce contexte il nous a paru utile de faire le point sur la prise en charge des formes pédiatriques de tuberculose multi-résistante dans la ville de Conakry.
L’objectif de cette étude est de rapporter l’expérience des trois centres de PEC TB-MR de la ville de Conakry dans la gestion des cas de tuberculose multirésistante chez les enfants et les adolescents.
MÉTHODES
Les trois sites de PEC TB-MR de la ville de Conakry (Service de PPH Hôpital National Ignace Deen, le Centre Anti-tuberculeux de la Carrière et le Centre de Santé de. Conakry).
Il s’agissait d’une étude rétrospective de type descriptif allant de 1 Janvier 2012 au 31 décembre 2016. Ont été inclus dans l’étude tous les enfants de moins de 15ans diagnostiqués pour une tuberculose multirésistante indépendamment du sexe, les dossiers incomplets ont été exclus.
Techniques de collecte des données
Identification des cas de tuberculose multi-résistante chez les enfants et adolescents de moins de 18 ans dans les registres de traitement de la TB-MR des trois sites de prise en charge. Recueil des informations sociodémographiques, des informations sur les antécédents thérapeutiques, les données bactériologiques et l’issue du traitement. Dans le dossier médical du patient, nous avons recueilli les informations cliniques, les données sur les effets secondaires. Au LNR, nous avons complété les données bactériologiques qui manquaient dans les registres de traitement et dans les dossiers médicaux.
Les variables de l’étude ont été regroupées en:
• Variables sociodémographiques des patients.
• Variables cliniques.
• Variables paracliniques.
• Variables thérapeutiques.
Analyse des données
Les données collectées sur les fiches d’enquête ont été saisies dans le logiciel EPI Info 7. Nous avons procédés après cette étape à une vérification de la qualité des données et à des corrections si nécessaires. La base de données ainsi constituée a été analysé.
La saisie, et la présentation des données se sont effectuées à l’aide des logiciels du pack office 2013 (Word, Excel, Powerpoint).
Considérations éthiques
La confidentialité a été observée tout au long de cette étude, l'identification des patients s’est basée sur le numéro d'enregistrement TB-MR.
RÉSULTATS
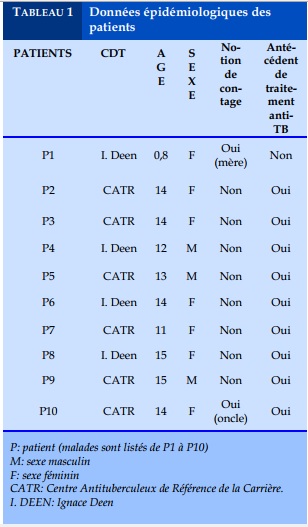
Le diagnostic de la multi-résistance a été fait pour l’ensemble des patients au moyen du test Xpert MTB/RIF, les résultats des tests de sensibilité aux autres antituberculeux de première ligne n’étaient disponibles que pour deux malades. Neuf malades sur dix avaient antérieurement pris des antituberculeux de première ligne soit: 5 cas d’échecs du primo traitement, 4 cas de rechute et un nouveau cas.
Le suivi bactériologique (examen de microscopie et culture) était mensuel dans le schéma court de traitement et trimestriel pour la phase de continuation du schéma long de traitement de la tuberculose multirésistante.
DISCUSSION
Nous avons effectué une étude rétrospective de type descriptif allant du 1er janvier 2013 au 31décembre 2017 au cours de quelle avons colligé 10 dossiers d’enfants et d’adolescents âgés de moins de 15 ans suivis dans les trois sites de prise en charge TB-MR de la ville de Conakry. La majorité (90%) avait un âge compris entre 11 et 15 ans avec des extrêmes de 8 mois et 14 ans. Des résultats rapportés par Jyoti Arora et Coll en 2016 [7] dans une étude faite à Delhi en Inde qui montraient un âge moyen des de 13 ans.
Dans notre étude nous avons observé une prédominance féminine 7/10 avec un sexe ratio de 0,42. Concernant les antécédents, seulement un patient avait une notion de contage établit chez sa mère qui est décédée de tuberculose multi-résistante, il s’agissait de la plus jeune des patients, âgée seulement de 8mois à au moment du diagnostic, la difficulté de prise en charge de ce cas était surtout liée aux conditions d’administration des médicaments et à la réalisation des examens de suivi.
Dans 9 cas sur 10 les patients avaient des antécédents de traitement antituberculeux, les mêmes constats sont rapportés par de nombreux auteurs dont
Concernant la sérologie VIH, les patients P4 et P6 étaient positifs au VIH et étaient déjà sous ARV au moins du diagnostic de la tuberculose multirésistante. Ces résultats sont compatibles avec ceux de Jyoti Arora et Coll [7] en 2016 A.S. Bakayoko et Coll [2] en Côte d’Ivoire.
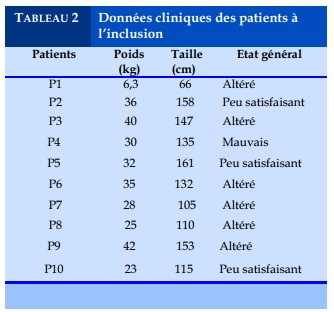
Deux des patients avaient un contact établi avec un malade TB-MR, le patient E1 dont la mère est décédée de tuberculose multi-résistante et le patient E10. De point de vue clinique, les patients étaient tous symptomatiques avec un état général altéré dans la majorité des cas à l’inclusion au traitement. Les symptômes retrouvés étaient ceux habituellement retrouvés dans la tuberculose classique.
Polina A. Smirnova et al au Nord-Ouest de la Russie en 2016 [8] ont trouvé que plus de la moitié des enfants étaient asymptomatiques avec seulement des manifestations radiologiques au diagnostic. Cette différence pourrait être en rapport avec les retards dans le diagnostic souvent rencontrés dans le contexte Guinéen.
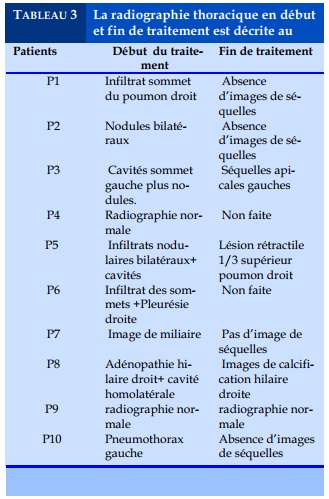
La radiographie pulmonaire était réalisée chez tous nos malades en début de traitement, avec dans deux cas des radiographies strictement normales. Concernant le profil de la résistance, tous nos patients avaient bénéficié du test Xpert MTB/RIF, ce test avait détecté la présence du Mycobactérium tuberculosis et une résistance à la Rifampicine chez tous nos patient. Les tests de sensibilité aux autres antituberculeux de première ligne n’étaient disponibles que pour deux patients, ceci s’explique par le fait que pour une longue période le LNRM de Conakry ne faisait pas de tests de sensibilité aux antituberculeux à cause des problèmes de biosécurité Nos résultats sont différents de ceux rapportés par Dans l’étude rapportée par Ning Ning Tao et col en Chine [8], les tests de sensibilité étaient réalisés chez l’ensemble des malades.
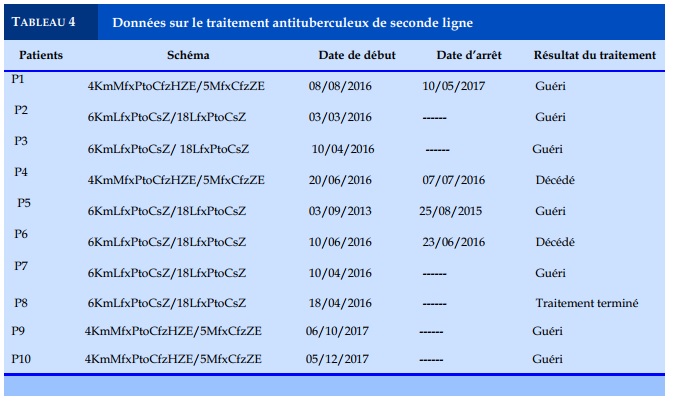
La majorité (7/10) de nos patients ont bénéficié d’un traitement antituberculeux de seconde ligne selon le schéma long TB-MR à savoir 6 mois de (Km- Lfx- Pto- Cs- Z) et 18 mois de (Lfx- Pto- Cs-Z). Et les trois autres patients ont reçu le traitement selon le protocole de 9 mois: 4 (Km-Mfx-Pto-Cfz-H-Z-E)/5 mois (Mfx-Cfz-Z-E) conformément aux directives nationales et de l’OMS. Les résultats du traitement ont été définis conformément les suivants: 7 patients guéris, un patient ayant terminé son traitement deux patients décédés,. Les deux patients décédés (E4 et E6) sont ceux infectés par le VIH, l’immunodépression pourrait en être la cause du décès. Les définitions opérationnelles ci-dessus (décès, guérison, traitement terminé) sont tirées des directives de l’OMS [10,11].
CONCLUSION
La tuberculose multi-résistante demeure grave chez l’enfant, un meilleur dépistage des contacts pédiatriques des patients TB-MR et le renforcement du traitement de première ligne pourraient réduire l'impact de cette maladie chez les enfants et adolescents.
CONFLICT OF INTERESTS
Non.
REFERENCES
1. Matteo Zignol, Charalambos Sismanidis, Dennis Falzon, Philippe Glaziou, Masoud Dara and Katherine Floyd. Multidrug-resistant tuberculosis in children: Eur Respir J. 2013 Sep;42(3):701-7.
2. A.S. Bakayoko-Yeo-Tenena, K. Samake, Z. Kone, A.T. Daix , G. Coulibaly , V. Schwoebel, A.O. Kouakou, J. Kouakou, K.M. Domoua. Tuberculose multirésistante de l’enfant et l’adolescent en Côte d’Ivoire. Rev Mal Resp Volume 34, Supplement, January 2017, 221-A222
3. H. Simon Schaaf. Update on multidrug-resistant tuberculosis in children.
4. Int J Mycobacteriol. 2016 Dec ; 5 Suppl 1.
5. Harausz EP, Garcia-Prats AJ, Law S Treatment and outcomes in children with multidrug-resistant tuberculosis: A systematic review and individual patient data meta-analysis PLoS Med. 2018 Jul 11;15(7).
6. F.Tritar, H. Daghfous, S. Ben Saad, L. Slim-Saidi. Prise en charge de la tuberculose multirésistante. Revue de Pneumologie Clin 2014 (2-7) P.
7. World Health Organization THIS WHO treatment. Guidelines for drug-resistant tuberculosis 2016 www.who.int/tb/areas-of-work/drug-resistant-tb/ treatment/resources/
8. Jyoti Arora, Ritu Singhal, Manpreet Bhalla, Ajoy Verma, Niti Singh, Digamber Behera, Rohit Sarin, Vithal Prasad Myneedu. Drug resistance detection and mutation patterns of multidrug resistant tuberculosis strains from children in Delhi. Journal of EpidemiologyandGlobal Health 2017 (1-3). http:// dx.doi.org/10.1016/j.jegh.2016.12.003.
9. Polina A. Smirnova, Anna Turkova, Elena I. Nikishova, James A. Seddon, Elizabeth Chappell, Olga A. Zolotaya, Oxana M. Mironuk, Andrey O. Maryandyshev Multidrug-resistant tuberculosis in children in northwest Russia: an observational cohort study, European Respiratory Journal 2016 48: 14961499.
10. Ning-ning Tao, Xiao-chun He, Xian-xin Zhang, Yao Liu, Chun-bao Yu, Huai-chen Li Drug-Resistant Tuberculosis among Children, China, 2006–2015. Emerg Infect Dis. 2017 Nov; 23(11): 1800–1805.
11. Organisation mondiale de la Santé. Définitions et cadre de notification pour la tuberculose. Révision 2013 (mise à jour de décembre 2014) http:// a p p s . w h o . i n t / i r i s / bitstream/10665/110724/1/9789242505344_fre.pdf
TABLES
REFERENCES
1. Matteo Zignol, Charalambos Sismanidis, Dennis Falzon, Philippe Glaziou, Masoud Dara and Katherine Floyd. Multidrug-resistant tuberculosis in children: Eur Respir J. 2013 Sep;42(3):701-7.
2. A.S. Bakayoko-Yeo-Tenena, K. Samake, Z. Kone, A.T. Daix , G. Coulibaly , V. Schwoebel, A.O. Kouakou, J. Kouakou, K.M. Domoua. Tuberculose multirésistante de l’enfant et l’adolescent en Côte d’Ivoire. Rev Mal Resp Volume 34, Supplement, January 2017, 221-A222
3. H. Simon Schaaf. Update on multidrug-resistant tuberculosis in children.
4. Int J Mycobacteriol. 2016 Dec ; 5 Suppl 1.
5. Harausz EP, Garcia-Prats AJ, Law S Treatment and outcomes in children with multidrug-resistant tuberculosis: A systematic review and individual patient data meta-analysis PLoS Med. 2018 Jul 11;15(7).
6. F.Tritar, H. Daghfous, S. Ben Saad, L. Slim-Saidi. Prise en charge de la tuberculose multirésistante. Revue de Pneumologie Clin 2014 (2-7) P.
7. World Health Organization THIS WHO treatment. Guidelines for drug-resistant tuberculosis 2016 www.who.int/tb/areas-of-work/drug-resistant-tb/ treatment/resources/
8. Jyoti Arora, Ritu Singhal, Manpreet Bhalla, Ajoy Verma, Niti Singh, Digamber Behera, Rohit Sarin, Vithal Prasad Myneedu. Drug resistance detection and mutation patterns of multidrug resistant tuberculosis strains from children in Delhi. Journal of EpidemiologyandGlobal Health 2017 (1-3). http:// dx.doi.org/10.1016/j.jegh.2016.12.003.
9. Polina A. Smirnova, Anna Turkova, Elena I. Nikishova, James A. Seddon, Elizabeth Chappell, Olga A. Zolotaya, Oxana M. Mironuk, Andrey O. Maryandyshev Multidrug-resistant tuberculosis in children in northwest Russia: an observational cohort study, European Respiratory Journal 2016 48: 14961499.
10. Ning-ning Tao, Xiao-chun He, Xian-xin Zhang, Yao Liu, Chun-bao Yu, Huai-chen Li Drug-Resistant Tuberculosis among Children, China, 2006–2015. Emerg Infect Dis. 2017 Nov; 23(11): 1800–1805.
11. Organisation mondiale de la Santé. Définitions et cadre de notification pour la tuberculose. Révision 2013 (mise à jour de décembre 2014) http:// a p p s . w h o . i n t / i r i s / bitstream/10665/110724/1/9789242505344_fre.pdf
ARTICLE INFO
DOI: 10.12699/jfvpulm.10.30.2019.23
Conflict of Interest
Non
Date of manuscript receiving
07/02/2019
Date of publication after correction
15/3/2019
Article citation
Diallo BD, Camara MH, Diallo OH, Camara A, Barry AO , Diallo TH, Camara LM, Sow OY. Multidrug-resistant tuberculosis of children and adolescents in Conakry. J Func Vent Pulm 2019;30(10):23-27.