
 English
English
 French
French
Management of chylothorax in children in Madagascar
Prise en charge des chylothorax de l’enfant à Madagascar
F. Randrianambinina1, H. Randrianambinina, NNM. Razafimanjato1, M. Ravoatrarilandy1, HJL. Rakotovao1
1: Service de Chirurgie Thoracique du CHU Joseph Ravoahangy Andrianavalona (CHU-JRA) Antananarivo Madagascar. BP 4150
2: Service des Urgences du CHU Anosiala Ambohidratrimo 103
Corresponding author
Dr. RANDRIANAMBININA Fanomezantsoa
Service de Chirurgie Thoracique du CHU Joseph Ravoahangy Andrianavalona (CHU-JRA) Antananarivo Madagascar. BP 4150
E-mail: fanomez_r@yahoo.fr
Introduction. Chylothorax is a presence of chyle in the pleural cavity. The objective of our study is to describe the epidemiological, clinical and therapeutic aspects of chylothorax in children encountered in our department in order to improve their management.
Method. This was a retrospective study of children and infants with chylothorax hospitalized in our Thoracic Surgery department over a 10-year period from May 2009 to May 2019. Many parameters were analyzed.
Results. We had collected 17 cases of chylothorax in children during our study period, including 10 (58.82%) boys and 07 (41.18%) girls. The median age was 03 years and the etiology was dominated by congenital lymphatic malformation in 47.06% of cases followed by tuberculosis infection in 23.53% of cases. All patients (100% of cases) were treated with percutaneous chest drainage associated with a fat-free diet and 10 patients (58.82% of cases) had had surgery.
Conclusion. The diagnosis of chylothorax is confirmed by biochemical examination of pleural fluid. The etiology in children is mainly dominated by a congenital lymphatic malformation thus requiring specific imaging such as lymphangiography and lymphoscintigraphy in order to study the lymphatic system but these examinations do not yet exist in us making it difficult to take charge patients.
KEYWORDS: Chylothorax; Thoracic drainage; Lymphangiography; Medium chain triglycerides.
Introduction. Le chylothorax est une présence de chyle dans la cavité pleurale. L’objectif de notre étude est de décrire les aspects épidémiologiques, cliniques et thérapeutiques des chylothorax de l’enfant rencontrés dans notre service afin d’améliorer leur prise en charge.
Méthode. Il s’agissait d’une étude rétrospective des enfants et nourrissons présentant un chylothorax, hospitalisés dans notre service de Chirurgie thoracique sur une période de 10 ans allant du mois de Mai 2009 au Mai 2019. Nombreux paramètres étaient analysés.
Résultats. Nous avions colligé 17 cas de chylothorax de l’enfant durant notre période d’étude dont 10 (58,82%) garçons et 07 (41,18%) filles. L’âge médian était de 03 ans et l’étiologie était dominée par la malformation lymphatique congénitale dans 47,06% des cas suivie de l’infection tuberculeuse dans 23,53% des cas. Tous les patients (100% des cas) étaient traités par un drainage thoracique percutané associé à un régime alimentaire sans graisse et 10 patients (58,82% des cas) avaient eu une intervention chirurgicale.
Conclusion. Le diagnostic du chylothorax est confirmé par l’examen biochimique du liquide pleural. L’étiologie chez l’enfant est surtout dominée par une malformation lymphatique congénitale nécessitant ainsi les imageries spécifiques telles que la lymphangiographie et la lymphoscintigraphie afin d’étudier le système lymphatique mais ces examens n’existent pas encore chez nous rendant difficile la prise en charge des patients.
MOTS CLÉS: Chylothorax; Drainage thoracique; Lymphangiographie; Triglycérides à chaîne moyenne.
INTRODUCTION
Le chylothorax est caractérisé par la présence d’un chyle dans la cavité pleurale. Le diagnostic est donné par l’aspect laiteux du liquide pleural associé à l’élévation du taux de triglycéride supérieur à 110 mg/dL et l’existence de chylomicrons dans ce liquide pleural [1]. Il existe plusieurs causes de chylothorax telles que l’origine tumorale, traumatique, chirurgicale comme la chirurgie de l’œsophage et les curages ganglionnaires médiastinaux [2] mais chez l’enfant, le chylothorax est le plus souvent classé d’origine idiopathique ou congénital qui est souvent dû à une malformation congénitale lymphatique [3].
MÉTHODE
Le but de notre étude est de décrire les aspects épidémiologiques, cliniques et thérapeutiques des chylothorax de l’enfant rencontrés dans notre service afin d’améliorer leur prise en charge. Il s’agissait d’une étude rétrospective des enfants et nourrissons présentant un chylothorax, hospitalisés dans notre service de Chirurgie thoracique sur une période de 10 ans allant du mois de Mai 2009 au Mai 2019. Nous avions exclus les patients perdus de vue après sortie de l’hôpital et ceux qui sont sorties sans diagnostic avec signature de décharge. Nombreux paramètres avaient été analysés tels que: la prévalence, l’âge, le genre, les étiologies, les manifestations cliniques, les examens para cliniques ainsi que le traitement. L’analyse statistique était traitée par l’Excel 2013. Cette étude avait comme limite sa réalisation mono centrique qui ne reflète pas la population de la capitale.
RESULTATS
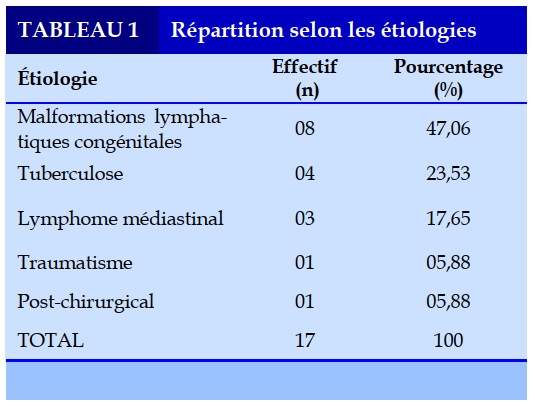
Nous avions colligé 17 cas de chylothorax de l’enfant durant notre période d’étude dont 10 (58,82%) garçons et 7 (41,18%) filles. L’âge médian était de 03 ans allant de 02 mois à 12 ans, avec un pic de fréquence dans la tranche d’âge de 0 à 5 ans. L’étiologie était dominée par la malformation lymphatique congénitale dans 47,06% des cas suivi de l’infection tuberculeuse dans 23,53% des cas (Tableau 1).
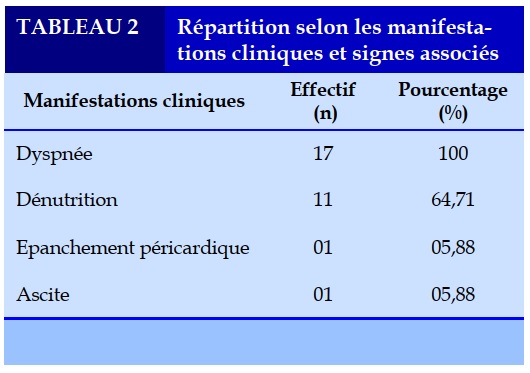
Il s’agissait d’un chylothorax bilatéral dans 52,94% (n=9) (Figure 1), un chylothorax gauche dans 29,41% (n=5), et un chylothorax droit dans 17,65% (n=3). Les manifestations cliniques étaient dominées par la dyspnée (100% des cas) et la dénutrition (64,71% des cas) (Tableau 2). Tous les patients (100% des cas) avaient bénéficié d’une radiographie thoracique et seulement 4 patients (23,53%) avaient pu avoir un scanner thoracique. Aucun patient n’avait eu une IRM thoracique. Tous les patients (100% des cas) avaient un examen biochimique et cytologique du liquide pleural ayant permis de confirmer la nature chyleuse de l’épanchement pleural.
Tous les patients (100% des cas) étaient traités par un drainage thoracique percutané associé à un régime alimentaire sans graisse et un apport protidique par des supplémentations entérales. Cependant, une intervention chirurgicale était indiquée chez 10 patients (58,82% des cas) dont une ligature du canal thoracique par thoracotomie postéro-latérale chez 6 patients (60% des cas) (Figure 2), une pleurodèse par talcage pleural chirurgical chez 2 patients (20% des cas), une ligature du tronc lymphatique abdominal chez un enfant (10% des cas) et une dérivation pleuro-péritonéale avec fenêtre péricardique pleural chez un enfant qui a eu une cause tuberculeuse avec épanchement péricardique associé (10% des cas). Ces indications chirurgicales avaient été posées au bout de 15 jours de drainage thoracique sans amélioration de la quantité du liquide ramené par le drain.
DISCUSSION
Le chylothorax de l’enfant peut être congénital ou acquis mais l’origine congénitale est la plus rencontrée avec une prévalence de 1/15000 nouveaux nés (4).
Nous avions eu une prédominance masculine dans notre étude qui correspond au résultat retrouvé dans l’étude de Hermon et coll avec 19 garçons et 15 filles et celui de Densupsoontorn et coll (7 garçons et 2 filles) [5, 6]. D’autres études avaient retrouvées une prédominance féminine [7, 8]. Mais nous n’avions retrouvé aucune explication pour cette prédominance masculine ou féminine dans la littérature.
Dans la description de Jean Sabatier, les étiologies des chylothorax peuvent être divisées en quatre groupes principaux:
Cependant dans notre étude, après les malformations lymphatiques congénitales, la tuberculose constitue une des causes principales du chylothorax chez nos patients (23,53% des cas) alors qu’elle figure parmi les causes rares dans la littérature. Ceci s’explique par l’endémicité tuberculeuse dans notre pays.
Le diagnostic est donné par la présence d’un épanchement pleural laiteux et sans odeur [10, 11]. Il est confirmé par l’examen biochimique du liquide pleural qui montre un taux de triglycéride >110 mg/dL et le rapport entre taux de cholestérol dans le liquide pleural et la cholestérolémie <1; le taux de protéine est entre 2 et 3 mg/dl et le taux du LDH est très bas [10].
Mais quand le diagnostic est douteux, la méthode la plus utilisée est la recherche de chylomicron dans le liquide pleural qui est devenu positif [10]. Habituellement, la cytologie du chylothorax révèle une prédominance lymphocytaire >50% [10].
Pour l’imagerie, la radiographie standard permet de mettre en évidence l’épanchement pleural, son abondance et la présence d’un syndrome interstitiel réticulé ou nodulaire évoquant une lymphangiectasie pulmonaire diffuse [12]; le scanner et l’IRM aident à l’investigation mais les examens spécifiques permettant d’évaluer le système lymphatique sont représentés par la lymphangiographie et la lymphoscintigraphie [13]. On n’a pas accès à ces examens spécifiques à Madagascar et le scanner ainsi que l’IRM sont très coûteux.
Ainsi, la majorité de nos patients ne peut pas en bénéficier à cause de faible moyen financier, rendant ainsi difficile d’étudier le système lymphatique de nos patients. Actuellement, pour les formes congénitales, le diagnostic anténatal est possible dans les pays développés permettant une prise en charge précoce du nourrisson. Dans la littérature, l’âge gestationnel de diagnostic anténatal est de 30 à 33 semaines d’aménorrhées [14, 15, 16].
Dans notre étude, le chylothorax bilatéral dominait dans 52,94% des cas. Ceci s’explique par la prédominance de causes malformatives du chylothorax chez nos patients. Ce résultat correspond à celui retrouvé dans l’étude de Bellini et coll. avec prédominance d’atteinte bilatérale dans 66,6% des cas [8].
Concernant le traitement, il doit être conservateur et la place de la chirurgie se met en dernier recours. Le drainage thoracique percutané constitue le traitement le plus recommandé associé à une suspension de l’alimentation riche en graisse mais remplacée par un régime riche en triglycérides à chaîne moyenne (TCM) qui sont directement absorbés par le système porte sans formation de chylomicrons permettant de diminuer le flux de lymphe dans le canal thoracique [9]. On y associe l’utilisation de diurétiques avec compensation des pertes et la perfusion d’albumine ainsi que le repos digestif et la nutrition parentérale totale avec apport en protéines de 3 à 4 g/kg/j, en glucides de 16 à 18 g/kg/j et en lipides de 2 g/kg/j [17]. L’échec du traitement conventionnel doit conduire à l’administration intraveineuse ou sous-cutanée de somatostatine ou de son analogue synthétique (Octréotide) à dose initiale de 1μg/kg/heure et à augmenter progressivement jusqu’à une dose maximale de 10μg/kg/heure [7, 8, 18]. L’Octréotide est un peptide qui réduit les sécrétions digestives, la pression veineuse intra hépatique et le débit sanguin splanchnique [18]. Chez nous à Madagascar, le traitement conservateur est limité à un arrêt d’alimentation riche en graisse. L’albumine en perfusion coûte très chère et nous n’avons pas de somatostatine non plus entraînant ainsi une persistance de fuite chyleuse pleurale et l’augmentation de l’indication chirurgicale invasive (58,82%).
Dans la littérature, la chirurgie est indiquée s’il y a persistance de chylothorax après 2 à 4 semaines de drainage thoracique associé à un traitement médical et diététique [19]. Il existe plusieurs types de chirurgies dans le traitement de chylothorax tels que une ligature du canal thoracique par thoracoscopie, une pleurodèse chimique par polyvidone iodée ou bléomycine ou minocycline ou talcage pleural et une dérivation pleuro-péritonéale [10,19, 20]. Le traitement étiologique doit être instauré pour éviter une récidive de chylothorax.
CONCLUSION
Le chylothorax est assez rare chez l’enfant et les étiologies sont dominées par les malformations congénitales lymphatiques et la tuberculose à Madagascar. Le diagnostic est confirmé par l’examen biochimique du liquide pleural. Les imageries spécifiques permettant d’étudier le système lymphatique telles que la lymphangiographie et la lymphoscintigraphie n’existent pas encore chez nous entraînant une difficulté de prise en charge diagnostique et thérapeutique de cette pathologie.
Le traitement médical conservateur est limité également ce qui favorise une augmentation d’indication chirurgicale avec une lourde morbidité et mortalité post-opératoire chez ces enfants qui sont dénutris dans la majorité des cas. Ainsi, il faut avoir plusieurs changements du système de santé à Madagascar à tous les niveaux dès le moyen diagnostique jusqu’au moyen thérapeutique afin d’atteindre une prise en charge adéquate du chylothorax chez l’enfant pour obtenir un meilleur résultat.
CONFLIT D’INTÉRÊT
Aucun.
RÉFERENCES
1. Biewer ES, Zürn C, Arnold R, Glöckler M, SchulteMönting J, Schlensak C, Dittrich S. Chylothorax after surgery on congenital heart disease in newborns and infants – risk factors and efficacy of MCT-diet. Journal of Cardiothoracic Surgery 2010, 5:127.
2. Sziklavari Z, Allgäuer M, Hübner G, Neu R, Ried M, Grosser C, Szöke T, Schemm R and Hofmann HS. Radiotherapy in the treatment of postoperative chylothorax. Journal of Cardiothoracic Surgery 2013; 8:72.
3. Perisson C, Nathan N, Larroquet M, Corvol H. An idiopathic congenital chylothorax: surgery or conservative management? BMJ Case Rep 2014. doi:10.1136/bcr-2014-204147.
4. Hmami F, Oulmaati A, Bouchikhi C, Banani A, Bouharrou A. Chylothorax congénital: une réponse rapide et Totale à la polyvidone iodée, Archives de Pé- diatrie 2014 ; 21:1002-5.
5. Hermon M, Tenner E, Burda G, Strohmaier W, Schlager G and Golej J. Chylothorax and Chylous-Like Diseases in Children: Clinical Management. Front. Pediatr. 2019; 7:258. doi: 10.3389/fped.2019.00258.
6. Densupsoontorn N, Jirapinyo P, Tirapongporn H, Wongarn R, Chotipanang K, Phuangphan P and
Chongviriyaphan N. Fat-soluble vitamins and plasma and erythrocyte membrane fatty acids in chylothorax pediatric patients receiving a medium chain triglyceride-rich diet. J. Clin. Biochem. Nutr. 2014; 3(55): 174–7.
7. Downie L, Sasi A, Malhotra A. Congenital chylothorax: associations and neonatal outcomes. J. Paediatr. Child Health. 2014 ; 50: 234–8.
8. Bellini C, Ergaz Z, Radicioni M, et al. Congenital fetal and neonatal visceral chylous effusions: neonatal chylothorax and chylous ascites revisited. A multicenterretrospectivestudy. Lymphology 2012; 45: 91–102 .
9. Sabatier J. Chylothorax : étiologie et traitement. Act. Méd. Int. - Angiologie 1998 ; 245(14) : 4913-5.
10. Rodrigues ALL, Romaneli MTN, Ramos CD, Fraga AMA, Pereira RM, Appenzeller S, Marini R, Tresoldi AT. Bilateral spontaneous chylothorax after severe vomiting in children. Rev Paul Pediatr. 2016; 34(4): 518-21.
11. Skouras V, Kalomenidis I. Chylothorax: diagnostic approach.Curr Opin Pulm Med. 2010 ; 16: 387-93.
12. Nouri-Merchaoui S, Mahdhaoui N, Yacoubi MT, et al. Lymphangiectasies pulmonaires congénitales : une cause rare de détresse respiratoire néonatale. Arch Pediatr 2012 ; 19: 408–12.
13. Tutor JD. Chylothorax in infants and children. Pediatrics. 2014 ; 133: 722-33.
14. Resch B. Division of Neonatology, Paediatric Dept, Medical University of Graz, Auenbruggerplatz, Graz, Austria 2010 ; 2(34) A-8036.
15. Downie L, Sasi A, Malhotra A. Congenital chylothorax: associations and neonatal outcomes. J Paediatr Child Health 2014 ; 50: 234–8.
16. Bellini C, Ergaz Z, Radicioni M, et al. Congenital fetal and neonatal visceral chylous effusions: neonatal chylothorax and chylous ascites revisited. A multicenterretrospectivestudy. Lymphology 2012 ; 45: 91–102.
17. Chemaou A, Ayachi M, Ailal F, et al. Chylothorax idiopathique chez un nourrisson. Prise en charge et évolution. Arch Pediatr 2012 ; 19: 711–3.
18. Horvers M, Mooij CF, Antonius TA. Is octreotide treatment useful in patients with congenital chylothorax? Neonatology 2012 ; 101: 225–31.
19. Tutor JD. Chylothorax in infants and children. Pediatrics. 2014 ; 133: 722-33.
20. McGrath EE, Blades Z, Anderson PB. Chylothorax: aetiology,diagnosis and therapeutic options. Respir Med. 2010 ; 104: 1-8.
FIGURES - TABLES


RÉFERENCES
1. Biewer ES, Zürn C, Arnold R, Glöckler M, SchulteMönting J, Schlensak C, Dittrich S. Chylothorax after surgery on congenital heart disease in newborns and infants – risk factors and efficacy of MCT-diet. Journal of Cardiothoracic Surgery 2010, 5:127.
2. Sziklavari Z, Allgäuer M, Hübner G, Neu R, Ried M, Grosser C, Szöke T, Schemm R and Hofmann HS. Radiotherapy in the treatment of postoperative chylothorax. Journal of Cardiothoracic Surgery 2013; 8:72.
3. Perisson C, Nathan N, Larroquet M, Corvol H. An idiopathic congenital chylothorax: surgery or conservative management? BMJ Case Rep 2014. doi:10.1136/bcr-2014-204147.
4. Hmami F, Oulmaati A, Bouchikhi C, Banani A, Bouharrou A. Chylothorax congénital: une réponse rapide et Totale à la polyvidone iodée, Archives de Pé- diatrie 2014 ; 21:1002-5.
5. Hermon M, Tenner E, Burda G, Strohmaier W, Schlager G and Golej J. Chylothorax and Chylous-Like Diseases in Children: Clinical Management. Front. Pediatr. 2019; 7:258. doi: 10.3389/fped.2019.00258.
6. Densupsoontorn N, Jirapinyo P, Tirapongporn H, Wongarn R, Chotipanang K, Phuangphan P and
Chongviriyaphan N. Fat-soluble vitamins and plasma and erythrocyte membrane fatty acids in chylothorax pediatric patients receiving a medium chain triglyceride-rich diet. J. Clin. Biochem. Nutr. 2014; 3(55): 174–7.
7. Downie L, Sasi A, Malhotra A. Congenital chylothorax: associations and neonatal outcomes. J. Paediatr. Child Health. 2014 ; 50: 234–8.
8. Bellini C, Ergaz Z, Radicioni M, et al. Congenital fetal and neonatal visceral chylous effusions: neonatal chylothorax and chylous ascites revisited. A multicenterretrospectivestudy. Lymphology 2012; 45: 91–102 .
9. Sabatier J. Chylothorax : étiologie et traitement. Act. Méd. Int. - Angiologie 1998 ; 245(14) : 4913-5.
10. Rodrigues ALL, Romaneli MTN, Ramos CD, Fraga AMA, Pereira RM, Appenzeller S, Marini R, Tresoldi AT. Bilateral spontaneous chylothorax after severe vomiting in children. Rev Paul Pediatr. 2016; 34(4): 518-21.
11. Skouras V, Kalomenidis I. Chylothorax: diagnostic approach.Curr Opin Pulm Med. 2010 ; 16: 387-93.
12. Nouri-Merchaoui S, Mahdhaoui N, Yacoubi MT, et al. Lymphangiectasies pulmonaires congénitales : une cause rare de détresse respiratoire néonatale. Arch Pediatr 2012 ; 19: 408–12.
13. Tutor JD. Chylothorax in infants and children. Pediatrics. 2014 ; 133: 722-33.
14. Resch B. Division of Neonatology, Paediatric Dept, Medical University of Graz, Auenbruggerplatz, Graz, Austria 2010 ; 2(34) A-8036.
15. Downie L, Sasi A, Malhotra A. Congenital chylothorax: associations and neonatal outcomes. J Paediatr Child Health 2014 ; 50: 234–8.
16. Bellini C, Ergaz Z, Radicioni M, et al. Congenital fetal and neonatal visceral chylous effusions: neonatal chylothorax and chylous ascites revisited. A multicenterretrospectivestudy. Lymphology 2012 ; 45: 91–102.
17. Chemaou A, Ayachi M, Ailal F, et al. Chylothorax idiopathique chez un nourrisson. Prise en charge et évolution. Arch Pediatr 2012 ; 19: 711–3.
18. Horvers M, Mooij CF, Antonius TA. Is octreotide treatment useful in patients with congenital chylothorax? Neonatology 2012 ; 101: 225–31.
19. Tutor JD. Chylothorax in infants and children. Pediatrics. 2014 ; 133: 722-33.
20. McGrath EE, Blades Z, Anderson PB. Chylothorax: aetiology,diagnosis and therapeutic options. Respir Med. 2010 ; 104: 1-8.