
 English
English
 French
French
Epidemiological, Clinical, Biological and Radioligical Profile of Acute Exacerbations of COPD Apropos of 101 Cases
Profil Epidemiologique, Clinique, Biologique Et Radioligique Des Exacerbations Aigue De La Bpco A Propos De 101 Cas
Yousfi, S. Guerrouj, A. Thouil, H. Kouismi
1: Service de Pneumologie ; CHU Mohammed VI Oujda
2: Faculté de Médecine et de Pharmacie Oujda
Corresponding author:
Yousfi Fatima Zahra. Service de Pneumologie. CHU Mohammed VI Oujda. Faculté de Médecine et de Pharmacie Oujda
E-mail: yousfifatimazahra112@gmail.com
ABSTRACT
Introduction. The acute exacerbation of COPD is a very frequent diagnostic and therapeutic emergency faced by the Pulmonologist. COPD is often underdiagnosed and revealed by acute exacerbations which can jeopardize the vital and functional prognosis of the chronic bronchitic patient.
Material and methods. This is a descriptive retrospective study, spread over a period of 4 years from 2017 to 2020, and conducted within the Pneumology department of CHU Mohammed VI of OUJDA.
Results. 101 cases of acute exacerbation of COPD were collected. The therapeutic management of exacerbations in our patients consisted of the administration of oxygen and nebulization of short-acting bronchodilators and anticholinergics in all patients, systemic corticosteroid therapy in 80% of patients, and antibiotic therapy 43%, The evolution was favorable in 77% of patients against 13 who died and 10% of patients towards IRC.
Conclusion. Exacerbations of COPD are frequent and responsible for a considerable burden on the community. Smoking cessation remains the best treatment to slow the decline of respiratory function and therefore the fight against smoking must be a priority of health policies.
KEYWORDS: COPD; Exacerbation; Pronostic; Respiratory failure.
RÉSUMÉ
Introduction. L’exacerbation aigue de BPCO est une urgence diagnostique et thérapeutique très fréquente à laquelle est confronté le Médecin Pneumologue. La BPCO est souvent sous-diagnostiquée r révélé par des exacerbations aigues qui peuvent mettre en jeu le pronostic vital et fonctionnel du patient bronchitique chronique.
Matériel et méthodes. Il s’agit d’une étude rétrospective descriptive, étalée sur une période de 4 ans allant de l’année 2017 à l’année 2020, et menée au sein du service de Pneumologie de CHU Mohammed VI d’OUJDA.
Résultats. 101 cas d’exacerbation aigue de BPCO ont été colligés. La prise en charge thérapeutique des exacerbations de nos patients, a consisté sur l’administration d’oxygène et d’une nébulisation des bronchodilatateurs de courte durée d’action et d’anticholinergique chez tous les patients une corticothérapie systémique chez 80% de patients, et une antibiothérapie 43%, L’évolution était favorable chez 77% des patients contre 13 qui sont décédés et 10% des patients vers IRC.
Conclusion. Les exacerbations de la BPCO sont fréquentes et responsable d’une charge considérable pour la collectivité. Le sevrage tabagique reste le meilleur traitement pour ralentir le déclin de la fonction respiratoire et donc la lutte contre le tabagisme doit être une priorité des politiques de santé.
MOTS CLÉS: BPCO; Exacerbation; Pronostic; Insuffisance respiratoire.
INTRODUCTION
La bronchopneumopathie chronique obstructive est une pathologie respiratoire chronique lentement progressive, caractérisée par une diminution non complètement réversible des débits aériens.
Cet état pathologique comprend la forme obstructive de la bronchite chronique et de l’emphysème. Elle constitue un problème de santé publique majeure à l’échelle mondiale et devrait être la 3ème cause de mortalité en 2030, sa prévalence au Maroc reste largement sous-estimée.
Le tabagisme constitue le premier facteur de risque de cette maladie, mais il existe d’autres facteurs de risque qui sont également incriminés notamment l’exposition professionnelle et la pollution.
L’exploration fonctionnelle respiratoire (EFR) permet de poser le diagnostic positif, d’évaluer la gravité de la bronchopneumopathie chronique obstructive et le suivi des sujets bronchitique chronique.
L’évolution de la maladie est marquée par des épisodes d’intensité variable appelés exacerbations.
L’exacerbation la bronchopneumopathie chronique obstructive se définit par la survenu d’une aggravation durable des symptômes respiratoires au-delà des variations habituelles et imposant une modification du traitement médicamenteux.
L’objectif de notre étude est de décrire les profils épidémiologiques, fonctionnels, étiologiques, thérapeutiques et évolutifs des patients hospitalisés pour exacerbations aigues de BPCO au sein du service de Pneumologie du CHU Mohamed VI - OUJDA.
MATERIELS ET METHODE
Type d’étude
Etude rétrospective, descriptive intéressant les patients hospitalisés et traités au sein du service de Pneumologie du CHU Mohamed VI d’ Oujda, durant une période de 4 ans allant de l’année 2017 à l’année 2020.
Population cible
Critères d’inclusions
Les patients inclus dans notre étude :
Connus porteurs d’une bronchopneumopathie chronique obstructive documentée par une exploration fonctionnelle respiratoire (Spirométrie)
Porteurs d’une BPCO probable devant les critères suivants : L’âge supérieur à 40 ans, patients tabagique ou anciens tabagique, signes cliniques de BPCO, avec ou sans facteurs de risque associés.
Critères d’exclusions
Patients porteurs d’une autre pathologie respiratoire chronique obstructive (Asthme et bronchectasie)
BPCO à l’état stable
Dossiers incomplets
Recueil des données
Le recueil des données était réalisé grâce à une fiche d’exploitation analysant les données épidémiologiques, cliniques, paracliniques, thérapeutiques et évolutives des patients. Le traitement des données recueillies et l’analyse statistique ont été réalisés grâce au logiciel « Excel 2010 ». L’étude était portée sur les patients hospitalisés au service de Pneumologie de CHU Mohammed VI d’Oujda.
Caractères épidémiologiques
Répartition selon le sexe
Parmi les patients hospitalisés, une prédominance masculine est relevée à 93% contre 7 % féminine. Avec un sex-ratio H /F à 13,2%.
FIGURE 1. Répartition des patients BPCO selon le sexe
Répartition selon l’âge
La moyenne d’âge des patients de notre série était de 64 ans (87-40ans). La tranche d’âge la plus représentée de notre série était 60-70 ans à 37% suivie par la tranche ≥ 70ans à 30 % puis la tranche d’âge entre 50-60 ans à 24 %. En dernière position, les 40-50 ans à seulement 8%.
FIGURE 2. Répartition des patients selon les tranches d’âg
Répartition selon les catégories professionnelles
FIGURE 3. Répartition des patients selon la catégorie professionnelle
37% des patients étudiés ne présentaient pas d’exposition professionnelle à risque et 63% de patients exerçaient une profession à risque : On note une prédominance pour les métiers d’agriculteur et de mineurs.
La répartition des professions était comme suit :
FIGURE 4. Répartition des patients BPCO exerçant une profession à risque selon leur profession
Exposition toxiques
Tabagisme
Dans notre étude, la consommation tabagique était retrouvée chez 98 patients soit 97%, seuls 3 patients n’avaient jamais fumé soit 3%
Le sevrage tabagique était noté chez 57% alors que 40% des patients tabagiques étaient non sevrés. La consommation moyenne était de 35P/A.
FIGURE 5. Répartition des patients selon l’exposition tabagique
Autres habitudes toxiques
32,6% de nos patients avaient l’habitude de consommer du cannabis, 42, 5% étaient éthyliques chronique.
Exposition professionnelle
L’exposition professionnelle était retrouvée dans 63% avec une prédominance notée pour une exposition à des particules organiques (poussières végétales, toxines bactériennes ou fongiques) et à la poussière de la mine (MINEURS).
Exposition domestique
L’exposition à la fumée de four était retrouvée chez les patients de sexe féminin chez 6 patientes soit 7% avec une durée moyenne de 25 ans.
Antécédents
L’étude des dossiers de nos patients à objectivé que 9.3% des patients avaient des antécédents chirurgicaux ; quant aux antécédents médicaux on retrouve : (TABLEAU 1)
Etat Basal BPCO
Parmi les 101 patients hospitalisés pour EABPCO, soit 62 % étaient porteurs d’une BPCO connue et 38 % avaient une exacerbation révélatrice.
FIGURE 6. Répartition des patients selon le diagnostic de BPCO (BPCO connus/ BPCO révélatrices)
Statut exacerbateurs fréquent
Chez nos 101 malades hospitalisés pour EABPCO, 29% rapportaient au moins 2 Hospitalisations annuelles et étaient donc considérés exacerbateurs fréquents, tandis que 71 % présentaient moins de 2 hospitalisations annuelles dont 14% 1 hospitalisation annuelle et 57% aucune hospitalisation.
FIGURE 7. Répartition des patients selon leur statut exacerbateur
PROFIL CLINIQUE
Signes fonctionnels
Signes respiratoires
Les signes fonctionnels récoltés au cours de notre exploitation étaient dominés par l’aggravation de la dyspnée qui était présente chez tous les patients de notre série.
La dyspnée était évaluée selon le score de la MMRC :
FIGURE 8. Répartition des patients BPCO dyspnéique selon la classification MMRC
En 2ème position, 78% des patients présentaient une toux dont 18% étaient productive avec des expectorations purulentes, 20,7% productive avec des expectorations muco-purulente et 25,7% avec expectorations muqueuse, 13,6% avaient une toux sèche.
FIGURE 9. Répartition des patients BPCO selon la productivité de la toux
En 3ème position, 27,2 % présentaient une douleur thoracique et l’hémoptysie était présente dans 12% des cas.
Signes généraux
L’altération de l’état générale était marquée chez 86% de cas associant un amaigrissement, une asthénie et anorexie.
Signes physiques
Evaluation initiale
IMC moyen était à 22 qui variait entre 16 et 40.
Les signes respiratoires
La fréquence respiratoire était en moyenne de 21 cycle/min variait entre 20 et 40 Cycle /min. Une SaO2 moyenne de 86% avec des extrêmes de 60% et 95% .
Les signes neurologiques avec installation de trouble de conscience et d’agitation étaient retrouvés chez 10% de cas motivant une prise en charge en réanimation.
Signes physiques pleuropulmonaires
La répartition des signes était comme suit :
FIGURE 10. Les différents signes physiques respiratoires retrouvés chez les patients BPCO
Signes physiques cardiovasculaire
Les signes hémodynamiques: La fréquence cardiaque moyenne était de 87 bpm variant entre 62 et 100 bpm. L’examen cardio-vasculaire a retrouvé des signes d’insuffisance cardiaque droite (Œdème des membres inferieure) dans 20% des cas soit 20 cas et un tableau d’insuffisance cardiaque gauche chez 3 % de cas.
Evaluation de la gravité de l’exacerbation de la BPCO
L’évaluation de la gravité de l’exacerbation était basée sur la présentation clinique initiale, et le terrain des patients : 60% des patients étaient hospitalisés pour une exacerbation aigue sévère. Les patients en exacerbations légères et modères ( 28% d’ exacerbation modéré et 12% d’exacerbation légère) étaient hospitalisés pour prise en charge d’éventuelle cause d’exacerbation notamment les causes néoplasique, le pneumothorax, l’ embolie pulmonaire.
FIGURE 11. Répartition des patients selon la gravité de l’exacerbation aigue de BPCO
Profil paraclinique
Imagerie médicale
Radiographie thoracique
Tous les patients avaient des anomalies radiologiques à la radiographie thoracique avec la présence de plusieurs de ces anomalies chez le même patient. Les images radiologiques observées sont représentés dans le tableau suivant : (TABLEAU 2)
Tomodensitométrie thoracique
Tous les patients de notre série ont bénéficié d’un scanner thoracique avant ou au cours de leurs hospitalisations révélant :
FIGURE 12. Fréquence des anomalies de TDM thoracique chez les patients BPCO
Bilans biologiques
Le bilan biologique était en faveur de :
NFS : Une moyenne d’hémoglobine à 12 g/dL variant entre 7g /dl et 18g /dl une anémie était retrouvé chez 10 patients et une polyglobulie chez 5 patients.
Une hyperleucocytose à prédominance à PNN dans 40 % des cas.
Une éosinophilie était objectivée chez 5 patients.
La CRP était élevé dans 70% des cas.
Bilan rénal était perturbé dans 5% des cas soit 5 patients.
Les D-Dimères étaient positifs dans 45% des
Bilan Bactériologique
L’ECBE : 25% des patients ont bénéficié d’un ECBE :
Les Prélèvements avaient objectivé les germes suivants:
Streptocoque pneumoniae était retrouvé chez 18 % de cas.
Pseudomonas aeroginosa était retrouvé chez 5 % des cas.
Klebesiella était retrouvé chez 2% de cas.
Explorations fonctionnelles respiratoires
La gazométrie artérielle
La gazométrie artérielle était retrouvée chez 52,5% de nos malades où l’on décèle dans 15% des cas réalisant cet examen une hypoxémie avec hypercapnie, 22, 5% une hypoxémie sans hypercapnie et 15 % des gazométries étaient normale.
La spirométrie
A distance du tableau initiale une a spirométrie était réalisée chez 76 patients (soit 75,2%) et objectivait un trouble ventilatoire obstructif (VEMS/CVF<0.7) chez tous les patients non réversible après bronchodilatateurs chez 69 patients.
Exploration cardiologique
L’électrocardiogramme (ECG) était effectué chez 70 patients soit 70% révélant un trouble de rythme cardiaque chez la majorité des patients avec prédominance de tachycardie sinusale et de bloc de branche droit.
Echographie cardiaque
L’echo-coeur était réalisée chez 63% de malades de notre série soit 62,3%, elle est revenue normale chez 37 malades et a décelé des signes d’HTP chez 21 malades, et des stigmates d’ insuffisance cardiaque droites chez 23 de nos malades avec dilatation de VD , une insuffisance cardiaque gauche chez 3 patients avec une dilatation du VG .
Fibroscopie bronchique souple
Devant la suspicion d’une origine néoplasique et après stabilisations des patients sur le plan respiratoire une fibroscopie souple était faite chez 27 patients et a révélé un aspect d’une tumeur bourgeonnante chez 14 patients et un aspect inflammatoire diffus chez les 13 cas restants.
Sur les 101 dossiers étudiés
L’étiologie infectieuse était retrouvée chez 38 patients soit 37 % des étiologies des exacerbations.
Les cardiopathies étaient incriminées dans 28 cas soit 28 % des patients.
L’étiologie néoplasique était retrouve dans 14 % des causes des exacerbations (14 cas)
Le pneumothorax était retrouvé chez 13 cas, soit 13 % de patients de notre série.
L’embolie pulmonaire était retrouvée dans 12 %.
Prise médicamenteuse était retrouvé chez 2 patients (type neuroleptique)
Ecart de traitement chez 10% de cas .
FIGURE 13. Répartition des patients selon l’étiologie des exacerbations
Traitement
Lieu de prise en charge
48% de nos patients étaient admis initialement au service de réanimation puis transférés au service de Pneumologie pour complément de prise en charge alors que 52% de nos patients étaient directement hospitalisés au sein du service de Pneumologie du CHU Mohamed VI de OUJDA.
La durée d’hospitalisation était située entre 5 jours à 20 Jours, avec une durée moyenne de 10 jours.
FIGURE 14. Répartition des patients selon le service de prise en charge
Traitement initial de l’exacerbation à la phase aigüe
Oxygénothérapie
L’oxygénothérapie était administrée chez tous nos patients avec un débit variant entre 2 et 6 litres par minute. Le débit moyen était de 3L/min.
Les bronchodilatateurs de courte durée d’action
Chez tous les patients, une association de béta-2-mimétiques et anticholinergiques était retrouvés.
Ils étaient délivrés par nébulisation initialement toutes les 20 mn pendant 1heure puis toutes les 4 heures.
La corticothérapie orale
La corticothérapie orale était prescrite chez 80%. La durée moyenne du traitement était de 5J à la dose de 0,5mg/kg/jr.
Ventilation non invasive (VNI)
L’hypoxémie persistante malgré l’oxygénothérapie, et l’acidose respiratoire étaient les principales indications de la mise en place de la ventilation non invasive dans notre série.
Intubation invasive
Devant l’installation de trouble de conscience et d’agitation 10 patients ont dû avoir recours à une intubation invasive.
Traitement de la cause d’ exacerbation (étiologique)
Antibiothérapie
Les patients ayant une étiologie infectieuse et des processus pulmonaire surinfectés, ont bénéficiés d’une antibiothérapie probabiliste et à large spectre que nous avons adapté par la suite en fonction des résultats bactériologiques.
Amoxicilline protégé seule était indiquée chez 25 cas, association amoxcilline protégée et macrolide 12 cas, association C3G+ciprofloxacine chez 3 cas, association amoxcilline protégé +Levofloxacine chez 3 cas.
Le choix de l’antibiotique dépend de la gravité de l’exacerbation, la notion de prise d’antibiotique dans les mois précédant l’épisode et du germe incriminé.
FIGURE 15. Protocole thérapeutique utilisés chez les patients hospitalisés pour exacerbation de BPCO
Une anticoagulation curative
L’anticoagulation curative pour traitement d’embolie pulmonaire à base d’héparine injectable avec relai précoce d’AVK était indiqué chez 4 patients et chez 2 patients les anticoagulant oraux directe étaient indiqué.
Le drainage thoracique
Le drainage thoracique était indiqué chez tous les patients dont l’étiologie d’exacerbation était le pneumothorax (13 %) de cas.
Traitement des cardiopathies
Le traitement spécifique des décompensations cardiaque (Antihypertenseurs, anti arythmique, diurétique) était instauré chez 28% de cas.
Traitement préventif
La prévention de nouvelles exacerbation était basée sur l’instauration d’un traitement bronchodilatateurs de fond adapté au stade de BPCO pour chaque patient, la mise en place d’une oxygénothérapie de longue durée pour les patients en stade d’IRC, une vaccination efficace antipneumoccocique et antigrippale, et l’éducation du patient tout en insistant sur l’observance thérapeutique et le sevrage tabagique.
Un traitement associant les bronchodilatateurs de longue durée d’action était indiqué chez tous les patients.
Les Anticholinergiques seul (LAMA seul) chez 42 patients.
Association LABA + LAMA chez 28 patients.
Association LABA + LAMA + CSI chez 13 patients.
Association LABA et les corticoïdes inhalés (LABA+ CSI) chez 5 patients.
Les bronchodilatateurs de cours durée d’action à la demande étaient indiqués pour tous les patients.
La vaccination antigrippale et anti-pneumoccocique étaient recommandées pour tous les patients.
Le sevrage tabagique était recommandé pour tous les patients tabagiques non sevrés.
L’Oxygénothérapie de longue durée d’action était indiquée chez les patients en stade d’insuffisance respiratoire chronique soit 10%.
Par manque de moyens et de structures adaptées la réhabilitation respiratoire n’a pas été proposée.
Evolution – complication
Dans notre population d’étude
L’évolution clinique était marquée par une amélioration chez 78 patients soit 77,2%. 13 patients ont été décédés dont 3 patients étaient décédés au service de pneumologie et 10 patients étaient décédés au service de réanimation après avoir eu recours à une intubation invasive par un arrêt cardiorespiratoire. L’évolution était marquée par une insuffisance respiratoire chronique chez 10 patients avec mise en place d’OLD.
FIGURE 16. Répartition des malades BPCO selon leur évolution
DISCUSSION
Définition
La BPCO est définit selon le rapport de la Global Initiative on Obstructive Lung Disease (GOLD 2021), par une maladie fréquente qui peut être prévenue et guérie caractérisée par des symptômes respiratoires persistants et une limitation des débits aériens secondaire à des anomalies des voies aériennes et/ou des alvéoles résultant d’une exposition importante à des particules ou des gaz nocifs [1]. Cette limitation des débits aériens est la résultante d’une atteinte des voies aériennes et de destruction du parenchyme (emphysème) dont la participation relative au cours de la BPCO varie d’un sujet à l’autre. La BPCO à une définition fonctionnelle respiratoire : elle se caractérise par un déficit ventilatoire obstructif (DVO) proximal partiellement ou non réversible sous bronchodilatateurs et d’aggravation progressive. La bronchite chronique à une définition clinique : toux productive au moins 3 mois/an sur au moins 2 années consécutives [2]. Elle peut être simple (sans obstruction ou obstructive. Seule la forme obstructive fait partie de la BPCO. L’emphysème à une définition anatomique : élargissement anormal et permanent des espaces aériens distaux avec destruction des parois alvéolaires [3].
L’exacerbation aiguë de BPCO est définie comme un événement aigu caractérisé par une aggravation des symptômes respiratoires (notamment la toux, l’expectoration et la dyspnée) au-delà des variations quotidiennes et conduisant à une modification thérapeutique : soit, simple augmentation des bronchodilatateurs ; dans ce cas, une durée supérieure à 48 heures est requise pour parler d’exacerbation ; soit, ajout d’un traitement supplémentaire (antibiothérapie et/ou corticothérapie orale [4].
Epidémiologie
Prévalence
La prévalence de la BPCO est difficile à estimer en raison du sous-diagnostic et de la complexité à réaliser des épreuves fonctionnelles respiratoires dans le cadre d’études épidémiologiques. On juge en effet que le nombre de cas diagnostiqués et traités représente moins d’un tiers du total des malades [5-6].
La plupart des auteurs s’accordent pour estimer que le nombre de patients atteints de BPCO est actuellement en augmentation dans le monde et l’on peut penser qu’il continuera à croître dans les années à venir [7]. Deux raisons essentielles expliquent ces prévisions : le tabagisme croissant dans les pays en voie de développement et l’augmentation de l’espérance de vie.
Les dernières études prévalence en Afrique faible à 179/100000, cette estimation très basse est expliquée par l’inclusion de tous les âges alors que la BPCO est une pathologie du sujet âgé [7].
Mortalité
La BPCO est actuellement dans les 10 premières
causes de décès dans le monde et est prédite à devenir la 3ème cause de décès d’ici 2030.
La mortalité de la BPCO est estimée à 27% des décès liés au tabac. Les décès liés aux tabac sont prédit de doubler depuis 2002 à 2030 en particulier dans les pays à bas et à moyen revenus [8]. Près de 90% des décès par BPCO, se produisent dans des pays à revenu faible ou intermédiaire.
Ces données importantes de mortalités restent quand même sous-estimées du fait du sous-diagnostic et de l’intrication avec les comorbidités [9].
Rappel Physiopathologique
Physiopathologie de la BPCO
La physiopathologie de la BPCO fait implique 3 facteurs : un processus inflammatoire, le stress oxydatif et un déséquilibre entre les protéases et les anti-protéases.
Une infiltration des cellules immunitaires (Macrophages, lymphocytes T, CD8, polynucléaires neutrophiles)
Il s’agit d’inflammation chronique excessive des voies aériennes, du parenchyme et du réseau vasculaire pulmonaire, causée par l’inhalation de particules ou de gaz toxiques et par le tabagisme. Elle met en jeu des cellules immunitaires : les neutrophiles, les macrophages et les lymphocytes qui vont détruire le tissu, favoriser la destruction de la cloison alvéolaire et stimuler la sécrétion de mucus [10] [11].
Le stress oxydatif
Les oxydants sont générés par le tabac et les autres particules nocives et sont libérés par les cellules inflammatoires comme les macrophages et les neutrophiles.
Ces oxydants diminuent les anti-protéases, et augmentent la production de mucus, induisent une bronchoconstriction et augmentent la production des facteurs pro-inflammatoires, Par ailleurs, il existe une réduction des antioxydants (vitamine C, vitamine E, glutathion.) [12].
Déséquilibre de la balance protéases anti protéases
Les protéases tendent à détruire le parenchyme pulmonaire et les anti- protéases à le protéger. La perte de cet équilibre peut être causée par les cellules inflammatoires et les cellules épithéliales dans la BPCO.
La destruction de l’élastine est probablement responsable de l’emphysème [13].
Physiopathologie des exacerbations aigue de la BPCO
L’exacerbation aigue de BPCO est en rapport avec une inflammation systémique et bronchitique accrue, la greffe de germes bactériens et viraux ainsi que des anomalies des échanges gazeux.
Inflammation systémique et bronchique
Au cours des exacerbations de la BPCO, il existe une majoration de l’inflammation systémique déjà existante chez le patient bronchitique à l’état stable.
Lors d’une cascade inflammatoire des médiateurs inflammatoires (les interleukines et les chémokines) sont libérés et activent les cellules immunitaires provoquant une inflammation systémique avec une augmentation de la protéine C réactive (CRP) et le fibrinogène [14].
Le processus inflammatoire lors de l’exacerbation implique surtout les neutrophiles mais tous types de cellules inflammatoires dans la muqueuse bronchique peuvent être recrutés et le processus inflammatoire dépend également de type du facteur déclenchant de l’exacerbation [15][16].
Rôle des Germes dans les exacerbations aigu de BPCO
Germes bactériens
Lors d'une exacerbation de BPCO, des bactéries sont isolées dans 40-60% des cas.
Les germes prédominants sont : Haemophilus influenzae, Moraxella catarrhalis et Streptococcus pneumoniae. Ces bactéries pénètrent dans les cellules épithéliales et induisent une destruction cellulaire, elles peuvent altérer les protéines des jonctions serrées intra-épithéliales facilitant leur pénétration dans le sous-épithélium [17].
Les produits bactériens stimulent la sécrétion de mucus et la production par les cellules épithéliales et les macrophages des médiateurs de l’inflammation tels que Tumor necrosis factor alpha (TNFa), l'interleukine 8 (IL8). Ces deux puissants médiateurs chimiotactiques vont provoquer le recrutement et l’activation des neutrophiles qui libèrent le leucotriéne B4 (LTB-4) et de l’élastase neutrophilique qui vont majorer la sécrétion de mucus et amplifier le recrutement des cellules neutrophiles [17]. En plus la présence de bactéries suggère déjà une violation des défenses de l'hôte avec des lésions des cellules épithéliales associées, une hypersécrétion de mucus, une diminution de la fréquence des battements ciliaires, une augmentation des fuites vasculaires sous-muqueuses et une infiltration de cellules inflammatoires
Germe Viraux
Une infection virale est retrouvée chez 30 à 60% des patients. Les virus fréquemment identifiés lors des exacerbations sont les rhinovirus, le virus de la grippe et le virus respiratoire syncitial [18].
Ces virus augmentent l’expression de la cyclo-oxygénase inductible (COX2) dans les éosinophiles et les macrophages et augmentent en conséquence la production de leucotriènes et de thromboxane A2 qui exercent un effet constricteur.
Anomalies des échanges gazeux:
L’exacerbation sévère de BPCO est caractérisée par une détérioration significative des gaz du sang artériel par rapport à leur niveau de base chez le malade à l’état stable.
L’hypoxémie est due à une aggravation des anomalies de ventilation/perfusion (V.A/Q) qui sont responsable d’une augmentation de l’espace-mort physiologique et donc d’une hypoventilation alvéolaire et d’une hypercapnie.
L’hypercapnie est majorée par l’augmentation de production de CO2 par l’organisme en hyper-métabolisme lié au stress de la maladie et de sa cause.
L’acidose respiratoire est la conséquence de l’hypercapnie, mais elle est rarement sévère au cours des exacerbations des BPCO car l’hypercapnie chronique a entrainé compensation métabolique (augmentation des bicarbonates et l’excès de base).
Donc lors d’un épisode aigu il faut une élévation considérable de la Paco2 pour qu’apparaisse une acidose majeure [19].
Rôle de la pollution dans les exacerbations aigue de la BPCO
Les patients présentent plus d’exacerbations et d’hospitalisations lors des pics de pollution. Plusieurs polluants y sont incriminés, entre autre, les particules de diamètre inférieur à 10μm (PM10 et PM2.5), l’ozone (O3), le dioxyde de souffre (SO2) et le dioxyde d’azote (NO2). La pollution exerce un stress oxydatif épithélial et stimule, par des mécanismes identiques à ceux décrits pour les infections virales, la production d’isoprostanes responsables d’une contraction des muscles lisses et d’un œdème [20-21].
Données cliniques
Diagnostic positif d’une exacerbation de BPCO
Interrogatoires et Signes fonctionnels
Lors des exacerbations de BPCO un interrogatoire minutieux s’avère nécessaire incluant la recherche des facteurs de risque, des antécédents respiratoires (asthme, infections respiratoires dans l’enfance), des habitudes toxiques et tabagiques (durée du tabagisme, quantité de cigarette fumées…), la présence des comorbidités. , l’établissement de l’histoire de la maladie avec la date de début des symptômes (toux, expectoration, dyspnée). En pratique, il est habituel que le diagnostic de BPCO ne soit évoqué pour la 1ère fois que lors d’une exacerbation de la maladie.
L’exacerbation est caractérisée par
La majoration d’une dyspnée, une majoration du volume de l’expectoration et/ou de sa purulence (en cas d’exacerbation infectieuse).
Une majoration de la toux pendant plus de 48 heures
Si le patient est connu et suivi comme BPCO, il faut rechercher
Notion d’exacerbations antérieures durant l’année.
Notion d’hospitalisation durant l’année.
Traitement de fond.
Les facteurs déclenchant l’exacerbation.
Patient non connu comme BPCO (la BPCO est suspectée), il faut rechercher :
Tabagisme chronique
Une bronchite chronique.
La notion de dyspnée d’effort
Les comorbidités associées
Dans notre étude, l’exacerbation était révélatrice de la BPCO chez 38 % patients contre 62% de patients connus bronchitique chronique.
Signes physiques
L’examen physique doit chercher l’ensemble de signes cliniques respiratoires et hémodynamique ainsi que neurologique permettant d’apprécier la sévérité de l’exacerbation de la BPCO : Les signes de gravités de l’exacerbation de BPCO sont d’ordre respiratoire, cardiovasculaire, et neurologique [22].
Signes Respiratoires. Dyspnée de repos, Polypnée >25cycle/min , cyanose et Saturation en oxygène à l’air ambiant<90%, signes de luttes respiratoires et usage de muscles respiratoires accessoires , respiration abdominale paradoxale, Signe de Hoover, Signe Campbell.
Signes hémodynamique: Tachycardie > 110B /min, Hypotension, Marbrures Œdèmes des membres inférieurs Signes d’insuffisance cardiaque droite.
Signes neurologique en rapport avec l’hypercapnie : Agitation, Obnubilation, Confusion, coma, flapping tremor ou Asterixis.
Diagnostic de gravité
Le diagnostic de gravité est lié à la sévérité de la présentation clinique et l’engagement du pronostic vital, à l’étiologie en cause, à l’état basal des patients atteints de BPCO (notamment le degré d’obstruction évaluer par le VEMS) tableau , à la réponse du malade à la thérapeutique et les données relevées au cours de l’interrogatoire à savoir : âge, comorbidités associés et antécédents. Selon le dernier rapport GOLD 2021 sur la BPCO, les exacerbations aigues de BPCO sont classées comme suit [1]:
Légère : Traitée avec des Béa-2-agonistes à courte durée d’action seulement.
Modérée : Traitée avec des Béa-2-agonistes à courte durée d’action associée à une antibiothérapie et/ou corticothérapie orale.
Sévère : Patient nécessitant une hospitalisation. Les exacerbations sévères peuvent être associées à une insuffisance respiratoire aigüe.
On peut déduire donc que la caractérisation des exacerbations de BPCO ne se fait qu’à postériori de la décision thérapeutique.
Dans notre étude l’évaluation de la gravité des exacerbations était basé sur la présentation clinique initiale et le terrain des patients : 12% des exacerbations aigue étaient classé légère, 28% modérés, et 60% étaient considérées comme sévères.
Quant aux poussées d’origine infectieuse : Trois critères associés ou non sont classiquement proposés (critères d’ANTHONISEN) pour déterminer la gravité : augmentation du volume de l’expectoration, modification de l’expectoration devenant purulente et apparition ou majoration d’une dyspnée [23].
Légère : accroissement d’un seul des symptômes cardinaux
Modéré : accroissement des deux symptômes cardinaux
Sévère : accroissement des trois symptômes cardinaux
(FIGURE 17) Tableau classification de l’état basal de la BPCO
Facteurs de risque des exacerbations aigu de BPCO
Le principal facteur de risque d’exacerbations est la présence d’exacerbations antérieures. D’autres facteurs ont été associés au risque d’exacerbations, d’hospitalisations et de décès :
Un taux élevé de polynucléaires éosinophiles (> 2 %) : associé à un risque élevé d’exacerbation et une bonne réponse aux corticoïdes inhalés [24].
Le rapport entre la dimension de l’artère pulmonaire et la crosse de l’aorte [1]. L’importance de l’emphysème apprécié par la TDM thoracique [1].
La vitamine D est impliquée dans la physiopathologie des exacerbations, des études ont montré que la supplémentations en VIT D diminue le risque par 50% des hospitalisations pour BPCO, donc il est recommandé de chercher un déficit en VIT D chez les patients hospitalisés pour exacerbation de BPCO, ainsi supplémentation en vitamine D est recommandé chez cette catégorie de patients [1].
La sévérité peut également être évaluée par l’identification de facteurs de risque qui peuvent être classé en facteurs d’aggravation précoce et les facteurs de risque d’aggravation tardive (tableau 3) [25].
Donnes paracliniques
Bilan radiologique
Radiographie thoracique
Examen indispensable au cours de l’exacerbation de BPCO permet d’objectiver des anomalies radiologiques dans 15 à 20 % des cas, et peut induire des modifications thérapeutiques dans 10 à 21 % des cas [26].
La Radiographie thoracique permet de rechercher : les signes de distension thoracique.
Sur une radiographie thoracique de face : aplatissement des coupoles diaphragmatiques, horizontalisation des côtes, élargissement des espaces intercostaux, hyper-clarté pulmonaire.
Sur une radiographie thoracique de profil : augmentation des espaces claires rétro-sternal et rétro-cardiaque, augmentation du diamètre thoracique antéropostérieur.
Elle peut orienter également vers la cause d’exacerbation aigue de la bpco ou d’établir un diagnostic étiologique par telles que la présence d’un processus tissulaire, la cardiomégalie et le pneumothorax.
Angioscanner et TDM thoracique avec injection
Permet la recherche d’une embolie pulmonaire ou de lésions tumorales et une bonne description de lésions pulmonaire.
Il est plus performant que le cliché radiographique thoracique standard dans la caractérisation de lésions pulmonaires globalement [27].
Gazométrie artérielle
La gazométrie est un examen essentiel dans la prise en charge de la BPCO à l’état stable et au cours des exacerbations aigue de la BPCO.
Elle est capitale cours des exacerbations de BPCO, où elle permet d’évaluer la présence ou non d’une insuffisance respiratoire aigüe ainsi que son classement, conditionnant ainsi son degré de gravité [28].
Les deux valeurs qui semblent avoir une valeur pronostique sont une PaO2 inférieure à 50 mm Hg et un pH inférieur à 7,30 [28].
Elle permet d’évaluer l’existence d’une insuffisance respiratoire chronique préexistante et de guider la décision d’une oxygénothérapie ainsi que la prescription d’une oxygénothérapie de longue durée et poser l’indication d’une ventilation non invasive ou invasive [28].
Critères de gravité gazométriques [28] :
- Hypoxémie (PaO2 < 60 mm Hg)
- Hypercapnie (PaCO2 > 50 mm Hg)
- Acidose respiratoire (pH < 7,36)
- SaO2 < 90 % en air ambiant
Dans notre étude la gazométrie était faite chez 52 ,5% des patients, 15% des patients avaient une hypoxémie avec hypercapnie, 22,5% une hypoxémie sans hypercapnie et 15% avaient une gazométrie normale.
Bilan biologique
NFS
La numération formule sanguine réside d’abord dans la recherche d’une éventuelle anémie considéré comme facteur prédictif de mortalité en cas d’exacerbation aigue de BPCO [29-30].
Permet de rechercher également une polyglobulie secondaire à une hypoxémie chronique mal corrigée dans le contexte de BPCO compliquée d’une insuffisance respiratoire chronique[29-30].
Elle permet également de repérer plus souvent une anémie ou une hyperleucocytose dans le cadre de phénomènes inflammatoires ou infectieux. Dans notre étude 10% des patients étaient anémiques et 40% avaient une hyperleucocytose à PNN.
Une lymphopénie a été parfois associée à un risque accru de virose en cas d’exacerbation aigue de BPCO et peut être un examen d’orientation étiologique de très faible spécificité [31].
Mais également l’orientation vers le diagnostic de l’étiologie bactérienne par l’intermédiaire
Du rapport neutrophile/lymphocyte avec une sensibilité de 61% et une spécificité de 58% (taux relativement faibles) [29-30].
Le volume plaquettaire élevé contribue également a démontré l’état inflammatoire systémique de la BPCO, son élévation est retrouvé aussi bien à la phase stable qu’en cas d’exacerbation [29-30].
La CRP
Est un biomarqueur inflammatoire, joue un rôle dans la confirmation de l’état Inflammatoire systémique qu’endure l’exacerbateur de BPCO, mais également ses valeurs élevées sont corrélées à la fois aux infections virales et aux infections bactériennes avec une sensibilité et une spécificité respectivement à 54% et 52%. Elle participe ainsi aux arguments clinico-biologiques infectieux [32-33].
Une étude suggère qu’un taux de CRP supérieur à 50 mg/l est associé à une évolution défavorable (décès à l’hôpital ou dans les 15 jours suivant la sortie, recours à la réanimation ou survenue d’une défaillance cardiaque pendant le séjour) [84][34].
Dans notre étude la CRP était élevée chez 70 %.
La pro-calcitonine
La procalcitonine est un polypeptide normalement produit dans les cellules neuroendocrines de la thyroïde et des poumons, est un marqueur de l’inflammation et d’infection bactérienne.
La stratégie d’utilisation de PCT dans les infections respiratoires basses est la suivante : un dosage sanguin > 0.25 ng/ml permet de mieux sélectionner l’exacerbation BPCO qui est traitable par antibiotiques, un taux < 0.25 ng/ml rend le diagnostic d’infection bactérienne peu probable [35].
L’arrêt des antibiotiques peut également être guidé par une cinétique après dosage séquentiel (48h) au-dessous d’un seuil (0.25ng/ml) ou une vitesse de décroissance (diminution ≥90% de la valeur initiale.
Les stratégies d’utilisation des antibiotiques basées sur la PCT ont montré une diminution significative des durées de traitement. Dans notre étude le dosage de la pro-calcitonine n’as pas été retrouvé.
Le peptide natriurétique (BNP)
C’est une neurohormone cardiaque libérée dans la circulation à partir des ventricules en réponse à une augmentation de la tension pariétale, traduisant une augmentation des volumes et des conditions de charge gauche et droite [36] [37].
Le dosage de BNP et de la partie N-terminale de son précurseur (NT-proBNP) a été développé pour distinguer les causes cardiaques des causes non cardiaques de la dyspnée aiguë [38].
Un dosage sérique de BNP supérieur à 500pg/ml permet de sélectionner parmi les sujets de moins de 50 ans hospitalisés pour exacerbation de BPCO ceux qui seront traités contre une insuffisance cardiaque [39].
f-Dimères
Les D-dimères sont utilisés pour éliminer le diagnostic d’EP chez des patients présentant une probabilité clinique faible ou intermédiaire (score de Genève), ils sont des produits spécifiques de dégradation de la fibrine.
Ils sont augmentés dans les situations où le phénomène de coagulation est augmenté, qu’il s’agisse d’une pathologie thrombotique ou d’une réaction secondaire à une situation pathologique (sepsis, néoplasie, chirurgie, traumatisme important …) ou physiologique (grossesse et post partum, sujet âgé…) [40] [41].
Bilan métabolique
Bilan lipidique
La détermination du profil lipidique est utile pour la recherche d’un syndrome métabolique dans le cadre du bilan de comorbidités. Une étude a démontré une corrélation entre le syndrome métabolique la durée des exacerbations et leur fréquence [42].
Glycémie
Le diabète ainsi que l’hyperglycémie sans diabète diagnostiqué sont des facteurs de mortalité augmenté et de prolongation du séjour hospitalier [43].
Bilan phosphocalcique
La déficience en vitamine D est associée à une augmentation des admissions hospitalière pour BPCO [44].
Bilan bactériologique
L’ECBC n’est pas recommandé en première intention chez un patient hospitalisé pour une exacerbation BPCO. Recommandé surtout en cas d’infection à germes résistants lors d’ un échec d’une première ligne d’antibiothérapie, antécédent d’infection ou colonisation à germes résistants ou en cas d’immunodépression, d’exacerbation BPCO itératives, d’exacerbation sévère ou d’obstruction bronchique sévère [45] .
Ill est facilement contaminé par la flore saprophytique oro-pharyngée, mais également les difficile à faire chez les patients au cours des détresses [46-47]. Dans de nombreuses études multicentriques moins de 50% des patients hospitalisés pour. EABPCO avait un ECBE positif et les germes les plus retrouvés étaient : H. Influenzae, S. Pneumoniae, Moraxellacatarrhalis et le P.aeruginosa [46-47].
Evaluation cardiaque
Electrocardiogramme (ECG)
L’ECG permet de découvrir des signes de souffrance ischémique, un trouble du rythme ou des arguments pour retenir une insuffisance cardiaque [27].
Echographie cardiaque
Il n’est pas recommandé de réalisé une échocardiographie systématiquement devant une exacerbation BPCO hospitalisée sauf en cas de suspicion d’une atteinte cardiaque associée.
L’échographie révèle dans la majorité des exacerbations BPCO, une élévation des pressions artérielles pulmonaires (HTP), corrélées à l’hypoxémie et à l’hypercapnie donc à la sévérité de l’épisode [48].
Spirométrie
Bien que certaines études aient montré que le VEMS au cours des exacerbations était faiblement corrélé au taux de rechute. Les dernières lignes directrices de la SPLF (société de pneumologie en langue française) ne recommande pas la réalisation d’une spirométrie au cours de la phase aigüe de l’EABPCO ; elle peut toutefois apporter un élément d’orientation dans certain cas particulier, notamment si le diagnostic de BPCO n’a pas été confirmé auparavant par une spirométrie (EABPCO révélant la maladie) et si elle est réalisable dans de bonnes conditions.
Dans tous les cas, une spirométrie doit être réalisé à distance en période stable [49]. C’est donc un examen utilisé à postériori du traitement ou dans le but de la confirmation du diagnostic.
Diagnostic étiologique
Les causes d’exacerbation sont multiples, mais dans environ un tiers des cas, aucune cause n’est retrouvée malgré une enquête exhaustive. Il est actuellement communément admis que la plupart des exacerbations ont pour origine les infections respiratoires (bactéries, germes atypiques et virales).
L’infection
Il s’agit du mécanisme le plus fréquemment en cause dans 80%, il est admis aujourd'hui qu'une étiologie bactérienne peut être retenue dans 40 à 50 % des cas, une étiologie virale dans 30 à 40 % des cas et un germe atypique dans 5-10 % des cas [50].
Les infections virales représentent un tiers des étiologies au cours des exacerbations de BPCO. Les exacerbations d'origine virale sont caractérisées par une dyspnée très marquée, des manifestations rhino-sinusiennes fréquentes et un temps de récupération plus long qu'au cours des exacerbations d'origine bactérienne [51].
Les rhinovirus sont les plus fréquemment rencontrés dans les exacerbations de BPCO d’origine virale, suivis des coronavirus, des virus influenzae et para influenzae, des adénovirus, du virus respiratoire syncytial (VRS) [52-53-54-55] et les patients atteints de BPCO sont plus sensibles à ces infections que les individus sains.
Les bactéries les plus souvent associées aux exacerbations aigues sont : le S.Pneumoniae, H. Influenzae, le Moraxella Catarrhalis, le P. Aeruginosa. Certaines études ont démontrées une corrélation entre la détérioration de la fonction pulmonaire et l’étiologie bactérienne retrouvée. La défaillance pulmonaire profitant essentiellement aux microorganismes : P.Aeruginosa et aux Entérobactéries [52-53].
Embolie Pulmonaire
La BPCO est considérée comme facteur de risque d'embolie pulmonaire (EP). Les phénomènes d’inflammation systémique, de stress oxydatif, d’hypoxémie, d’augmentation du volume plaquettaire moyen, retrouvés au cours de BPCO participent tous à la pathogénie de la maladie thromboembolique veineuse. La prophylaxie thrombo-embolique est donc avisée chez tout patient présentant une EABPCO sévère et un dépistage nécessaire chez tout patient BPCO se présentant pour exacerbation [54-55].
L’EP n’est pas évoquée systématiquement, d’autant que de nombreux symptômes et signes cliniques ainsi que des anomalies paracliniques sont communes à la bronchite et à l’EP. Toutes les deux peuvent se présenter sous la forme de dyspnée, tachypnée et sibilants toux et hémoptysie [56]. La présence des râles sibilants inexpliqués chez ces patients, il convient de réaliser systématiquement un angio- scanner thoracique pour éliminer un EP lorsque les D-dimères sont positifs. [57].
Insuffisance cardiaque gauche
Les décompensations cardiaques et les phénomènes thromboemboliques ont été démontrés comme principale étiologie de décès dans les 24h d’hospitalisation d’une exacerbation de BPCO au cours d’une étude rétrospective post-mortem de 2009 [58]. PARMIS les particularités de l'association BPCO et cardiopathie gauche est que la décompensation de l'une des pathologies peut retentir sur l'autre, voire même en déclencher une poussée aiguë) [59].
Les performances médiocres de l’examen physique et de la radiographie de thorax pour le diagnostic de dysfonction ventriculaire gauche, et les difficultés d’accès et de réalisation de l’échocardiographie chez ces patients, justifient l’utilisation de biomarqueurs comme les peptides natriurétiques (BNP et NT pro-BNP) qui as une meilleure performance dans ce contexte, principalement pour leur valeur prédictive négative [60].
Pneumothorax
C’est une cause rare et souvent mal toléré, impose un drainage thoracique en urgence, ceci d’autant plus que les altérations de la structure du poumon rendent peu vraisemblable le retour spontané à la paroi.
Il est parfois difficile de distinguer un pneumothorax et une bulle d’emphysème, la réalisation d’un examen tomodensitométrique étant souvent indispensable.
Cause inconnue
Le facteur déclenchant d’une exacerbation BPCO resterait inconnu dans 25 – 30 % des cas. Sont parfois incriminés les médicaments sédatifs (anxiolytiques et
neuroleptiques sédatifs, morphiques), les antitussifs, les infections extra-respiratoires (syndrome infectieux général), les traumatismes thoraciques, la chirurgie thoracique ou abdominale.
Bien entendu, comme détaillé ci-dessus lorsque la cause de l’exacerbation BPCO est inconnue, cela signifie qu’aucune infection n’a été retrouvée, qu’aucun pic de pollution n’a été déclaré. L’arrêt du traitement de fond peut être nié par le patient.
Enfin, le diagnostic différentiel d’une exacerbation BPCO n’entraîne pas systématiquement la réalisation d’un angioscanner thoracique ou d’une échocardiographie [61]. Dans notre étude les causes des exacerbations étaient dominées par les infections pulmonaires dans 37% de cas et les décompensations cardiaques chez 28% de cas.
Prise en charge thérapeutique des exacerbations
Hospitalisation ou traitement ambulatoire
L’hospitalisation n’est pas systématique dans les exacerbations. Pour guider le choix entre une prise en charge ambulatoire ou hospitalière, il convient d’analyser la modalité globale de la prise en charge en évaluant la sévérité de l’exacerbation. Donc la décision d’hospitalisation reposera sur l’évaluation de la gravité initiale.
Trois situations peuvent être observées
Insuffisance respiratoire aiguë menaçant le pronostic vital, nécessitant à court terme la mise en place d’une assistance ventilatoire adaptée. La prise en charge du patient est à l’évidence soit dans une structure de soins intensifs ou de réanimation médicale capable de mettre en route immédiatement une VNI mais aussi d’intuber et de ventiler le patient en cas de nécessité.
Exacerbations sans insuffisance respiratoire aigüe et sans critères de gravités et pour lesquelles la base thérapeutique repose sur une surveillance rapprochée et un traitement médical l’hospitalisation se fait dans cette situation au service de pneumologie.
Patient de gravité intermédiaire sans critère de détresse respiratoire. Cette troisième situation est relativement fréquente et la décision doit être individualisée.
L’orientation dépendra également des antécédents du patient, la réponse au traitement médical initial bien conduit, de l’étiologie éventuelle de l’exacerbation aigue. Les indications d’hospitalisation en unité des soins intensifs: [62]. Dyspnée sévère ne répondant pas au traitement d’urgence. Troubles psychiques (confusion mentale, léthargie, coma). Hypoxie persistante ou qui s’aggrave (PaO2<5,3 kPa ou 40 mmHg) et/ou acidose respiratoire sévère ou en voie d’aggravation (pH < 7,25) malgré un supplément d’oxygène et une VNI Besoin d’une ventilation assistée invasive. Instabilité hémodynamique et besoin de vasopresseur.
Traitement non pharmacologique
L’assistance ventilatoire
L'oxygénothérapie et le soutien ventilatoire sont deux traitements non pharmacologiques majeurs dans la gestion de l'exacerbation de la BPCO.
Oxygénothérapie
L’oxygénothérapie peut corriger l’hypoxémie. Mais elle peut aggraver une éventuelle hypercapnie, car une surélévation des concentrations d'oxygène inspiré peut entraîner l’inhibition de la commande centrale respiratoire, augmentant ainsi la rétention de dioxyde de carbone pouvant conduire à une acidose respiratoire.
L’oxygénothérapie est classiquement indiquée en première intention via des lunettes nasales, Avec une titration afin d’obtenir une saturation en oxygène entre 88 et 92%. L’utilisation de masques à effet venturi permet une détermination plus fiable de la FiO2 administrée. Il faut surveiller de manière très rapprochée, cliniquement par l’oxymètre de pouls et biologiquement par la gazométrie des patients présentant une exacerbation BPCO chez qui une oxygénothérapie a été initiée [63]. Au cours de notre série, tous nos patients ont bénéficié d’une oxygénothérapie.
La ventilation non invasive (VNI)
La VNI peut être débutée aux urgences, en service de pneumologie, à conditions de disposer du matériel adapté et d’un personnel médical et paramédical formé à la VNI en situation aiguë.
La VNI joue le rôle d’un bronchodilatateur direct et participe au recrutement alvéolaire du fait de la pression expiratoire positive externe (PEP), compensant la PEP intrinsèque [64-65].
Le recrutement alvéolaire améliore l'inadéquation ventilation-perfusion. Il a été démontré que la VNI rétablit les paramètres ventilatoires avec baisse de la FR, augmentation du volume courant et du volume minute, diminution du travail respiratoire, et améliore les échanges gazeux avec baisse de la PaCO2 et correction du pH, diminution de la fréquence de recours à l’intubation, diminution de la durée de séjour à l’hôpital et de la mortalité à l’hôpital, diminution des complications comme les pneumonies nosocomiales associées aux intubations endo-tracheale. Les indications de la VNI selon les recommandations GOLD 2021 sont les suivantes [1].
Acidose respiratoire
Dyspnée sévère associée à des signes de fatigue des muscles respiratoires
Hypoxémie persistante malgré une supplémentation en oxygène.
Les critères prédictifs d'échec liés à la VNI sont
Un âge élevé, une limitation préalable des activités de la vie quotidienne, la gravité initiale à l'admission, une fréquence respiratoire élevée, l'association d'une ou plusieurs comorbidités et des troubles de la conscience, une acidose sévère ou une hypercapnie majeure.
Contre-indication à la VNI sont
Environnement inadapté, expertise insuffisante de l’équipe, patient non coopérant, agité, opposant à la technique, intubation imminente, coma (sauf coma hypercapnique de IRC), épuisement respiratoire, Etat de choc , troubles de rythme ventriculaire graves, sepsis sévère, immédiatement après un arrêt cardio-respiratoires, pneumothorax non drainé, plaie thoracique soufflante, obstruction des voies aériennes supérieures, vomissements incoercible.Il n'existe pas de processus standardisé déterminant la durée et le sevrage de la VNI :Le sevrage s'effectuera de manière progressive en espaçant les séances, et l’'arrêt complet sera envisagé après une stabilisation clinique et gazométrique.
Ventilation invasive
Indiqué en cas de contre-indication à la VNI ou mise en jeu du pronostic vital. L’objectif principale de la ventilation mécanique invasive endo-trachéale au cours d’exacerbation aiguë sévère d’une BPCO est d’optimiser la dépense énergétique, d’éviter d’aggraver la distension thoracique en corrigeant progressivement l’acidose respiratoire.
Les complications les plus fréquentes de la ventilation mécanique invasive sont d’ordre traumatiques (barotraumatisme) et infectieuses (pneumopathies acquises sous ventilation mécanique) [66-67]. Les indications de l’intubation et de la ventilation mécanique ne sont pas totalement codifiées. De plus, en cas d’exacerbation aigue, les patients BPCO sont plus à risque que les autres de présenter un sevrage difficile de la ventilation artificielle [68-69].
Les indications de la ventilation invasive en cas d’exacerbations aigue de BPCO selon GOLD 2021, sont également des contres indications à la VNI [1]
Intolérance ou échec de la VNI
Etat post arrêt cardiaque ou respiratoire
Conscience diminuée
Agitation psycho-motrice inadéquate contrôlé par la sédation
Aspiration massive
Vomissements persistants
Incapacité à retirer les sécrétions respiratoires
Sevrage de la ventilation invasive
La BPCO représente l’une des pathologies les plus exposées à l’échec du sevrage de la ventilation invasive.
Le clinicien doit évaluer dès que possible la faisabilité et l’issue potentielle du sevrage selon le terrain, a fortiori chez un patient attient de BPCO, pour en optimiser les conditions, limiter la durée de la ventilation invasive voire proposer des alternatives au sevrage
La ventilation non invasive appliquée à la période post-extubation chez le patient atteint de BPCO a plusieurs objectifs [70-71]:
Raccourcir la durée de ventilation mécanique chez des patients présentant des difficultés de sevrage.
VNI préventive ou prophylactique pour prévenir la survenue d’une IRA post-extubation chez des patients à risques d’échec d’extubation.
VNI curative ou de sauvetage pour traiter la survenue d’une IRA post-extubation au décours immédiat (24–72heures) d’une extubation le plus souvent programmée. Bonchodilatateurs permettent une amélioration du VEMS et de la capacité vitale de l’ordre de 15 à 30 % en une à deux heures. L’association bêta2-agonistes et anticholinergique est recommandée.
L’intérêt de la théophylline (aminophylline par voie injectable) comme bronchodilatateur additionnel est très discuté en cas de non réponse aux nébulisations des autres bronchodilatateurs [72-73].
Corticothérapie
La corticothérapie générale est largement prescrite dans les exacerbations de BPCO. Une posologie de 0,5 mg/kg/j d’équivalent prednisone est suffisante et expose à moins de complications que des posologies plus élevées.
Les voies orales et intraveineuses sont probablement équivalentes en termes d’efficacité. Les données des études en soins de santé indiquent que les corticostéroïdes systémiques dans les exacerbations de BPCO permettent de raccourcir le temps de récupération, d’améliorer la fonction pulmonaire (VEMS) et l’hypoxémie artérielle (PaO2), et de réduire le risque de rechute précoce, l'échec du traitement et la durée de séjour à l’hôpital [74].
Anticoagulation prophylactique
Du fait du risque élevé de complications thromboemboliques au cours des exacerbations de BPCO [75-76].L’anticoagulation par héparine non fractionnée à dose efficace n’est pas recommandée, sauf autre indication. La prophylaxie par héparines de bas poids moléculaire à posologie élevée, par voie sous-cutanée, est
recommandée, comme la nardroparine 5000 UI anti-Xa ou l’énoxaparine 0, 4Ml [77-78].
L’antibiothérapie
Près de 70 % des exacerbations de BPCO ont un facteur déclenchant infectieux (souvent d’origine bactérienne). L’indication de l’antibiothérapie selon GOLD 2021est comme suit [1].
La présence de 3 symptômes cardinaux : Aggravation de la dyspnée, augmentation du volume des expectorations et l’augmentation de la purulence.
Présence de 2 symptômes cardinaux si l’un des 2 symptômes est ’augmentation de la purulence des expectorations.
Ventilation Mécanique: Invasive ou non invasive
La durée recommandée est de 5 à 7 J.
La SPLF préconise l’antibiothérapie si [49] :
Des signes de gravités sont présents
Le patient a une BPCO sévère (stade III et IV) ou des comorbidités susceptibles de menacer le pronostic vital
IL est constaté une purulence marquée
Il n’est actuellement pas recommandé de prescrire une antibiothérapie sur une valeur unique de CRP dans les EABPCO. L’utilisation de la procalcitonine, biomarqueur développé spécifiquement dans les infections bactériennes, pourrait avoir un intérêt décisionnel pour l’instauration d’une antibiothérapie.
Le choix d’antibiotique dépend du stade de la BPCO, mais en l’absence des résultats d’EFR, de l’existence et l’importance d’une dyspnée, toujours évaluée en dehors de toute exacerbation. Ce choix dépend aussi du profil de résistance régional des germes
Les antibiotiques recommandés en première intention sont l’amoxicilline-acide clavulanique), une céphalosporine de troisième génération injectable (céfotaxime ou ceftriaxone) ou une fluoroquinolone antipneumococcique (lévofloxacine, moxifloxacine).
Chez les patients avec facteurs de risque d’infection à Pseudomonas aeruginosa, l’association d’une bêtalactamine active sur le Pseudomonas aeruginosa et sur le pneumocoque (céfépime, pipéracilline + tazobactam) et de quinolones actives sur Pseudomonas aeruginosa (ciprofloxacine) est recommandée [63].
L’échec thérapeutique d’une antibiothérapie bien conduite impose d’éliminer une infection parenchymateuse par la radiographie de thorax, et de rechercher une infection due à Pseudomonas aeruginosa chez les patients présentant une BPCO évoluée. La durée du traitement antibiotique des exacerbations de BPCO est classiquement de 7 à 14 jours (10 jours en moyenne.
Les diurétiques
Ils ne sont pas indiqués de façon systématique. Ils peuvent être utiles au traitement d’une insuffisance cardiaque gauche documentée associée ou responsable de l’exacerbation aiguë. En cas de rétention hydrosodée et d’hypervolémie documentée, ils peuvent être administrés mais avec prudence. En effet, l’usage prolongé des diurétiques de l’anse type furosémide expose à un risque d’hypovolémie et d’alcalose métabolique. Les diurétiques exposent également à des troubles hydro-électrolytiques, comme l’hypokaliémie potentiellement délétère pour les muscles respiratoires [79] .
Anticoagulation curative :
En cas d’EP sous-jacente diagnostiquée, un traitement anticoagulant devrait être alors. Débuté dès la suspicion et poursuivi après confirmation. Les molécules disponibles comme moyen thérapeutique sont : les héparines, le Fondaparinux, les AVK, les anticoagulants oraux directs.
Les critères de retour à domicile
Lors de l’hospitalisation une évaluation régulière de la réponse clinique aux traitements chez les patients hospitalisés pour exacerbation BPCO. La mise en place d’un dispositif d’oxygénothérapie de longue durée doit être considérée en cas d’hypoxémie persistante :
Selon le gold 2021 un extracteur à domicile est indiqué si hypoxémie avec PaO2<55mmhg ou SAO2<88% ou une PAO2 est entre 55 et 60 mmhg associé polyglobulie et insuffisance cardiaque droite. Cette hypoxémie sera réévalué après 60 à 90 jours pour voir si ya toujours l’indication d’une OLD et si oxygénothérapie efficace.
Lors de l’évaluation de la capacité du patient à rentrer à domicile, il est recommandé de vérifier avec le patient qu’il a reçu et compris les conseils et les explications nécessaires avant la sortie.
La sortie de l’hôpital est l’occasion d’inscrire le patient dans une démarche de suivi et de contrôle de sa maladie et de ses comorbidités (Un rendez-vous de consultation de sevrage tabagique doit être planifié en accord avec le patient si encore tabagique).
Il est recommandé proposer un suivi plus fréquent chez les patients exacerbateurs fréquents et chez les patients ayant séjourné en unités de soins intensifs ou en réanimation : En cas d’hospitalisation sans séjour en réanimation ou en unité de soins intensifs, une consultation de pneumologie avec contrôle spirométrique et gazométrique doit être planifiée entre 4 à 8 semaines. Les patients hospitalisés en soins intensifs ou en
réanimation doivent être revus en consultation pneumologie dans les 4 semaines suivant la sortie, A la sortie un traitement bronchodilatateur de longue durée doit être initié ou poursuivi.
Prévention des exacerbations de la BPCO (GOLD 2021).
La prévention des exacerbations de la BPCO consiste en 3 volets : un traitement de fond adapté au stade de chaque patient, la vaccination anti-pneumoccocique et antigrippale qui doivent être à jour, et la réhabilitation respiratoire.
Traitement de Fond
Bronchodilatateurs
Il existe deux classes de bronchodilatateurs : Les béta2mimétiques de longue durée d’action (LABA) (formotérol et salmétérol ) qui améliorent la dyspnée, les volumes pulmonaires, le VEMS, l’état de santé, la fréquence des exacerbations et le nombre d’hospitalisation [80] , et les anticholinergiques de longue durée d’action (LAMA) tiotropium (spiriva) qui diminuent la fréquence des exacerbations que les LABA, le nombre d’hospitalisation, et améliorent l’efficacité de la réhabilitation pulmonaire en augmentant la résistance à l’effort.
Les corticoïdes inhalés (CSI)
Les corticoïdes inhalés ralentissaient la fréquence des exacerbations de 25% chez les patients sévères dont le VEMS moyen est inférieur à 50%.
Par ailleurs dans les formes moins sévères de BPCO, il n’était pas retrouvé de diminution du nombre d’exacerbations. Ils ne doivent pas être utilisés seuls, il faut les associer avec les beta-2 mimétiques [81].
Traitement combiné
Plusieurs études ont montré que la combinaison dans un même inhalateur d’un corticostéroïde inhalé et d’un β-2-mimétique de longue durée d’action se montrait d’avantage efficace que chacun des composants pris isolément.
TABLEAU. Indications du traitement de fond en fonction du phénotype BPCO selon le GOLD 2021.
La vaccination antigrippale et anti-pneumococcique
Le vaccin antigrippal s’administre par voie sous-cutanée ou intramusculaire. Sa composition est définie chaque année afin de s’adapter aux virus grippaux qui circulent [63].
Il est recommandé d’initier la vaccination antipneumococcique par un vaccin conjugué (PCV13), suivie d’un vaccin polysaccharidique (PPSV23) 8 semaines plus tard (G1B), une revaccination est recommandée 5 ans plus tard par le PPSV23, quel que soit le schéma vaccinal antipneumococcique.
La réhabilitation respiratoire
Elle comprend en général un entraînement à l’effort, un programme d’arrêt du tabac, des conseils diététiques et un enseignement thérapeutique.
Sa durée minimale est de 6 semaines ; elle peut se faire en ambulatoire ou en milieu hospitalier. Les bénéfices incluent une amélioration de la tolérance à l’effort, une diminution de la sensation de dyspnée, une réduction du nombre et de la durée des hospitalisations et une diminution des troubles de l’humeur comme la dépression et l’anxiété [82].
Evolution-pronostic des exacerbations aigus de BPCO
Selon le GOLD 2021 au cours des exacerbations de la BPCO les symptômes durent généralement entre 7 et 10 jours, mais certaines exacerbations peuvent durer plus longtemps. 20% des patients ne retrouvent pas leurs état de base après 8 semaines ; la survenue d’une exacerbation entraine la progression de la BPCO et cette dernière est plus probable si l’exacerbation dure plus longtemps, la survenu d’une exacerbation augmente le risque d’un prochain événement. La mortalité intra-hospitalière lors des exacerbations aigues de
BPCO varie entre 2.5 et 30% [83].
La fréquence des exacerbations influence la mortalité: 50% de décès à 5 ans chez les patients présentant une à deux exacerbations par an, et 70% chez ceux présentant trois exacerbations ou plus par an [84].
Les principales causes de mortalité chez les patients atteints de BPCO sont l’insuffisance respiratoire et les maladies cardiovasculaires qui sont responsables de 20 à 40 % des décès.
Par ailleurs, la mortalité dans la BPCO augmente avec le degré de l’obstruction bronchique; elle est évaluée à 50% chez les patients dont le VEMS est à 50% et augmente à 60% chez les patients ayant un VEMS <40% [85].
La BPCO est une pathologie respiratoire à grand impact socioéconomique et sanitaire. L’exacerbation de BPCO contribue au déclin de la fonction pulmonaire et augmente la morbi-mortalité des patients atteints.
Les infections respiratoires constituent la principale cause d’exacerbation aigue de BPCO, et peuvent être d’origine bactérienne ou virale.
La prise en charge thérapeutique de l’exacerbation repose sur l’association de l’ oxygénothérapie titrée, les bronchodilatateurs en nébulisation et la corticothérapie systémique, et la ventilation non invasive (VNI) en première intention si indication.
La prévention des exacerbations de BPCO est fondamental et consiste avant tout sur un traitement de fond adapté au stade de BPCO avec une bonne éducation du patient en insistant sur l’importance d’observance thérapeutique, une vaccination antigrippale et antipneumoccocique et une bonne réhabilitation respiratoire.
La vaccination antigrippale et anti-pneumococcique
Le vaccin antigrippal s’administre par voie sous-cutanée ou intramusculaire. Sa composition est définie chaque année afin de s’adapter aux virus grippaux qui circulent [63].
Il est recommandé d’initier la vaccination antipneumococcique par un vaccin conjugué (PCV13), suivie d’un vaccin polysaccharidique (PPSV23) 8 semaines plus tard (G1B), une revaccination est recommandée 5 ans plus tard par le PPSV23, quel que soit le schéma vaccinal antipneumococcique.
La réhabilitation respiratoire
Elle comprend en général un entraînement à l’effort, un programme d’arrêt du tabac, des conseils diététiques et un enseignement thérapeutique.
Sa durée minimale est de 6 semaines ; elle peut se faire en ambulatoire ou en milieu hospitalier. Les bénéfices incluent une amélioration de la tolérance à l’effort, une diminution de la sensation de dyspnée, une réduction du nombre et de la durée des hospitalisations et une diminution des troubles de l’humeur comme la dépression et l’anxiété [82].
Evolution-pronostic des exacerbations aigus de BPCO
Selon le GOLD 2021 au cours des exacerbations de la BPCO les symptômes durent généralement entre 7 et 10 jours, mais certaines exacerbations peuvent durer plus longtemps. 20% des patients ne retrouvent pas leurs état de base après 8 semaines ; la survenue d’une exacerbation entraine la progression de la BPCO et cette dernière est plus probable si l’exacerbation dure plus longtemps, la survenu d’une exacerbation augmente le risque d’un prochain événement. La mortalité intra-hospitalière lors des exacerbations aigues de BPCO varie entre 2.5 et 30% [83].
La fréquence des exacerbations influence la mortalité: 50% de décès à 5 ans chez les patients présentant une à deux exacerbations par an, et 70% chez ceux présentant trois exacerbations ou plus par an [84]. Les principales causes de mortalité chez les patients atteints de BPCO sont l’insuffisance respiratoire et les maladies cardiovasculaires qui sont responsables de 20 à 40 % des décès. Par ailleurs, la mortalité dans la BPCO augmente avec le degré de l’obstruction bronchique; elle est évaluée à 50% chez les patients dont le VEMS est à 50% et augmente à 60% chez les patients ayant un VEMS <40% [85].
La BPCO est une pathologie respiratoire à grand impact socioéconomique et sanitaire. L’exacerbation de BPCO contribue au déclin de la fonction pulmonaire et augmente la morbi-mortalité des patients atteints.
Les infections respiratoires constituent la principale cause d’exacerbation aigue de BPCO, et peuvent être d’origine bactérienne ou virale[85]. La prise en charge thérapeutique de l’exacerbation repose sur l’association de l’ oxygénothérapie titrée, les bronchodilatateurs en nébulisation et la corticothérapie systémique, et la ventilation non invasive (VNI) en première intention si indication.
La prévention des exacerbations de BPCO est fondamental et consiste avant tout sur un traitement de fond adapté au stade de BPCO avec une bonne éducation du patient en insistant sur l’importance d’observance thérapeutique, une vaccination antigrippale et antipneumoccocique et une bonne réhabilitation respiratoire .
CONCLUSION
La BPCO est une pathologie respiratoire à grand impact socioéconomique et sanitaire. L’exacerbation de BPCO contribue au déclin de la fonction pulmonaire et augmente la morbi-mortalité des patients atteints.
Les infections respiratoires constituent la principale cause d’exacerbation aigue de BPCO, et peuvent être d’origine bactérienne ou virale.
La prise en charge thérapeutique de l’exacerbation repose sur l’association de l’ oxygénothérapie titrée, les bronchodilatateurs en nébulisation et la corticothérapie systémique, et la ventilation non invasive (VNI) en première intention si indication.
La prévention des exacerbations de BPCO est fondamental et consiste avant tout sur un traitement de fond adapté au stade de BPCO avec une bonne éducation du patient en insistant sur l’importance d’observance thérapeutique, une vaccination antigrippale et antipneumoccocique et une bonne réhabilitation respiratoire .
CONFLICT OF INTERESTS
Non.
REFERENCE
| 1. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease2019 report [internet] 2021. |
| 2. Kim v, zhao h, regan e, han mk, make bj, crapo jd, et al. |
| 3. The st. George’s respiratory questionnaire definition of chronic bronchitis may be a better predictor of copd exacerbations compared with the classic definition. Chest. Oct 2019; 156(4):685‑95. |
| 4. Thurlbeck WM, Müller NL. Emphysema: definition, imaging, and quantification. Am J Roentgenol. nov 1994;163(5):1017‑25. |
| 5. Global Initiative for Chronic Obstructive Lung Disease The global strategy for diagnosis, management and prevention of COPD: (2014). |
| 6. Mannino DM, Gagnon RC, Petty TL, Lydick E. Obstructive lung diseaseand low lung function in adults in the United States: data from the NationalHealth and Nutrition. |
| 7. Examination Survey, 1988-1994. Arch Intern Med 2000;160:168 .Rudolf M. The reality of drug use in COPD. Chest 2000;117:29S-32S 3-9. |
| 8. Rudolf M. The reality of drug use in COPD. Chest 2000;117:29S-32S. |
| 9. Feenstra TL, van Genugten ML, Hoogenveen RT, Wouters EF, Rutten-vanMolken MP. The impact of aging and smoking on the future burden of chronicobstructive pulmonary disease: a model analysis in the Netherlands. Am J RespirCrit Care Med 2001;164:590-6. |
| 8. Mathers CD, Loncar D.Projections of Global Mortality and Burden of Disease from 2002 to 2030. Samet J, éditeur. PLoS Med. 28 nov 2006; 3(11):e442. |
| 9. Siddharthan T, Pollard SL, Quaderi SA, Mirelman AJ, Cárdenas MK, Kirenga B, et al. Effectiveness-implementation of COPD case finding and self-management action plans in low and middle-income countries: global excellence in COPD outcomes (GECo) study protocol. Trials. 19 oct 2018;19(1):571. |
| 10. Barnes PJ. Cellular and molecular mechanisms of chronic obstructive pulmonary disease. Clin Chest Med. 2014 Mar;35(1):71-86. Rennard SI, Wachenfeldt Kv. |
| 11. Rationale and emerging approaches for targeting lung repair and regeneration in the treatment of chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2011 Aug;8(4):368-75. |
| 12. Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016 Jul;138(1):16-27. |
| 13. Stockley RA. Neutrophils and protease/antiprotease imbalance. Am J Respir Crit Care Med. 1999 Nov;160(5 Pt 2):S49-52. |
| 14. Dev D, Wallace E, Sankaran R, Cunniffe J, Govan JR, Wathen CG, Emmanuel FX: Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease. Respir Med. 1998, 92: 664-667. |
| 15. Qiu Y, Zhu J, Bandi V, Atmar RL, Hattotuwa K, Guntupalli KK, Jeffery PK: Biopsy neutrophilia, neutrophil chemokine and receptor gene expression in severe exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003, 168: 968-975. |
| 16. Papi A, Bellettato CM, Braccioni F, Romagnoli M, Casolari P, Caramori G, Fabbri . Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med. 2006, 173: 1114-1121. |
| 17. Dizdari P.-O. Bridevaux P. Leuenberger. Rôle des bactéries dans les exacerbations de la BPCO Rev Med Suisse 2004; volume 0. 24137. |
| 18. Omar Kherad, Pierre-Olivier Bridevaux, Jean-Paul Janssens, Laurent Kaiser, Rôle des infections virales dans les exacerbations de bronchopneumopathie chronique obstructive (BPCO)Rev Med Suisse 2011; volume 7.2222-2226. |
| 19. Emmanuel Weitzenblum. Physiopathologie de la décompensation de l’insuffisance respiratoire chronique, John Libbey, Volume 6, numéro 2. 200. |
| 20. S. Jouneau. Facteurs déclenchant des exacerbations de BPCO Revue des Maladies Respiratoires Volume 34, numéro 4pages 343-348 (avril 2017). |
| 21. MacNee W, Donaldson K. Exacerbations of COPD: Environmental mechanisms. Chest 2000;117:390S-397S. |
| 22. B Delclaux. Exacerbations de BPCO : signes de gravité et facteurs pronostiques, Revue des maladies respiratoires, Volume 34, numéro 4, pages 353–358, 2017. |
| 23. World Health Organization. Chronic Obstructive Pulmonary Disease. WHO ; 2017 . |
| 24. Pascoe S, Locantore N, Dransfield MT, Barnes NC, Pavord ID. Blood eosinophil counts, exacerbations, and response to the addition of inhaled fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease: a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir Med. 2015 Jun;3(6):435-42. |
| 25. Jouneau S, Dres M, Guerder A, Bele N, Bellocq A, Bernady A, et al. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue française (summary). Rev Mal Respir. avr 2017;34(4):282‑322. |
| 26. Snow V., Laschner S., Mottur-Pilson C. Evidence base for the management of acute exacerbations of chronic obstructive pulmonary disease Ann Intern Med 2001; 134: 595-599. |
| 27. Jébrak G.Quelles sont les investigations nécessaires lors d’une exacerbation de BPCO chez un patienthospitalisé?Rev Mal Respir. 2017;34(4):375‑81. |
| 28. B Delclaux. Exacerbations de BPCO : signes de gravité et facteurs pronostiques, Revue des maladies respiratoires, Volume 34, numéro 4, pages 353–35. |
| 29. Maclay JD, McAllister DA, Johnston S, Raftis J, McGuinnes C, Deans A, et al. Increased platelet activation in patients with stable and acute exacerbation of COPD. Thorax. 1 sept 2011;66(9) :769‑74. |
| 30. Martinez-Rivera C, Portillo K, Muñoz-Ferrer A, Martínez-Ortiz ML, [30] Molins E, [30] Serra P, et al.Anemia is a Mortality Predictor in Hospitalized Patients for COPD Exacerbation. COPD J Chronic Obstr Pulm Dis. 23 mai 2012;9(3):243‑50:769‑74. |
| 31. Brusse-Keizer M.G., Grotenhuis A.J., Kerstjens H.A. Relation of sputum colour to bacterial load in acute exacerbations of COPD Respir Med 2009 ; 103 : 601-606 8, 2017. |
| 32. Clark TW, Medina M-J, Batham S, Curran MD, Parmar S, Nicholson KG. C-reactive protein level and microbial aetiology in patients hospitalised with acute exacerbation of COPD. Eur Respir J. janv 2015;45(1):76‑86. |
| 33. Dev D, Wallace E, Sankaran R, Cunniffe J, Govan JRW, Wathen CG, et al. Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease.Respir Med. avr 1998;92(4):664‑7. |
| 34. Stolz D., Christ-Crain M., Morgenthaler N.G. Copeptin, C-reactive protein, and procalcitonin as prognostic biomarkers in acute exacerbation of COPD Chest 2007 ; 131 : 1058-1067. |
| 35. Schuetz P., Christ-Crain M., Thomann R. Effect of procalcitonin-based guidelines vs. standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial JAMA 2009 ; 302 : 1059-1066. |
| 36. Januzzi J.L., Camargo C.A., Anwaruddin S. The N-terminal ProBNP investigation of dyspnea in the emergency department (PRIDE) study Am J Cardiol 2005 ; 95 : 948-954 [inter-ref] |
| 37. Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long-term survival after acute myocardial infarction. Comparison with plasma atrial natriuretic peptide and N-terminal proatrial natriuretic peptide Circulation 1996 ; 93 : 1963-1969. |
| 38. Maisel A.S., Krishnaswamy P., Nowak R.M. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure N Engl J Med 2002 ; 347 : 161-167 . |
| 39. McCullough P.A., Hollander J.E., Nowak R.M. Uncovering heart failure in patients with a history of pulmonary disease: rationale for the early use of B-type natriuretic peptide in the emergency department Acad Emerg Med 2003 ; 10 : 198-204. |
| 40. Dunn KL, Wolf JP, Dorfman DM, Fitzpatrick P, Baker JL, Goldhaber SZ. Normal d-dimer levels in emergency department patients suspected of acute pulmonary embolism. J Am Coll Cardiol. oct 2002;40(8):1475‑8. |
| 41. Pourmand A, Robinson H, Mazer-Amirshahi M, Pines JM. Pulmonary Embolism Among Patients With Acute Exacerbation Of Chronic Obstructive Pulmonary Disease: Implications For Emergency Medicine.J Emerg Med. sept 2018;55(3):339‑46. |
| 42. Küpeli E, Ulubay G, Ulasli SS, Sahin T, Erayman Z, Gürsoy A. Metabolic Syndrome is associated with increased risk of acute exacerbation of COPD: a preliminary study. Endocrine. août 2010;38(1):76‑82. |
| 43. Parappil A, Depczynski B, Collett P, Marks GB. Effect of comorbid diabetes on length of stay and risk of death in patients admitted with acute exacerbations of COPD: Length of stay in AECOPD with DM. Respirology. 4 juin 2010;15(6):918‑22. |
| 44. Cafferky N, Shah H-A, Murphy S. Vitamin-D deficiency & anaemia in patients with acute exacerbations of COPD (AECOPD); morbidity & mortality. In: Clinical Problems [Internet]. European Respiratory Society; 2018 [cité 18 janv 2020]. p. PA3855. Disponible sur: http://erj.ersjournals.com/lookup/doi/10.1183/13993003.congress-2018.PA3855 |
| 45. S. Jouneau, M. Dres, A. Guerder, N. Bele, ... N. Roche. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue française ,2017. |
| 46. Groenewegen KH, Wouters EFM. Bacterial infections in patients requiring admission for an acute exacerbation of COPD; a 1-year prospective study. Respir Med. juill 2003;97(7):770‑7. |
| 47. Pulmonary disease (AE-COPD) and the usefulness of analytical and clinical parameters in its identification (VIRAE study). Int J Chron Obstruct Pulmon Dis. mai 2012; 327. |
| 48. Terzano C., Romani S., Gaudio C. Right heart functional changes in the acute, hypercapnic exacerbations of COPD Biomed Res Int 2014 ; 2014 : 596051.[49] Jouneau S, Dres M, Guerder A, Bele N, Bellocq A, Bernady A, et al. |
| 49. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD).Guidelines from the Société de pneumologie de langue française (summary). Rev Mal Respir. avr 2017;34(4):282‑322. |
| 50. A. Cuvelie. Exacerbations des BPCO : le temps passe, les conceptions doivent évoluer revue des Maladies Respiratoires Vol 20, N° 5-C2 novembre 2003. |
| 51. Seemungal T, Harper-Owen R, Bhowmik A, Moric I, Sanderson. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001. |
| 52. Wedzicha JA, Singh R, Mackay AJ. Acute COPD Exacerbations. Clin Chest Med. mars 2014;35(1):157‑63. 30. Sadhra S, Kurmi OP, Sadhra SS, Lam KBH, Ayres JG. |
| 53. Boixeda R, Rabella, Sauca, Delgado, Martínez-Costa, Mauri, et al. Microbiological study of patients hospitalized for acute exacerbation of chronic obstructive pulmonary disease (AE-COPD) and the usefulness of analytical and clinical parameters in its identification (VIRAE study). Int J Chron Obstruct Pulmon Dis. mai 2012;327. |
| 54. Dev D, Wallace E, Sankaran R, Cunniffe J, Govan JRW, Wathen CG, et al. Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease.Respir Med. avr 1998; 92(4):664‑7. |
| 55. Akpinar EE, Hosgun D, Akpynar S, Atac GK, Doganay B, Gulhan M. Incidence of pulmonary embolism during COPD exacerbation. J Bras Pneumol. janv 2014;40(1):38‑45. |
| 56. A. Perrier, T. Perneger, J. Cornuz, V. Jounieaux, H. Bounameau. Étude BPCO-EP : prévalence et prédiction de l'embolie pulmonaire dans l'exacerbation de la broncho-pneumopathie chronique obstructive ... 2004. |
| 57. Mispelaere D, Glerant JC, Audebert M, Remond A, Sevestre-Pietri. Embolie pulmonaire et bronchospasme des bronchopneumopathies obstructives. Rev Mal Respir 2002 ; 19 : 415-23. |
| 58. Zvezdin B, Milutinov S, Kojicic M, Hadnadjev M, Hromis S, Markovic M, et al. A Postmortem Analysis of Major Causes of Early Death in Patients Hospitalized With COPD. Exacerbation. Chest. août 2009;136(2):376‑80. |
| 59. Sidney S, Sorel M, Quesenberry CP, DeLuise C, Lanes S, Eisner MD. COPD and Incident Cardiovascular Disease Hospitalizations and Mortality: Kaiser PermanenteMedical Care Program.Chest. oct 2005;128(4):2068‑75. |
| 60. Bronchopneumopathie chronique obstructive (BPCO). Réanimation.janv2014;23(S1):248‑51. |
| 61. S. Jouneau. Facteurs déclenchant des exacerbations de BPCO Revue des Maladies Respiratoires Volume 34, numéro 4pages 343-348 (avril 2017). |
| 62. Global Initiative for Chronic Obstructive Lung Disease, Inc. .... The assessment of COPD proposed by GOLD has been based on the patient's level of.2018. |
| 63. S. Jouneau, M. Dres, A. Guerder, N. Bele, ... N. Roche. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue française ,2017 |
| 64. Osadnik CR, Tee VS, Carson-Chahhoud KV, Picot J, Wedzicha JA, Smith BJ. Non-invasive ventilation for the management of acute hypercapnic respiratory failure due to exacerbation of chronic obstructive pulmonary disease. Cochrane Airways Group, éditeur. Cochrane Database Syst Rev [Internet]. 13 juill 2017 [cité 27] janv 2020]; Disponible sur: http://doi.wiley.com/10.1002/14651858.CD004104.pub4. |
| 65. Chandra D, Stamm JA, Taylor B, Ramos RM, Satterwhite L, Krishnan JA, et al. Outcomes of noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease in the United States, 1998-2008. Am J Respir Crit Care Med. 15 janv 2012;185(2):152‑9. |
| 66. Esteban A.Characteristics and Outcomes in Adult Patients Receiving Mechanical VentilationA 28-Day International Study. JAMA. 16 janv 2002;287(3):345. |
| 67. Nevins ML, Epstein SK. Predictors of Outcome for Patients With COPD Requiring Invasive Mechanical Ventilation. Chest. juin 2001;119(6):1840‑9. |
| 68. Menzies R, Gibbons W, Goldberg P. Determinants of Weaning and Survival Among Patients with COPD Who Require Mechanical. Ventilation for Acute Respiratory Failure. Chest. févr 1989;95(2):398‑405. |
| 69. Boles J-M, Bion J, Connors A, Herridge M, Marsh B, Melot C, et al. Weaning from mechanical ventilation. Eur Respir J. 1 mai 2007;29(5):1033‑56. |
| 70. Girault C. Non-invasive ventilation for weaning from mechanical ventilation and post-extubation acute respiratory failure. Non-invasive ventilation. 2e ed. Eur Respir Monog 2009; 41: 143-153. |
| 71. Hess D.R. The role of non-invasive ventilation in the ventilator discontinuation process Resp Care 2012; 57 : 1619-1625 119. |
| 72. Seidenfeld J.J., Jones W.N., Moss R.E., Tremper J. Intravenous aminophylline in the treatment of acute bronchospastic excerbations of COPD Ann Intern Med 1984; 3: 248-252 . |
| 73. Rice K., Leatherman J., Duane P.G. Aminophylline for acute exacerbations of chronic obstructive pulmonary disease: a controlled trial Ann Intern Med 1987; 107. |
| 74. Niewoehner DE, Erbland ML, Deupree RH, Collins D, Gross NJ,Light RW, Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease. Department of Veterans Affairs Cooperative Study Group. N Engl J Med1999;340:1941—7. |
| 76. Stolz D., Christ-Crain M., Morgenthaler N.G. Copeptin, C-reactive protein, and procalcitonin as prognostic biomarkers in acute exacerbation of COPD Chest 2007 ; 131 : 1058-1067. |
| 77. Effect of procalcitonin-based guidelines vs. standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial JAMA 2009 ; 302 : 1059-1066. |
| 78. Fraisse F., Hozapfel L., Coulaud L.M., Simmoneau G., Bedock B., Feissel M., Nadroparine in the prevention of deep venous thrombosis in acute decompensated COPD Am J Respir Crit Care Med 2000 ; 161 : 1109-1114 |
| 79. Samama M.M., Cohen A.T., Darmon J.Y. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients N Engl J Med 1999 ; 341 : 793-800. |
| 80. A Rabbat, A Guetta, C Lorut, A Lefebvre. Prise en charge des exacerbations aiguës de - Revue des maladies …, 2010 - Elsevier. |
| 81. Kew KM, Mavergames C, Walters JA. Long-acting beta2-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2013; 10(10): CD010177. |
| 82. Nannini LJ, Lasserson TJ, Poole P. Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012; 9(9): CD006829. |
| 83. McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. The Cochrane database of systematic reviews. 2015. |
| 84. J.-M. Chavaillon. Mortalité intrahospitalière au cours des exacerbations aiguës de BPCO. Étude EABPCOCPHG du Collège des pneumologues des hôpitaux généraux (CPHG) , Revue des Maladies Respiratoires 27, no 7 (septembre 2010): 709-16. |
| 85. S Birolleau Traitement de l'exacerbation de la bronchopneumopathie chronique ... 2012. |
| 86. Anthonisen NR, Skeans MA, Wise RA, Manfreda J, Kanner RE. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 2005;142:233 |
FIGURE - TABLES
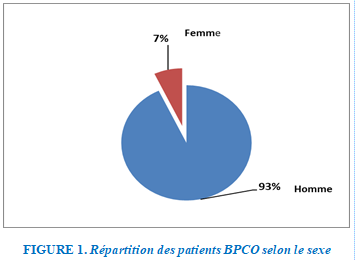
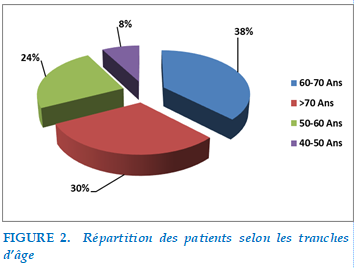
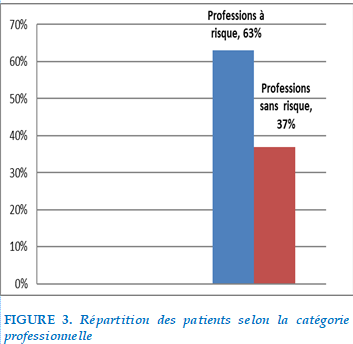
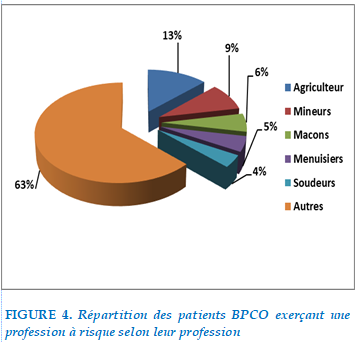
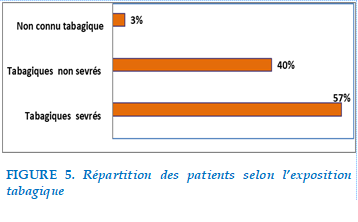
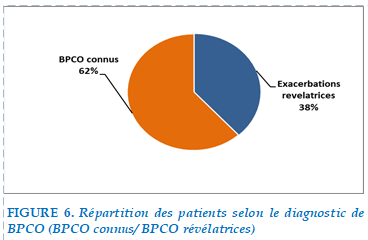
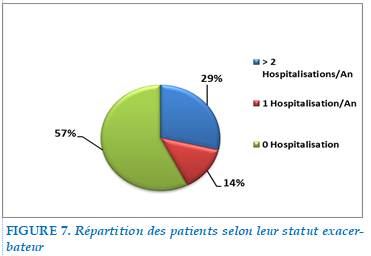
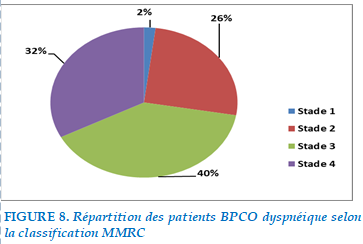
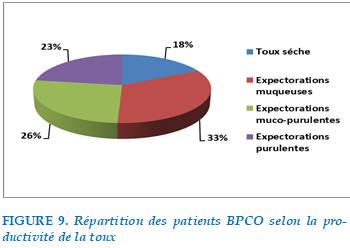
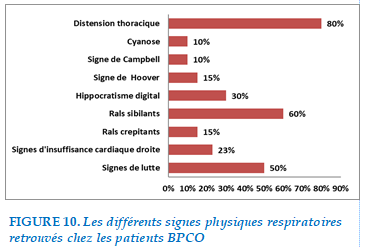
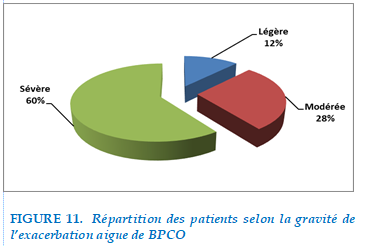
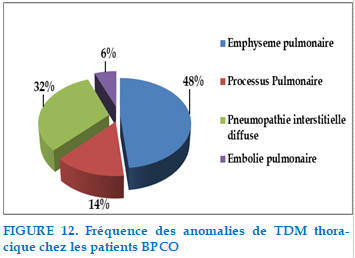
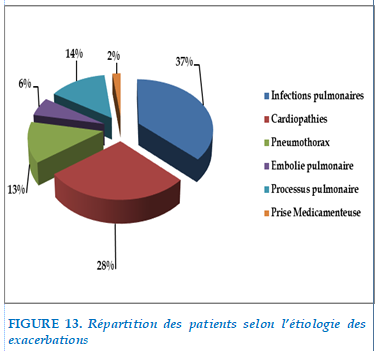
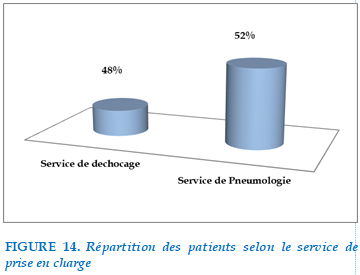
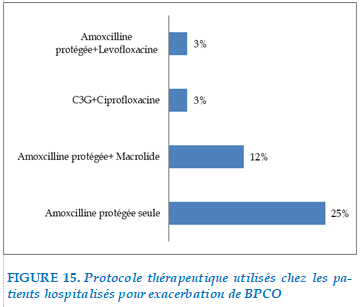
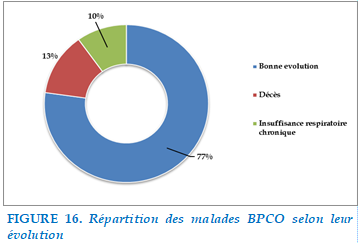
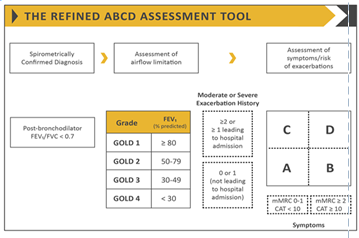
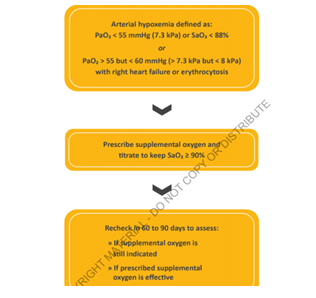
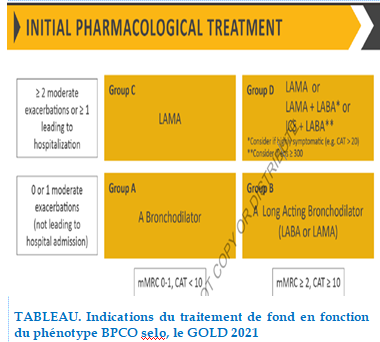
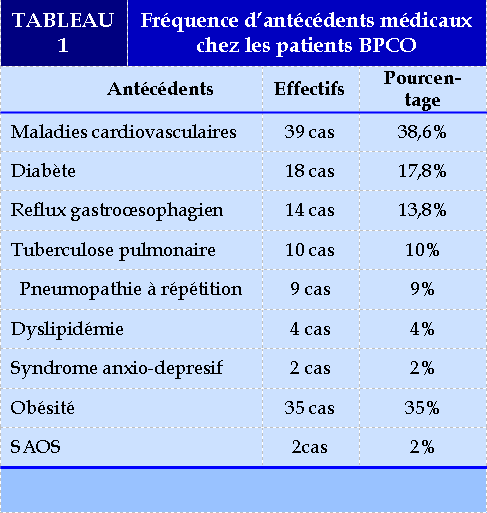
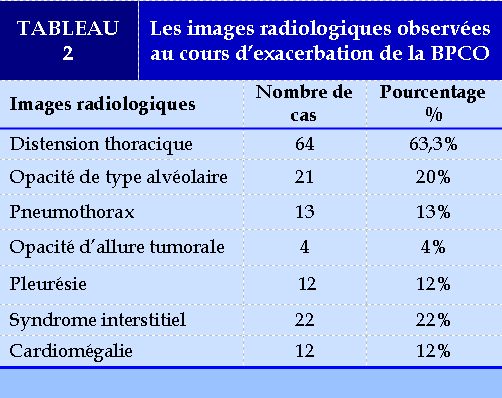

REFERENCE
| 1. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease2019 report [internet] 2021. |
| 2. Kim v, zhao h, regan e, han mk, make bj, crapo jd, et al. |
| 3. The st. George’s respiratory questionnaire definition of chronic bronchitis may be a better predictor of copd exacerbations compared with the classic definition. Chest. Oct 2019; 156(4):685‑95. |
| 4. Thurlbeck WM, Müller NL. Emphysema: definition, imaging, and quantification. Am J Roentgenol. nov 1994;163(5):1017‑25. |
| 5. Global Initiative for Chronic Obstructive Lung Disease The global strategy for diagnosis, management and prevention of COPD: (2014). |
| 6. Mannino DM, Gagnon RC, Petty TL, Lydick E. Obstructive lung diseaseand low lung function in adults in the United States: data from the NationalHealth and Nutrition. |
| 7. Examination Survey, 1988-1994. Arch Intern Med 2000;160:168 .Rudolf M. The reality of drug use in COPD. Chest 2000;117:29S-32S 3-9. |
| 8. Rudolf M. The reality of drug use in COPD. Chest 2000;117:29S-32S. |
| 9. Feenstra TL, van Genugten ML, Hoogenveen RT, Wouters EF, Rutten-vanMolken MP. The impact of aging and smoking on the future burden of chronicobstructive pulmonary disease: a model analysis in the Netherlands. Am J RespirCrit Care Med 2001;164:590-6. |
| 8. Mathers CD, Loncar D.Projections of Global Mortality and Burden of Disease from 2002 to 2030. Samet J, éditeur. PLoS Med. 28 nov 2006; 3(11):e442. |
| 9. Siddharthan T, Pollard SL, Quaderi SA, Mirelman AJ, Cárdenas MK, Kirenga B, et al. Effectiveness-implementation of COPD case finding and self-management action plans in low and middle-income countries: global excellence in COPD outcomes (GECo) study protocol. Trials. 19 oct 2018;19(1):571. |
| 10. Barnes PJ. Cellular and molecular mechanisms of chronic obstructive pulmonary disease. Clin Chest Med. 2014 Mar;35(1):71-86. Rennard SI, Wachenfeldt Kv. |
| 11. Rationale and emerging approaches for targeting lung repair and regeneration in the treatment of chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2011 Aug;8(4):368-75. |
| 12. Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016 Jul;138(1):16-27. |
| 13. Stockley RA. Neutrophils and protease/antiprotease imbalance. Am J Respir Crit Care Med. 1999 Nov;160(5 Pt 2):S49-52. |
| 14. Dev D, Wallace E, Sankaran R, Cunniffe J, Govan JR, Wathen CG, Emmanuel FX: Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease. Respir Med. 1998, 92: 664-667. |
| 15. Qiu Y, Zhu J, Bandi V, Atmar RL, Hattotuwa K, Guntupalli KK, Jeffery PK: Biopsy neutrophilia, neutrophil chemokine and receptor gene expression in severe exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003, 168: 968-975. |
| 16. Papi A, Bellettato CM, Braccioni F, Romagnoli M, Casolari P, Caramori G, Fabbri . Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med. 2006, 173: 1114-1121. |
| 17. Dizdari P.-O. Bridevaux P. Leuenberger. Rôle des bactéries dans les exacerbations de la BPCO Rev Med Suisse 2004; volume 0. 24137. |
| 18. Omar Kherad, Pierre-Olivier Bridevaux, Jean-Paul Janssens, Laurent Kaiser, Rôle des infections virales dans les exacerbations de bronchopneumopathie chronique obstructive (BPCO)Rev Med Suisse 2011; volume 7.2222-2226. |
| 19. Emmanuel Weitzenblum. Physiopathologie de la décompensation de l’insuffisance respiratoire chronique, John Libbey, Volume 6, numéro 2. 200. |
| 20. S. Jouneau. Facteurs déclenchant des exacerbations de BPCO Revue des Maladies Respiratoires Volume 34, numéro 4pages 343-348 (avril 2017). |
| 21. MacNee W, Donaldson K. Exacerbations of COPD: Environmental mechanisms. Chest 2000;117:390S-397S. |
| 22. B Delclaux. Exacerbations de BPCO : signes de gravité et facteurs pronostiques, Revue des maladies respiratoires, Volume 34, numéro 4, pages 353–358, 2017. |
| 23. World Health Organization. Chronic Obstructive Pulmonary Disease. WHO ; 2017 . |
| 24. Pascoe S, Locantore N, Dransfield MT, Barnes NC, Pavord ID. Blood eosinophil counts, exacerbations, and response to the addition of inhaled fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease: a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir Med. 2015 Jun;3(6):435-42. |
| 25. Jouneau S, Dres M, Guerder A, Bele N, Bellocq A, Bernady A, et al. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue française (summary). Rev Mal Respir. avr 2017;34(4):282‑322. |
| 26. Snow V., Laschner S., Mottur-Pilson C. Evidence base for the management of acute exacerbations of chronic obstructive pulmonary disease Ann Intern Med 2001; 134: 595-599. |
| 27. Jébrak G.Quelles sont les investigations nécessaires lors d’une exacerbation de BPCO chez un patienthospitalisé?Rev Mal Respir. 2017;34(4):375‑81. |
| 28. B Delclaux. Exacerbations de BPCO : signes de gravité et facteurs pronostiques, Revue des maladies respiratoires, Volume 34, numéro 4, pages 353–35. |
| 29. Maclay JD, McAllister DA, Johnston S, Raftis J, McGuinnes C, Deans A, et al. Increased platelet activation in patients with stable and acute exacerbation of COPD. Thorax. 1 sept 2011;66(9) :769‑74. |
| 30. Martinez-Rivera C, Portillo K, Muñoz-Ferrer A, Martínez-Ortiz ML, [30] Molins E, [30] Serra P, et al.Anemia is a Mortality Predictor in Hospitalized Patients for COPD Exacerbation. COPD J Chronic Obstr Pulm Dis. 23 mai 2012;9(3):243‑50:769‑74. |
| 31. Brusse-Keizer M.G., Grotenhuis A.J., Kerstjens H.A. Relation of sputum colour to bacterial load in acute exacerbations of COPD Respir Med 2009 ; 103 : 601-606 8, 2017. |
| 32. Clark TW, Medina M-J, Batham S, Curran MD, Parmar S, Nicholson KG. C-reactive protein level and microbial aetiology in patients hospitalised with acute exacerbation of COPD. Eur Respir J. janv 2015;45(1):76‑86. |
| 33. Dev D, Wallace E, Sankaran R, Cunniffe J, Govan JRW, Wathen CG, et al. Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease.Respir Med. avr 1998;92(4):664‑7. |
| 34. Stolz D., Christ-Crain M., Morgenthaler N.G. Copeptin, C-reactive protein, and procalcitonin as prognostic biomarkers in acute exacerbation of COPD Chest 2007 ; 131 : 1058-1067. |
| 35. Schuetz P., Christ-Crain M., Thomann R. Effect of procalcitonin-based guidelines vs. standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial JAMA 2009 ; 302 : 1059-1066. |
| 36. Januzzi J.L., Camargo C.A., Anwaruddin S. The N-terminal ProBNP investigation of dyspnea in the emergency department (PRIDE) study Am J Cardiol 2005 ; 95 : 948-954 [inter-ref] |
| 37. Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long-term survival after acute myocardial infarction. Comparison with plasma atrial natriuretic peptide and N-terminal proatrial natriuretic peptide Circulation 1996 ; 93 : 1963-1969. |
| 38. Maisel A.S., Krishnaswamy P., Nowak R.M. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure N Engl J Med 2002 ; 347 : 161-167 . |
| 39. McCullough P.A., Hollander J.E., Nowak R.M. Uncovering heart failure in patients with a history of pulmonary disease: rationale for the early use of B-type natriuretic peptide in the emergency department Acad Emerg Med 2003 ; 10 : 198-204. |
| 40. Dunn KL, Wolf JP, Dorfman DM, Fitzpatrick P, Baker JL, Goldhaber SZ. Normal d-dimer levels in emergency department patients suspected of acute pulmonary embolism. J Am Coll Cardiol. oct 2002;40(8):1475‑8. |
| 41. Pourmand A, Robinson H, Mazer-Amirshahi M, Pines JM. Pulmonary Embolism Among Patients With Acute Exacerbation Of Chronic Obstructive Pulmonary Disease: Implications For Emergency Medicine.J Emerg Med. sept 2018;55(3):339‑46. |
| 42. Küpeli E, Ulubay G, Ulasli SS, Sahin T, Erayman Z, Gürsoy A. Metabolic Syndrome is associated with increased risk of acute exacerbation of COPD: a preliminary study. Endocrine. août 2010;38(1):76‑82. |
| 43. Parappil A, Depczynski B, Collett P, Marks GB. Effect of comorbid diabetes on length of stay and risk of death in patients admitted with acute exacerbations of COPD: Length of stay in AECOPD with DM. Respirology. 4 juin 2010;15(6):918‑22. |
| 44. Cafferky N, Shah H-A, Murphy S. Vitamin-D deficiency & anaemia in patients with acute exacerbations of COPD (AECOPD); morbidity & mortality. In: Clinical Problems [Internet]. European Respiratory Society; 2018 [cité 18 janv 2020]. p. PA3855. Disponible sur: http://erj.ersjournals.com/lookup/doi/10.1183/13993003.congress-2018.PA3855 |
| 45. S. Jouneau, M. Dres, A. Guerder, N. Bele, ... N. Roche. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue française ,2017. |
| 46. Groenewegen KH, Wouters EFM. Bacterial infections in patients requiring admission for an acute exacerbation of COPD; a 1-year prospective study. Respir Med. juill 2003;97(7):770‑7. |
| 47. Pulmonary disease (AE-COPD) and the usefulness of analytical and clinical parameters in its identification (VIRAE study). Int J Chron Obstruct Pulmon Dis. mai 2012; 327. |
| 48. Terzano C., Romani S., Gaudio C. Right heart functional changes in the acute, hypercapnic exacerbations of COPD Biomed Res Int 2014 ; 2014 : 596051.[49] Jouneau S, Dres M, Guerder A, Bele N, Bellocq A, Bernady A, et al. |
| 49. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD).Guidelines from the Société de pneumologie de langue française (summary). Rev Mal Respir. avr 2017;34(4):282‑322. |
| 50. A. Cuvelie. Exacerbations des BPCO : le temps passe, les conceptions doivent évoluer revue des Maladies Respiratoires Vol 20, N° 5-C2 novembre 2003. |
| 51. Seemungal T, Harper-Owen R, Bhowmik A, Moric I, Sanderson. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001. |
| 52. Wedzicha JA, Singh R, Mackay AJ. Acute COPD Exacerbations. Clin Chest Med. mars 2014;35(1):157‑63. 30. Sadhra S, Kurmi OP, Sadhra SS, Lam KBH, Ayres JG. |
| 53. Boixeda R, Rabella, Sauca, Delgado, Martínez-Costa, Mauri, et al. Microbiological study of patients hospitalized for acute exacerbation of chronic obstructive pulmonary disease (AE-COPD) and the usefulness of analytical and clinical parameters in its identification (VIRAE study). Int J Chron Obstruct Pulmon Dis. mai 2012;327. |
| 54. Dev D, Wallace E, Sankaran R, Cunniffe J, Govan JRW, Wathen CG, et al. Value of C-reactive protein measurements in exacerbations of chronic obstructive pulmonary disease.Respir Med. avr 1998; 92(4):664‑7. |
| 55. Akpinar EE, Hosgun D, Akpynar S, Atac GK, Doganay B, Gulhan M. Incidence of pulmonary embolism during COPD exacerbation. J Bras Pneumol. janv 2014;40(1):38‑45. |
| 56. A. Perrier, T. Perneger, J. Cornuz, V. Jounieaux, H. Bounameau. Étude BPCO-EP : prévalence et prédiction de l'embolie pulmonaire dans l'exacerbation de la broncho-pneumopathie chronique obstructive ... 2004. |
| 57. Mispelaere D, Glerant JC, Audebert M, Remond A, Sevestre-Pietri. Embolie pulmonaire et bronchospasme des bronchopneumopathies obstructives. Rev Mal Respir 2002 ; 19 : 415-23. |
| 58. Zvezdin B, Milutinov S, Kojicic M, Hadnadjev M, Hromis S, Markovic M, et al. A Postmortem Analysis of Major Causes of Early Death in Patients Hospitalized With COPD. Exacerbation. Chest. août 2009;136(2):376‑80. |
| 59. Sidney S, Sorel M, Quesenberry CP, DeLuise C, Lanes S, Eisner MD. COPD and Incident Cardiovascular Disease Hospitalizations and Mortality: Kaiser PermanenteMedical Care Program.Chest. oct 2005;128(4):2068‑75. |
| 60. Bronchopneumopathie chronique obstructive (BPCO). Réanimation.janv2014;23(S1):248‑51. |
| 61. S. Jouneau. Facteurs déclenchant des exacerbations de BPCO Revue des Maladies Respiratoires Volume 34, numéro 4pages 343-348 (avril 2017). |
| 62. Global Initiative for Chronic Obstructive Lung Disease, Inc. .... The assessment of COPD proposed by GOLD has been based on the patient's level of.2018. |
| 63. S. Jouneau, M. Dres, A. Guerder, N. Bele, ... N. Roche. Management of acute exacerbations of chronic obstructive pulmonary disease (COPD). Guidelines from the Société de pneumologie de langue française ,2017 |
| 64. Osadnik CR, Tee VS, Carson-Chahhoud KV, Picot J, Wedzicha JA, Smith BJ. Non-invasive ventilation for the management of acute hypercapnic respiratory failure due to exacerbation of chronic obstructive pulmonary disease. Cochrane Airways Group, éditeur. Cochrane Database Syst Rev [Internet]. 13 juill 2017 [cité 27] janv 2020]; Disponible sur: http://doi.wiley.com/10.1002/14651858.CD004104.pub4. |
| 65. Chandra D, Stamm JA, Taylor B, Ramos RM, Satterwhite L, Krishnan JA, et al. Outcomes of noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease in the United States, 1998-2008. Am J Respir Crit Care Med. 15 janv 2012;185(2):152‑9. |
| 66. Esteban A.Characteristics and Outcomes in Adult Patients Receiving Mechanical VentilationA 28-Day International Study. JAMA. 16 janv 2002;287(3):345. |
| 67. Nevins ML, Epstein SK. Predictors of Outcome for Patients With COPD Requiring Invasive Mechanical Ventilation. Chest. juin 2001;119(6):1840‑9. |
| 68. Menzies R, Gibbons W, Goldberg P. Determinants of Weaning and Survival Among Patients with COPD Who Require Mechanical. Ventilation for Acute Respiratory Failure. Chest. févr 1989;95(2):398‑405. |
| 69. Boles J-M, Bion J, Connors A, Herridge M, Marsh B, Melot C, et al. Weaning from mechanical ventilation. Eur Respir J. 1 mai 2007;29(5):1033‑56. |
| 70. Girault C. Non-invasive ventilation for weaning from mechanical ventilation and post-extubation acute respiratory failure. Non-invasive ventilation. 2e ed. Eur Respir Monog 2009; 41: 143-153. |
| 71. Hess D.R. The role of non-invasive ventilation in the ventilator discontinuation process Resp Care 2012; 57 : 1619-1625 119. |
| 72. Seidenfeld J.J., Jones W.N., Moss R.E., Tremper J. Intravenous aminophylline in the treatment of acute bronchospastic excerbations of COPD Ann Intern Med 1984; 3: 248-252 . |
| 73. Rice K., Leatherman J., Duane P.G. Aminophylline for acute exacerbations of chronic obstructive pulmonary disease: a controlled trial Ann Intern Med 1987; 107. |
| 74. Niewoehner DE, Erbland ML, Deupree RH, Collins D, Gross NJ,Light RW, Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease. Department of Veterans Affairs Cooperative Study Group. N Engl J Med1999;340:1941—7. |
| 76. Stolz D., Christ-Crain M., Morgenthaler N.G. Copeptin, C-reactive protein, and procalcitonin as prognostic biomarkers in acute exacerbation of COPD Chest 2007 ; 131 : 1058-1067. |
| 77. Effect of procalcitonin-based guidelines vs. standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial JAMA 2009 ; 302 : 1059-1066. |
| 78. Fraisse F., Hozapfel L., Coulaud L.M., Simmoneau G., Bedock B., Feissel M., Nadroparine in the prevention of deep venous thrombosis in acute decompensated COPD Am J Respir Crit Care Med 2000 ; 161 : 1109-1114 |
| 79. Samama M.M., Cohen A.T., Darmon J.Y. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients N Engl J Med 1999 ; 341 : 793-800. |
| 80. A Rabbat, A Guetta, C Lorut, A Lefebvre. Prise en charge des exacerbations aiguës de - Revue des maladies …, 2010 - Elsevier. |
| 81. Kew KM, Mavergames C, Walters JA. Long-acting beta2-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2013; 10(10): CD010177. |
| 82. Nannini LJ, Lasserson TJ, Poole P. Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012; 9(9): CD006829. |
| 83. McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. The Cochrane database of systematic reviews. 2015. |
| 84. J.-M. Chavaillon. Mortalité intrahospitalière au cours des exacerbations aiguës de BPCO. Étude EABPCOCPHG du Collège des pneumologues des hôpitaux généraux (CPHG) , Revue des Maladies Respiratoires 27, no 7 (septembre 2010): 709-16. |
| 85. S Birolleau Traitement de l'exacerbation de la bronchopneumopathie chronique ... 2012. |
| 86. Anthonisen NR, Skeans MA, Wise RA, Manfreda J, Kanner RE. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 2005;142:233 |
ARTICLE INFO DOI: 10.12699/jfvpulm.13.40.2022.7
Conflict of Interest
Non
Date of manuscript receiving
18/01/2022
Date of publication after correction
18/04/2022
Article citation
Yousfi, S. Guerrouj, A. Thouil, H. Kouismi. Epidemiological, Clinical, Biological and Radioligical Profile of Acute Exacerbations of COPD Apropos of 101 Cases. J Func Vent Pulm 2022;40(12):7-28