
 English
English
 French
French
Non small cell lung cancer surgery - Locally advanced stages
La chirurgie des cancers bronchopulmonaires non à petites cellules - Stades localement avancés
Fatima Zahra Ammor, Marouane Lakranbi, Leila Bellirej, Hicham Harmouchi, Yassine Ouadnouni, Mohammed Smahi
Service de chirurgie thoracique, centre hospitalier universitaire hassan II, Fes, Maroc
Corresponding author:
Ammor Fatima Zahra. Service de chirurgie thoracique, centre hospitalier universitaire hassan II, Fes, Maroc
E-mail: dr.a.ammor@gmail.com
ABSTRACT
Introduction. 75% of lung cancers are diagnosed at an advanced III-IV stage, 30% of which are locally advanced and only 1% of these tumors are operated on, which makes it too controversial a subject, influenced by the poverty of the published series. This is a retrospective study about 17 cases, operated in our training for locally advanced lung cancer.
Results. 16 men and one woman, whose average age was 58.9 years). In the background, we note that all the male patients were smokers, a notion of tuberculosis in 2 cases, and a notion of diabetes in a single case. chest pain was the main symptom in 12 cases, associated with a cough in 10 cases, a notion of hemoptysis in 4 cases, as well as dyspnea in 10 cases, all evolving in a context of AEG and AMG. The radiological assessment and was able to classify the tumors after having made the objective of a discussion in RCP: stage IIB in 8 cases, IIIA in 7 cases, IIIB in one case and stage IVA in 1 case. The surgical approach was a TPLD in 8 cases, a TPLG in 7 cases, a sternotomy in one case as well as a manubriotomy for the tumor of the apex. The immediate postoperative suites were marked by 2 deaths (PAH, gas embolism). During an average follow-up of 4 years, there were 2 patients who were lost to sight and one death after a 3-year survival; on the other hand, a locoregional recurrence objectified in 4 cases (3 pulmonary and one parietal), axillary lymph node in one case, and remote in 3 cases (2 hepatic, 1 bone).
Conclusion. Surgical resection remains the best hope of cure for well-selected locally advanced lung cancers.
KEYWORDS: Lung cancer; NSCLC; Surgical resection; Survival.
RÉSUMÉ
Introduction. 75% des cancers pulmonaires sont diagnostiqué à un stade avancé III-IV dont 30% sont localement avancé et dont seul 1% de ces tumeurs sont opérés, ce qui fait de lui un sujet trop controversé, influencé par la pauvreté des séries publiées. Il s’agit d’une étude rétrospective à propos de 17 cas, opérés dans notre formation pour des cancers pulmonaires localement avancés.
Résultats. 16 hommes et une femme, dont l’âge moyen était de 58,9ans), parmi les antécédents on note que tous les patients de sexe masculin étaient tabagique, une notion de tuberculose dans 2 cas, et une notion de diabète dans un seul cas. la douleur thoracique était le maitre symptôme dans 12 cas, associée à une toux dans 10 cas, une notion d’hémoptysie dans 4 cas, ainsi qu’une dyspnée dans 10 cas, le tout évoluait dans un contexte d’AEG et AMG. Le bilan radiologique et a pu classer les tumeurs après avoir fait l’objectif d’une discussion en RCP : stade IIB dans 8 cas, IIIA dans 7 cas, IIIB dans un cas et en stade IVA dans 1 cas. La voie d’abord chirurgicale était une TPLD dans 8 cas, une TPLG dans 7 cas, une sternotomie dans un cas ainsi qu’une manubriotomie pour la tumeur de l’apex. Les suites postopératoires immédiates ont été marquées par 2 décès (HTAP, embolie gazeuse) .Pendant un recul moyen de 4 ans, il y’avait 2 patients qui ont été perdus de vue et un décès après une survie de 3 ans ; par contre une récidive locorégionale objectivé dans 4 cas (3 pulmonaire et une pariétale), ganglionnaire axillaire dans un cas, et à distance dans 3 cas (2 hépatique, 1 osseuse)
Conclusion. La résection chirurgicale reste le meilleur espoir de guérison pour des cancers pulmonaires localement avancés bien sélectionnés
MOTS CLÉS: Cancer pulmonaire; CBPNPC; Intervention chirurgicale; Survie.
INTRODUCTION
Le cancer bronchique non à petites cellules représente la forme histologique la plus fréquente des cancers bronchiques. Il est la première cause de décès par cancer dans la population masculine. Son incidence est estimée entre 40 et 70 pour 100 000 en France pour l'homme.75% des cancers pulmonaires sont diagnostiqué à un stade avancé III-IV dont 30% sont localement avancé et dont seul 1% de ces tumeurs sont opérés, ce qui fait de lui un sujet trop controversé, influencé par la pauvreté des séries publiées.
L’approche chirurgicale apporte une meilleure survie, exposée à 3 complexités thérapeutiques : l’opérabilité restreinte, résecabilité douteuse, et l’indication chirurgicale qui reste le pilier des discussions en concertation multidisciplinaire influencée par la résecabilité complète et le statut ganglionnaire.
MATERIELS ET METHODES
Il s’agit d’une étude rétrospective à propos de 17 cas, opérés dans notre formation pour des cancers pulmonaires localement avancés ; pour lequel, ils ont bénéficié d’une résection pulmonaires élargie à des structures adjacentes, pendant une durée de 9 ans.
RESULTATS
Il y’avait 16 hommes et une femme, dont l’âge moyen était de 58,9ans (37-68ans). Parmi les antécédents, on note que tous les patients de sexe masculin étaient tabagique, une notion de tuberculose dans 2 cas, et une notion de diabète dans un seul cas.
Mise à part d’une découverte fortuite lors d’un bilan préopératoire dans un cas, la durée de symptomatologie moyenne était de 3 mois (1mois-4ans).
La douleur thoracique était le maitre symptôme dans 12 cas, et qui était irradiante (Membre supérieur (1cas), rétro scapulaire (1cas), basithoracique (2cas)) ; associée à une toux dans 10 cas, une notion d’hémoptysie dans 4 cas, ainsi qu’une dyspnée dans 10 cas, le tout évoluait dans un contexte d’altération de l’état général et d’amaigrissement.
Le bilan radiologique initial, fait d’une radiographie et un scanner thoracique a objectivé, un processus tissulaire qui siégeait :
Le LSG dans 6 cas, LSD dans 5 cas dont une était une tumeur de l’apex, LIG dans 3 cas, LID dans 2 cas, ainsi qu’une tumeur bronchique de la BSD.
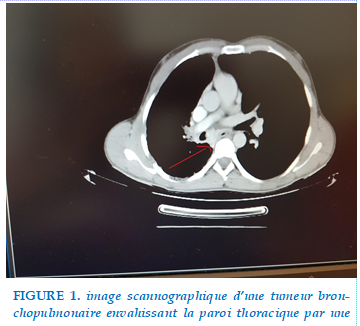
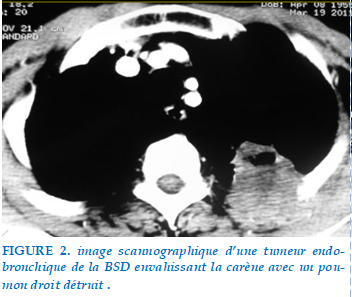
Ce processus envahissait la paroi thoracique dans 7 cas (Figure 1), la scissure dans 6 cas, l’artère pulmonaire dans 2 cas, la veine pulmonaire inférieure dans un cas, le diaphragme dans un cas, et la carène dans un cas (Figure2).
Sa taille moyenne était de 4,8 cm (2-9cm). Tous les patients avaient bénéficié d’une fibroscopie bronchique qui a pu déterminer un diagnostic histologique préopératoire par des biopsies bronchique dans 8 cas, ce dernier avait été obtenue différemment dans 4 autres cas, dont 3 par un examen extemporané et une par biopsie scannoguidée.
Un bilan d’extension a été réalisé par une TDM CTAP dans tous les cas, associée à un PET SCANN dans 2 cas, et une scintigraphie osseuse dans 2 cas, a pu objectiver qu’une métastase surrénalienne chez un patient.
Ces dossiers avait fait l’objectif d’une discussion en RCP et les tumeurs étaient classées en stade IIB dans 8 cas, IIIA dans 7 cas, IIIB dans un cas et en stade IVA dans 1 cas.
Après un bilan préopératoire dont le VEMS moyen était de 2,23L (1L700- 4L) ; La voie d’abord chirurgicale était une TPLD dans 8 cas, une TPLG dans 7 cas, une sternotomie dans un cas ainsi qu’une manubriotomie pour la tumeur de l’apex. Les gestes chirurgicales réalisés étaient:
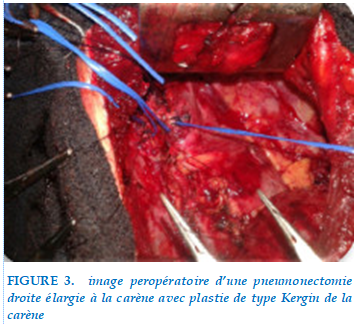
Une pneumonectomie dans 8 cas (suite à un envahissement : scissural dans 6 cas, ganglionnaire dans un cas, VPI dans un cas, carène dans un cas (Figure 3) élargies à la paroi dans 1 cas (arc postérieur de 3 cotes), à l’artère pulmonaire dans un cas, à l’oreillette gauche dans un cas.
Une lobectomie (droite 4 cas, gauche 2 cas) élargie à la paroi avec une pariétectomie totale de 2 à 4 arc costaux, nécessitant une reconstruction par une plaque de polypropylène dans un cas.
Une lobectomie angioplastique supérieure gauche élargie à l’artère pulmonaire.
Une lobectomie inférieure gauche élargie au diaphragme dans un cas .
Une pariétectomie de la 1ére cote associé à une lobectomie supérieure droite dans le cas de tumeur de l’apex .
Les suites postopératoires immédiates ont été marquées par 2 décès en postopératoire immédiat (HTAP, embolie gazeuse). Les diagnostics histologiques étaient un adénocarcinome dans 8 cas, un carcinome épidermoïde dans 8 cas, et une tumeur carcinoïde dans un cas. Après une discussion en RCP et restadification anatomopathologiques, tous les patients ont été référés en service d’oncologie pour éventuel traitement adjuvant.
Pendant un recul moyen de 4 ans, il y’avait 2 patients qui ont été perdus de vue et un décès après une survie de 3 ans ; par contre une récidive locorégionale objectivé dans 4 cas (3 pulmonaire et une pariétale), ganglionnaire axillaire dans un cas, et à distance dans 3 cas (2 hépatique, 1 osseuse).
DISCUSSION
Le cancer bronchique non à petites cellules représente la forme histologique la plus fréquente des cancers bronchiques. Il est la première cause de décès par cancer dans la population masculine [1].
Les cancers localement avancés se présentent par les stades IIIA-B (T3-4,N0-1,M0) et aussi suite à un envahissement ganglionnaire, présenté par les stades T1-2N2M0. Tous les dossiers doivent être discutés en réunion de concertation pluridisciplinaire pour déterminer la stratégie thérapeutique optimale [2].
L’Attitude thérapeutique dépendra de la possibilité de résection complète de la tumeur primitive et aussi du degré d’envahissement ganglionnaire en fonction du nombre de ganglions, leur topographie et ainsi l’effraction capsulaire, nécessitant un curage ganglionnaire massif ( A droite les aires ganglionnaires : 2R,4R,7,8,9 , et à gauche les aires 5,6,7,4L,8,9) [3].
Le traitement d’induction reste discutable vu les complications per et post-opératoires, tout en prenant en considération que ça ne permet pas de rendre résecable une tumeur qui l’était pas initialement. Un traitement néoadjuvant par radiothérapie ne peut avoir comme ambition que de faire diminuer la tumeur primitive et par chimiothérapie peut prétendre au même but. Cette action peut être potentialisée par l’association des deux techniques, mais les cas de guérison sont rares et ces techniques ne remplacent pas l’effet radical obtenu par la chirurgie, qui seule peut prétendre être plus souvent curatrice, vu son impact sur la survie à 5 ans qui est de l’ordre de 15 à 20 % [4].
La morbi-mortalité dépendra de type histologique, le stade TNM et aussi de type de résection qui va être discuté au cas par cas :
Les cancers envahissant la paroi présentent 5 à 8% des cancers opérés, ils sont classés T3N0M0: stades IIB, IIIA/B, l’indication chirurgicale est posée si Tumeur résécable (R0) avec un taux de morbidité qui reste acceptable de 19 à 36% par les complications, dont les plus fréquentes : l’atélectasie, les pneumopathies , la détresse respiratoire, et l’infection du matériel prothétique. Ainsi qu’un taux de mortalité de 0 à 8%, et une survie à 5ans de 24 à 61,4% [5] ; dont les facteur pronostiques étaient la résection R0 (Taux de récidive locale: 35%), envahissement ganglionnaire médiastinale N2.
Les cancers envahissant le péricarde sont suspecté en préopératoire (par la disparition du liseré de sécurité) , ils sont accessible à une exérèse complète, large si nécessaire, nécessitant du matériel prothétique à résorption lente (treillis d’acide polyglactine), ou une plaque de polytétrafluoréthylène fenêtrée si défect péricardique important, associant souvent des exérèses du nerf phrénique [6].
Les cancers envahissant la carène, classéeT4N0M0 (stade IIIA) sont souvent secondaire à un envahissement ganglionnaire plus que l’extension régionale, ils sont candidat à une lobectomie ou une pneumonectomie bronchoplastique ou en créant une «néocarène » selon différentes techniques chirurgicales , contre indiqué si N2, la place du traitement néo-adjuvant a créé de controverses vu les complications postopératoires qu’elle en expose sans influence de survie [7].
Les cancers envahissant la veine cave supérieure, présentent 1% des cancers opérés et classés T4N0M0, secondaire à une extension tumoral plus qu’un envahissement ganglionnaire N2 qui contre indique la chirurgie, la morbidité reste élevée allant de 23 à 55% et qui est en rapport avec la résection pulmonaire plus que la résection vasculaire, ainsi qu’une mortalité de 3à 10%, et une survie à 5ans tout stade confondu (N) de 25 à 30% [8].
Les cancers envahissant les vertèbres sont rare, moins de 1% des cancers opérés ; secondaire à un envahissement par contiguité nécessitant une sélection exhaustive des malades par exploration : d’extension médullaire (IRM, PETSCANN), et d’envahissement ganglionnaire médiastinal N2 et évaluation des vaisseaux médullaire. La morbidité est de 50% et la mortalité postopératoire immédiate est de : 0-15%, le seul facteur pronostique est le caractère R0 de la résection influençant la survie à 5ans qui est de 14% [9].
Les cancers envahissant le diaphragme sont exceptionnels, 0,17 à 0,4% des cancers opérés ; la diagnostic préopératoire est compliqué et rarement obtenu, l’envahissement d’un organe de l’étage sus mésocolique contre indique la chirurgie, la survie à 5 ans est de 22,6 % R0, et de 0 % à R1 [10].
Les cancers envahissant l’aorte souvent secondaire à un cancer du poumon gauche, et dont la survie à 5 ans dans les meilleurs conditions (IIB, R0, N0) est de 18% influencée par l’expertise des techniques chirurgicales [11].
Pour les cancers envahissant le pédicule pulmonaire et l’oreillette gauche sont rare représentent moins de 3,7 % des cancers opérés, souvent associés à une résection bronchoplastique avec une morbidité de 52.6% et une Mortalité de 10.5%, une survie à 5 ans de 43.7%, avec une survie médiane de 28.9 mois [12].
Pour les cancers envahissant l’œsophage sont exceptionnels, avec une rareté de séries et résultats publiés.
Les tumeurs de l’apex sont une forme particulière des cancers localement avancés, représentent une entité pathologiques à prise en charge spécifique.
CONCLUSION
La résection chirurgicale reste le meilleur espoir de guérison pour des cancers pulmonaires localement avancés bien sélectionnés lors des discussions de concertation multidisciplinaire, avec une survie à 5 ans élevés atteignant les 25 à 30 % en cas de résection complète et un pronostic influencé par l’étendue de l’exérèse, le statut ganglionnaire et aussi la maitrise des techniques chirurgicales.
Pour ce qui est connu à propos de ce sujet
Les cancers pulmonaires est la cause de décès la plus fréquente dans la pathologie respiratoire, le diagnostic est souvent tardif à des stades avancés où la prise en charge n’est pas encore codifiée avec des controverses multiples, vu la rareté des séries publiées dans ce sens.
La chirurgie de résection pulmonaire a connu un énorme progrès, avec des techniques chirurgicales s’adaptant à une résection carcinologiques lors ces stades, et dont la gestion nécessite une connaissance approfondi des facteurs pronostiques pour une morbi-mortalité moindre.
La chirurgie peut être exclusive ou associée à une radio-chimiothérapie en adjuvant ou néo-adjuvant d’où la nécessité d’un triage rigoureux de patients, discutés au cas par cas, lors des réunions de concertations multidisciplinaire qui ont une place pondérale dans la prise en charge des cancers pulmonaire au stades avancés.
Pour l’objectif et les apports de cette étude
Rapporter les techniques chirurgicales les plus adaptées aux différents types d’envahissement tumoral locorégional garant d’une résection carcinologique.
Evaluer la place de la chirurgie dans la prise en charge thérapeutique des cancers pulmonaires localement avancé, en rapportant les résultats en terme de morbi-mortalité.
Souligner les facteurs pronostiques diagnostique et thérapeutique.
CONFLICT OF INTEREST
Non.
REFERENCE
1. Fry WA, Menck HR, Winchester DP. The National Cancer Data Base report on lung cancer. Cancer. 1996;77(9):1947‑55.
2. Eberhardt WEE, Mitchell A, Crowley J, Kondo H, Kim YT, Turrisi A, et al. The IASLC Lung Cancer Staging Project: Proposals for the Revision of the M Descriptors in the Forthcoming Eighth Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. 2015;10(11):1515‑22.
3. Thomas P, Dahan M, Riquet M, et al. [Practical issues in the surgical treatment of non-small cell lung cancer. Recommendations from the French Society of Thoracic and Cardiovascular Surgery]. Rev Mal Respir. 2008;25(8):1031‑6.
4. Thomas M, Rübe C, Hoffknecht P, et al. German Lung Cancer Cooperative Group. Effect of preoperative chemoradiation in addition to preoperative chemotherapy: a randomized trial in stage III non-small-cell lung cancer. Lancet Oncol 2008;9:636—48.
5. Lopez L, Pujol JL, Varela A et al. Surgical treatment of stage III non-small cell bronchogenic carcinoma involving the chest wall. Scand J Thorac Cardiovasc Surg 1992 ; 26 : 129-133.
6. Pitz CC, Brutel de la Rivière A, Elbers HR, Westermann CJ, Van den Bosch JM. Results of resection of T3 non-small cell lung cancer invading the mediastinum or main bronchus. Ann Thorac Surg 1996 ; 62 : 1016-1020.
7. Paolo Macchiarini, Matthias Altmayer, Tetsuhiko Go, et al. and the Hannover Interdisciplinary Intrathoracic Tumor Task Force Group. Technical Innovations of Carinal Resection for Nonsmall-Cell Lung Cancer. Ann Thorac Surg 2006;82:1989–97.
8. Spaggiari L, Leo F, Veronesi G, et al: Superior vena cava resection for lung and mediastinal malignancies: a single-center experience with 70 cases. Ann Thorac Surg 83:223-30, 2007.
9. DeMeester TR, Albertucci M, Dawson PJ, Montner SM. Management of tumor adherent to the vertebral column. J Thorac Cardiovasc Surg 1989;97:373-8.
10. McCaughan BC, Martini N, Bains MS, McCormack PM. Chest wall invasion in carcinoma of the lung: therapeutic and prognostic implications. J Thorac Cardiovasc Surg 1985;89: 836-41.
11. Okubo K, Yagi K, Yokomise H, et al. Extensive resection with selective cerebral perfusion for a lung cancer invading the aortic arch. Eur J Cardiothorac Surg 1996;10:389–91.
12. Tsuchiya R, Asamura H, Kondo H, et al. Extended resection of the left atrium, great vessels, or both for lung cancer. Ann Thorac Surg 1994;57:960–5.
Figures
REFERENCE
1. Fry WA, Menck HR, Winchester DP. The National Cancer Data Base report on lung cancer. Cancer. 1996;77(9):1947‑55.
2. Eberhardt WEE, Mitchell A, Crowley J, Kondo H, Kim YT, Turrisi A, et al. The IASLC Lung Cancer Staging Project: Proposals for the Revision of the M Descriptors in the Forthcoming Eighth Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. 2015;10(11):1515‑22.
3. Thomas P, Dahan M, Riquet M, et al. [Practical issues in the surgical treatment of non-small cell lung cancer. Recommendations from the French Society of Thoracic and Cardiovascular Surgery]. Rev Mal Respir. 2008;25(8):1031‑6.
4. Thomas M, Rübe C, Hoffknecht P, et al. German Lung Cancer Cooperative Group. Effect of preoperative chemoradiation in addition to preoperative chemotherapy: a randomized trial in stage III non-small-cell lung cancer. Lancet Oncol 2008;9:636—48.
5. Lopez L, Pujol JL, Varela A et al. Surgical treatment of stage III non-small cell bronchogenic carcinoma involving the chest wall. Scand J Thorac Cardiovasc Surg 1992 ; 26 : 129-133.
6. Pitz CC, Brutel de la Rivière A, Elbers HR, Westermann CJ, Van den Bosch JM. Results of resection of T3 non-small cell lung cancer invading the mediastinum or main bronchus. Ann Thorac Surg 1996 ; 62 : 1016-1020.
7. Paolo Macchiarini, Matthias Altmayer, Tetsuhiko Go, et al. and the Hannover Interdisciplinary Intrathoracic Tumor Task Force Group. Technical Innovations of Carinal Resection for Nonsmall-Cell Lung Cancer. Ann Thorac Surg 2006;82:1989–97.
8. Spaggiari L, Leo F, Veronesi G, et al: Superior vena cava resection for lung and mediastinal malignancies: a single-center experience with 70 cases. Ann Thorac Surg 83:223-30, 2007.
9. DeMeester TR, Albertucci M, Dawson PJ, Montner SM. Management of tumor adherent to the vertebral column. J Thorac Cardiovasc Surg 1989;97:373-8.
10. McCaughan BC, Martini N, Bains MS, McCormack PM. Chest wall invasion in carcinoma of the lung: therapeutic and prognostic implications. J Thorac Cardiovasc Surg 1985;89: 836-41.
11. Okubo K, Yagi K, Yokomise H, et al. Extensive resection with selective cerebral perfusion for a lung cancer invading the aortic arch. Eur J Cardiothorac Surg 1996;10:389–91.
12. Tsuchiya R, Asamura H, Kondo H, et al. Extended resection of the left atrium, great vessels, or both for lung cancer. Ann Thorac Surg 1994;57:960–5.
ARTICLE INFO DOI: 10.12699/jfvpulm.14.43.2023.16
Conflict of Interest
Non
Date of manuscript receiving
25/01/2023
Date of publication after correction
25/06/2023
Article citation
Fatima Zahra Ammor, Marouane Lakranbi, Leila Bellirej, Hicham Harmouchi, Yassine Ouadnouni, Mohammed Smahi. Non small cell lung cancer surgery - Locally advanced stages . J Func Vent Pulm 2023;43(14):16-20