
 English
English
 French
French
Evaluation Of The Profiles Of Patients With Multidrug-Resistant Tuberculosis At The University Hospital Center The National Reference Of N'djamena-Chad
Evaluation Des Profils Des Patients Atteints De La Tuberculose Multi Resistante Au Centre Hospitalier Universitaire La Reference Nationale De N’djamena-Tchad
Dlinga1, R. Ngakoutou1, A. Ahmet 1, AM. Medila Moussa2, KA. Adjougoulta3, KDB. Adjougoulta4, J. Madtoingue5 , KA. Aziagbe6
1: Service de pneumologie du CHU la Référence Nationale de N’Djamena
2: Service de l’imagerie du CHU la Référence Nationale de N’Djamena
3: Service de cardiologie du CHU Référence Nationale de N’Djamena
4: Service d’anesthésie et de réanimation du CHU la Référence Nationale de N’Djamena
5: Service des maladies infectieuses du CHU la Référence Nationale de N’Djamena
6: Service de pneumologie du CHU Sylvanus Olympio de Lomé-Togo
Corresponding author:
Dieudonné DLINGA. Service de pneumologie du CHU la Référence Nationale de N’Djamena
E-mail: dlingadieu@gmail.com
ABSTRACT
Introduction. Multidrug-resistant tuberculosis is a public health problem in resource-limited countries. It is a major threat to TB control. The objective of the study is to contribute to the management of patients with multidrug-resistant tuberculosis in Chad. Material and methods. This was a retrospective and descriptive study conducted over a period of five years, from 2016 to 2020, in the Pneumo-Phtisiology Department of the university hospital center the national reference of Djamena (Chad). Results. A frequency of 0.9% was reported in our study. The age group of 25-34 years was the most represented with 47.2%. Men 66.1% with a sex ratio M/F of 1.95. The history of tuberculosis, HIV and the notion of contagion were noted respectively by 60.6%, 21.2% and 75.6%. The use of standard anti-tuberculosis drugs represented 28.3%; alcohol and tobacco intoxication were respectively 44.1% and 29.1%. Alteration of general condition to WHO stage 3 and hyperthermia were found in 77.9% and 72.4% respectively. Cough and chest pain were present in all patients. Hemoglobin level of 7 to 12g/dl was predominant with 62.5%. Alveolar-cavity syndrome accounted for 44.9% of the sample during the study. We recorded 9.4% death rate, 4% lost to follow-up and 3.1% failure rate. Conclusion. Multidrug-resistant tuberculosis is increasingly common in African pneumological settings where treatment remains a challenge.
KEYWORDS: Tuberculosis; multi-resistant; risk factors; CHU-RN.
RÉSUMÉ
Introduction. La tuberculose multi résistante est un problème de santé publique dans les pays à ressources limitées. C’est une menace importante au contrôle de la tuberculose. L’objectif de l’étude est de contribuer à la prise en charge des patients atteints de la tuberculose multi-résistante au Tchad. Matériel et méthodes. Il s’est agi d’une étude rétrospective et descriptive menée sur une période de cinq ans, allant de 2016 au 2020, dans le service de Pneumo-phtisiologie du CHU la Référence Nationale de N’Djamena (Tchad). Résultats. Une fréquence de 0,9% a été mentionnée dans notre étude. La tranche d’âge de 25-34 ans était la plus représenté avec 47,2%. Les hommes 66,1% avec un sex-ratio H/F de 1,95. Les antécédents de la tuberculose, du VIH et la notion du contage étaient notés respectivement de 60,6%, 21,2% et 75,6%. La prise d’antituberculeux standard représentait 28,3% ; l’intoxication alcoolique et tabagique était respectivement de 44,1% et 29,1%. L’altération de l’état général au stade 3 de l’OMS et l’hyperthermie étaient retrouvées respectivement dans 77,9% et 72,4%. La toux et la douleur thoracique étaient présentes chez tous les patients. Le taux d’hémoglobine de 7 à 12g/dl prédominait avec 62,5%. Le syndrome alvéolo-cavitaire représentait 44,9% de l’échantillon lors de l’étude. Nous avons enregistré 9,4% de taux de décès, 4% de perdu de vue et 3,1% de taux d’échec. Conclusion. La tuberculose multi résistante est de plus en plus fréquente en milieux pneumologiques africains où la prise reste un défi.
MOTS CLÉS: Tuberculose; multi résistance; facteurs de risque; CHU-RN.
INTRODUCTION
Découverte pour la première fois en 1882 par Robert Koch, la tuberculose est une maladie infectieuse à transmission interhumaine dont le germe responsable est le bacille de Koch.
Cette maladie demeure, parmi les maladies infectieuses guérissables, celle qui fait plus de victime avec presque deux (2) millions de mort par année parmi les neuf (9) millions le nombre de nouveaux cas estimé par l’Organisation Mondiale de Santé (OMS) en 2013 [1].
Sa transmission est toujours directe, du sujet malade bacillifère au sujet réceptif, par voie aérienne du fait des bacilles contenus dans l'air, dans les gouttelettes de salive en suspension émises par le patient [2].
Actuellement le problème de la tuberculose est loin d’être maitrisé. Il se trouve compliqué à cause de trois principaux évènements : l’endémie du sida, l’inefficacité relative du bacille de Calmette et Guérin (BCG) et l’apparition des souches de Mycobacterium résistants voire multi résistantes aux antituberculeux [3].
La tuberculose multi résistante est définie comme une infection causée par une mycobactérie du complexe tuberculosis, résistante au moins à l’Isoniazide et à la Rifampicine, les deux antituberculeux majeurs du traitement de référence et plus particulièrement la résistance à la Rifampicine qui est un facteur de mauvais pronostic [4].
En 2014, l’Organisation Mondiale de la Santé (OMS) estime qu’environ 9 millions des patients atteints de la tuberculose chaque année dont 480 000 personnes auraient présenté une tuberculose dite multi résistante [5].
Il s’agit d’un problème de santé publique. Selon l’OMS en 2018, environ un demi-million de nouveaux cas de tuberculose résistante à la Rifampicine (dont 78 % de cas de tuberculose multi résistante) ont été enregistrés. Les trois pays représentant la plus grande part de la charge mondiale étaient l’Inde (27 %), la Chine (14 %) et la Fédération de Russie (9 %) [6].
À l’échelle mondiale, 3,4 % des nouveaux cas de tuberculose et 18 % des cas déjà traités présentaient une tuberculose multi résistante ou une tuberculose résistante à la rifampicine (TB-MR/TB-RR), les proportions les plus élevées (>50 % chez les cas déjà traités) étant observées dans les anciens pays soviétiques [6].
En Afrique du nord la prévalence de la tuberculose multi résistante pour le nouveau cas est inférieure à 2,9% tandis qu’en Afrique sud saharienne, une étude en République Démocratique du Congo(RDC) avait retrouvé une prévalence de 2,2% [1,7]. Au Tchad, la prévalence de la TB-MDR est estimée à 2,8% parmi les nouveaux patients et de 21% parmi les patients déjà traités [8].
La présentation clinique de la tuberculose multi résistante est non spécifique et repose sur les signes classiques de la tuberculose pharmacosensible. de N’Djamena au Tchad.
Le diagnostic repose sur l’interrogatoire en recherchant les facteurs de risques, la clinique et la para clinique surtout la réalisation du GENEXPERT (Xpert MTB/RIF) et la coloration à L’Auramine [9].
La prise en charge est multifactorielle et doit se faire dans une unité d’hospitalisation ayant l’expérience de la prise en charge des tuberculoses multi résistantes.
Au Tchad, peu d’études ont été réalisées pour évaluer les profils des patients atteints de la tuberculose multi résistante, qui représente une menace importante de contrôle de la tuberculose.
L’objectif de ce travail était d’identifier les profils des patients atteints de la tuberculose multi-résistante afin de contribuer à leur prise en charge dans le service de pneumo-phtisiologie du CHU la Référence Nationale.
METHODES
Il s’est agi d’une étude rétrospective et descriptive sur une période de cinq (5) ans allant de 2016 au 2020. Etaient inclus dans l’étude, les dossiers des patients de tout âge et des deux sexes, hospitalisé durant la période d’étude dans le service pour tuberculose multirésistance après le GeneXpert.
Ce résultat était complété par les tests de sensibilité et la culture réalisés au laboratoire national de référence.
Les variables épidémiologiques, cliniques, paracliniques, évolutives étaient recueillies à l’aide d’un questionnaire établi sur une fiche d’enquête avec le consentement du malade à participer à l’étude.et analysées à l’aide du logiciel SPSS dans sa version 18.0.
RESULTATS
Durant notre étude, nous avons enregistré 13502 dossiers des patients dans le service de pneumo-phtisiologie dont 127 cas de tuberculose multi résistante soit une fréquence de 0,9%.
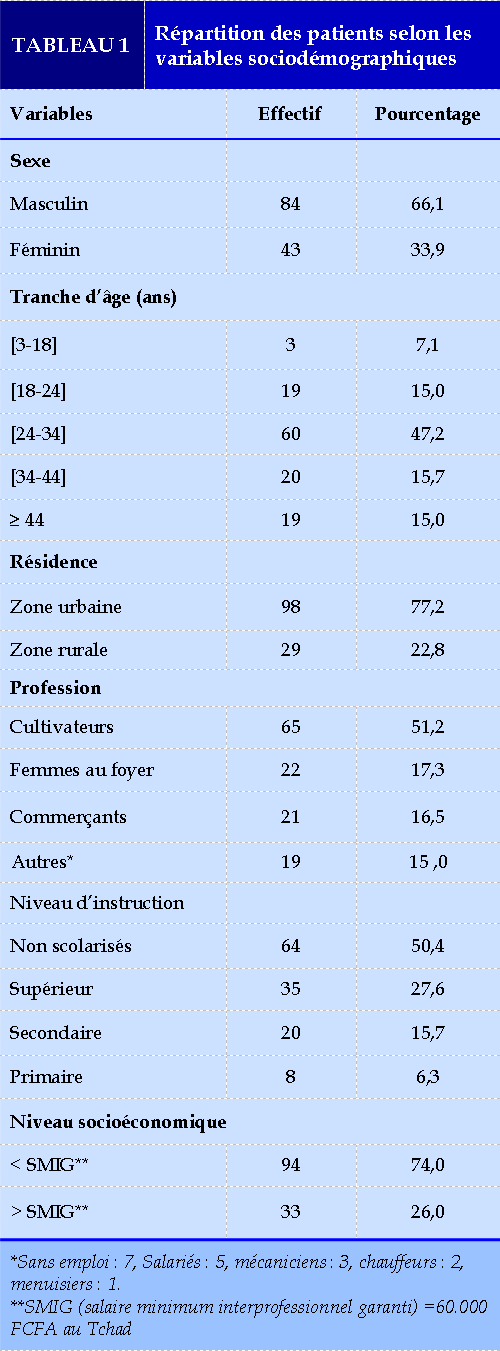
Données sociodémographiques (Tableau 1)
Données cliniques
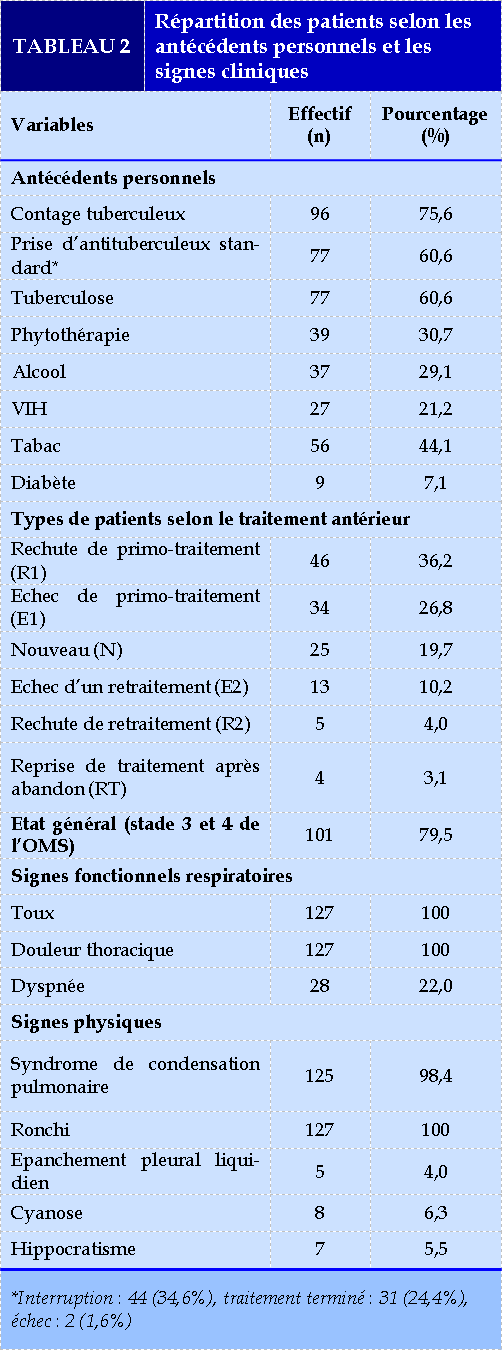
Le Tableau 2 résume les antécédents pathologiques et les signes cliniques de la population d’étude.
Données paracliniques
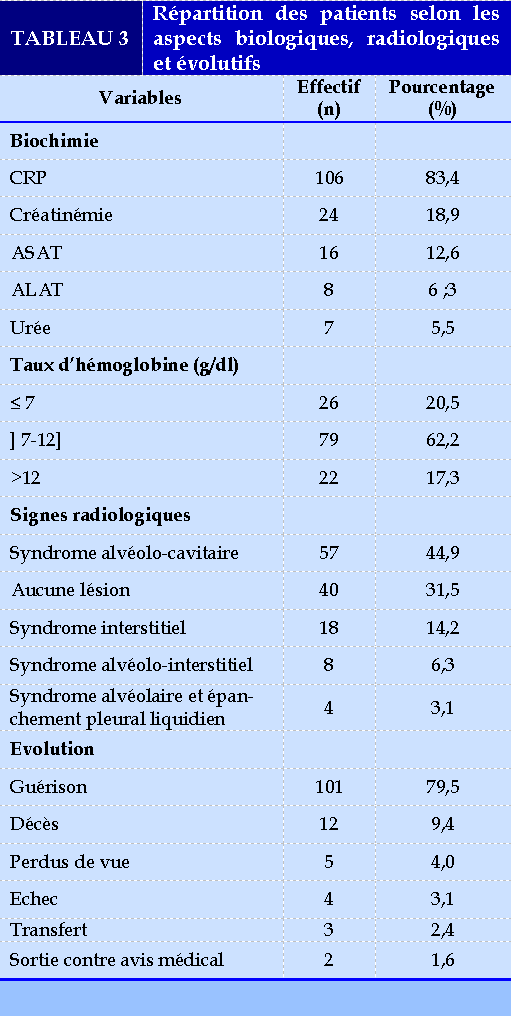
Le Tableau 3 résume les différents aspects biologiques, radiologiques de lésions pulmonaires observées et évolutifs.
DISCUSSION
La fréquence de la tuberculose multi résistante dans cette série d’étude était de 0,9%. Ce résultat est largement inférieur à ceux de LaFreniere et al. [10] au canada en 2018 qui a retrouvé 10,1%. Ceci pourrait s’expliquer par la pauvreté de notre plateau technique ou au mécanisme de contrôle de la distribution des antituberculeux moins efficace.
Dans notre étude, la tranche d’âge 24-34 ans était la plus représentée avec 47,2%. Ce résultat est diffèrent à celui de LaFreniere et al. [11] en 2020 au canada qui ont retrouvé une tranche d’âge 35 à 44 ans dans 41,3% et inferieur à celui de Niang et al. [12] en 2014 au Sénégal qui a retrouvé une tranche d’âge similaire de [413 dans 70%. Ceci pourrait s’expliquer par la prédisposition de cette tranche d’âge aux facteurs de risque et l’inobservance au traitement suite à leur nombreuse
préoccupation. Ce constat corrobore avec les données de l’OMS [12] et à celui de Knuchel et al. [5] en 2016 en Suisse que la majorité des malades infectés par la TB-MR sont jeunes et ont un âge compris entre 25 et 44 ans. Par rapport au sexe, il ressort de l’étude que sur 127 cas de tuberculose multi résistante, on a une prédominance masculine de 66,1% avec un sexe ratio de 1,95. Misombo-katabela et al. [2] et Camara et al. [13] en 2019 en Guinée avaient retrouvé la prédominance masculine respectivement dans 61,97% et 70,56%. Cette prédominance masculine pourrait s’expliquer d’une part par le fait que les hommes s’exposent plus à l’intoxication alcoolique et surtout au tabac qui est un facteur favorisant la fragilisation du parenchyme pulmonaire et de la tuberculose et d’autres part par l’hypothèse qu’ils sont moins observants au traitement et plus susceptibles de recevoir un traitement inadéquat. Dans notre série, 77,2% des patients vivaient en zones urbaines. Ce résultat est inférieur à celui de Ouédraogo et al. [14] en 2014 au Burkina qui avait retrouvé 82%. Ceci pourrait s’expliquer par la forte densité de la population urbaine et la cohabitation dans les logements communs où ils se partageaient les mêmes douches et les mêmes cuisines. Ce constat corrobore aux données internationales notamment à celui de Shen et al. [15] en 2009 en Chine qui prouve que les patients vivants en milieu urbain sont plus prédisposés à l’atteinte de TB-MR. Dans notre série, les cultivateurs étaient majoritaires soit 51,2%. Ce résultat est similaire à celui de Ouédraogo et al. [16] en 2016 au Mali qui a retrouvé 50,7% des cultivateurs. Ceci pourrait s’expliquer par le manque d’emploi et l’agriculture qui reste l’une des principales sources de revenu dans notre milieu. Selon la situation maritale, 63,8% étaient des mariés. Ce résultat est différent à ceux de Okemba-Okombi et al. [17] en 2020 à Brazzaville et Niang et al. [11] en 2014 au Sénégal qui avaient retrouvé des célibataires respectivement 62,5% et 67%.
Ceci pourrait s’expliquer par nos croyances socioculturelles vis-à-vis du mariage. Dans cette étude, les patients non scolarisés étaient les plus représentés dans 50,4%. Ceci pourrait s’expliquer par le taux élevé de la non scolarisation dans notre au Tchad. Sur le plan socio-économique 74% des patients vivaient en dessous du SMIG qui est de 50.000 FCFA. Ferchichi et al. [18] en 2020 et Essebaa et al. [19] en 2021 en Tunisie avaient retrouvé 77% et 23,8% des patients avec un niveau socio-économique bas. Ceci pourrait s’expliquer par le fait que la pauvreté de la population, la malnutrition, le manque d’hygiène puis la forte densité sont propices à la prolifération et mutation des bacilles.
L’antécédent de la tuberculose était retrouvé dans 60,6%. Hirama et al. [9] en 2020 au Canada, Bopaka et al. [20] en 2020 à Brazzaville qui ont retrouvé respectivement 34,8% et 88,6%. Deux études réalisées en Russie et au Brésil avaient montré que les patients atteints d’une pathologie respiratoire sont plus disposés à la TB-MR [21,22]. Dans notre étude, les patients TB-MR/VIH représentaient 21,2 %. Ce résultat est similaire à celui de Camara et al. [12] en 2019 en Guinée qui avaient retrouvé 22% mais supérieur à celui de Adambounou et al. [23] en 2019 au Togo qui avaient retrouvé 18%. Ceci pourrait s’expliquer par le phénomène d’amplification de sélection de souches mutantes suite à la pandémie de l’infection à VIH et la prédilection de la tuberculose et VIH à des populations en situation de précarité. Concernant la notion de contage 75,6% avaient un contact étroit avec des patients tuberculeux pulmonaires bacillifères. Ce résultat est supérieur à celui de Okemba-Okombi et al. [17] en 2020 à Brazzaville qui avait retrouvé 15,4%. Plusieurs auteurs ont montré la relation entre le contage tuberculeux et la multirésistance. Mtraoui et al. [4] avaient retrouvé que le risque d’infection est fortement corrélé au nombre et la durée d’exposition et est élevé quand le contage est au niveau familial. Dans notre série, 77 (60,6%) patients avaient un antécédent de prise d’antituberculeux standard. Parmi eux 34,6% avaient interrompu le traitement. Ce résultat est inférieur à ceux de Okemba-Okombi et al. [17] et Berkchi et al. [24] en 2021 au Maroc qui avaient retrouvé respectivement 6,8% et 24% des cas d’interruption thérapeutique. Ceci pourrait s’expliquer d’une part par la rupture des antituberculeux dans les services et d’autre part par l’ignorance de la population. Plusieurs auteurs avaient retrouvé la relation entre le traitement antérieur et la survenue d’une tuberculose multi-résistante [27,28].
Dans cette série 30% des patients consommaient de la phytothérapie. Ceci pourrait s’expliquer par nos croyances culturelles vis-à-vis des décoctions. Parmi les patients, 4,7% avaient un antécédent d’incarcération. Ce résultat est similaire à ceux de Smaoui Fourati et al. [1] en 2015 en Tunisie et Hirama et al. [9] qui avaient retrouvé 4,2 et 5,2% mais est inférieur à ceux de Mejri et al. [25] en 2015 en Tunisie et Essebaa et al. [49] en 2021 au Congo qui étaient de 17% et 12,5%. Ceci pourrait s’expliquer par le manque d’efficacité des services médicaux des prisons, le manque de coordination entre les services médicaux de prisons et le programme national de lutte contre la tuberculose et surtout par les conditions de vie précaires, la promiscuité et l'insalubrité. Dans notre série, l’intoxication au tabac et à l’alcool était retrouvée respectivement dans 44,1% et 29,1%. Des antécédents de ces intoxications avaient été retrouvé à des proportions différentes des nôtres par: Okemba-Okombi et al. [47] (tabac : 46,2%, alcool : 38,5%), Mejri et al. [55] (tabac : 75%, alcool : 30%). Les patients éthyliques sont généralement inobservants à leurs traitement, ce qui favoriseraient le développement
des résistances aux antituberculeux. Par contre les avis divergent en ce qui concerne la relation entre le tabagisme et la multirésistance.
S’agissant de types de patients, 36,2% étaient de types R1. Ce résultat est supérieur à celui de Snène et al. [27] en 2014 en Tunisie qui avaient retrouvé 9% mais inférieur à celui de Adambounou et al. [23] en 2019 au Togo qui avait retrouvé 90,20%. Notre résultat pourrait s’expliquer par des conditions socio-économiques défavorables d’une part et la promiscuité de la population d’autre part.
Dans cette étude, 79,5% des patients avaient un état général altéré classé stade 3 ou 4 de l’OMS. Ouedraogo et al. [13], Fikal et al. [28] en 2016 au Maroc avaient retrouvé un état général altéré classé stade 3 respectivement dans 38,5% et 83,33%. Le retard des patients à la consultation, certains terrains fragiles ou fragilisés pourraient expliquer ce taux élevé dans notre étude. Les principaux signes fonctionnels respiratoires étaient, la toux (100%), la douleur thoracique (100%) et la dyspnée (22%). Il s’agit des symptômes classiques des pathologies pulmonaires. S’agissant des formes cliniques, tous les patients avaient la tuberculose pulmonaire. Ce résultat est similaire à celui de Ouédraogo et al. [17] qui avaient retrouvé 100% des formes pulmonaires mais supérieur à celui de Paz et al. [30] en 2019 en France et Djibril et al. [31] en 2020 au Sénégal qui avaient retrouvé 86,4% et 86%. Il s’agit de la forme la plus fréquente décrite dans la littérature.
Sur le plan évolutif, 79,5% avaient une évolution favorable. Ce résultat est supérieur à celui de Okemba-Okombi et al. [17] qui avaient retrouvé 61,5%. Ce résultat pourrait s’expliquer par rapport à la spécificité de chaque population étudiée car les régimes thérapeutiques sont presque les mêmes et ont une durée d’au moins 20 mois. Lors de cette étude, l’échec représentait 3,1%, par contre les perdus de vue, les sorties contre avis médical et le transfert représentaient respectivement 4%, 1,6% et 2,4%. Nous avons enregistrés 9,4% des décès. Ce résultat est similaire à ceux de Ouédraogo et al. [14] en 2014 au Burkina Faso qui avait trouvé 5,1% perdus de vue et Anon et al. [33] en 2020 en côte d’Ivoire qui avaient trouvé 4% d’échec et 13% de décès. Ceci pourrait s’expliquer par les différentes stratégies d’action de PNT, le retard de consultation, la mauvaise condition d’hospitalisation et de la prise en charge des patients par les personnels de santé qui travaillent dans des conditions difficiles (manque des moyens de protection).
CONCLUSION
La tuberculose multi résistante est fréquente au Tchad, engendrant un lourd fardeau. Elle touche les patients jeunes, de sexe masculin, vivants dans les zones urbaines et avec un antécédent d’intoxication alcoolo-tabagique. La plupart des patients avaient un état général classé stade 3 ou 4 de l’OMS. Selon le traitement antérieur, les patients R1 et E1 étaient majoritaire et plus de la moitié des patients avaient terminé le traitement. L’étude a observé au cours du traitement des échecs, des décès, des perdus de vue et les sorties contre avis médical. A travers ces observations, le combat contre la tuberculose multi résistante est loin d’être achevé et beaucoup d’effort reste à fournir de la prévention.
CONFLIT D’INTERETS
Les auteurs déclarent aucun conflit d’intérêt à travers cette étude.
REFERENCE
| 1. Fourati SS, Mzid H, Marouane C, Kammoun S, Messadi-Akrout F. Tuberculose multi résistante. Epidémiologie et facteurs de risque. Rev pneumol clin. 2015 Août ; 71(4) : 233-241. |
| 2. Misombo-katabela A, Nguefack-Tsague G, kalla GCM, Zé EA, Diangs K, Pasida T, et al. Facteurs de risque de la tuberculose multi résistante dans la ville de Kinshasa en RDC. Pan African Med J. 2016 Avril ; 23(157) : 6137. |
| 3. Jabri H, Lakhdar N, El khattabi W, Afèf H. Les moyens diagnostiques de la tuberculose. Rev Pneumol clin.2016 ; 72(5) : 320-5. |
| 4. Veziris N, Robert J. Tuberculose multi résistante : Prise en charge. La lettre de l’infectiologue-Tom XVIII Numéro 5-septembre-octobre 2003 : 186-9. |
| 5. Knuchel J, Lador F, Soccal PM, Janssens JP. Le point sur la tuberculose résistante en suisse. Rev Med suisse. 2016 Novembre ; 12 (539) : 1948-1954. |
| 6. OMS. Rapport sur la tuberculose dans le monde 2019 : Résumé d’orientation ; 1-7. |
| 7. Ministère de la santé. Enquête de prévalence sur la résistance tuberculeuse dans la ville de Kinshasa : Programme National de Lutte contre la Tuberculose. Kinshasa, 1999. google scholar. |
| 8. PNT. Guide technique de prise en charge des cas de Tuberculose à Bacilles multi-résistantes. Edition 2017. |
| 9. Rapport de mission au centre hospitalier régional de Moundou. Octobre 2013 : 1-32. |
| 10. LaFreniere M, Dam D, Strudwick L, McDermott S. Résistance aux antituberculeux au Canada : 2018. Rel mal trans au Canada 2020 ; 46(1) : 10-6. |
| 11. Niang A, Konté HD, Sall R, Diop YM, Ba F, Sarr M et al. Profil épidémiologique des patients atteints de tuberculose multi résistante au Sénégal : Rev mal resp 2015 ; 32 suppl : A233. |
| 12. The WHO/IUATLD Global project on ant tuberculosis drug resistance surveillance. Antituberculosis drug resistance in the world; 2008. http://www.who.int/tb/publications/2008/drs report4 26feb08.pdf |
| 13. Camara LM, Diallo BD, Diallo MH, Diallo A, Diallo OH, Camara MH et al. Facteurs de risque de décès des patients tuberculeux multi-résistants traités par schéma court à Conakry. Jaccr Africa. 2019 ; 3(4) : 441-448. |
| 14. Ouédraogo SM, Ouédraogo AR, Birba E, Ouédraogo G, Badoum G, Boncoungou/Nikiéma K et al. Tuberculose multi résistante à Bobo-Dioulasso : Aspects épidémiologiques, cliniques, radiographiques et évolutifs. RAMI. 2014 ; 1(2) : 1-44. |
| 15. Shen X, De Riemer K, Yuan ZA, Shen M, Xia Z, Gui X, et al. Drug-resistant tuberculosis in Shanghai, China, 2000-2006: prevalence, trends and risk factors. Int J Tuberc Lung Dis. 2009; 13(2): 253-9. |
| 16. Ouédraogo SM, Sondo KA, Ouédraogo AR, Ouédraogo G, Badoum G, Boncoungou K et al. Etat des lieux sur la tolérance du traitement de la tuberculose multi résistante (Burkina Faso).Mali médical tome XXXI. 2016; (3) : 31-36. |
| 17. Okemba-Okombi FH, Ndinga Essango E, Kaswa Kayomo M, Ossale Abacka BK, Bopaka RG, Atipo Ibara BI. Tuberculose multi résistante à Brazzaville : Aspects épidémiologiques, cliniques, radiographiques et évolutifs. J Func Vent Pulm 2020 ; 33(11) :1-6. |
| 18. Ferchichi M, Saad SB, Mansour AB, Nafitti O, Hadj SB, Daghfous H et al. Comportement additifs ; quelle signification chez les patients ayant une Tuberculose multi résistante ? Rev mal resp .2020: 13(1) : 224-495. |
| 19. Essebaa S, Saad SB, Mansour AB, Channouffi A, Nafitti O, Hady SB et al . Tuberculose multi résistante Guérie : fin d’une tragédie ou début d’une autre ? Revues des maladies respiratoires. 2021; 13(1) : 233. |
| 20. Hirama T, Sabur N, Derkach P, McNamee J, Howard Song H, Marras T et al. Facteurs de risque associés à la tuberculose pharmaco résistante dans un centre de référence situé à Toronto (Ontario) au Canada : 2010 à 2016.Rel mal trans au Canada 2020; 46(4) : 95–103. |
| 21. Ruddy M, Balabanova Y, Graham C, Fedorin I, MalanovaN, Elisarova E et al. Rates of drug resistance and risk factor analysis in civilium and prison patients with tuberculosis in samara region, Russia. PMC. 2005; 60(2): 130-5. |
| 22. Barroso EC, Salani-Manta RM, Santos RO, Sousa ALO, Barroso JB, Rodrigues JLN. Risk factors for acquired multidrug-resistant tuberculosis. J Pneumol 2003; 29:89-97. |
| 23. Adambounou TAS, Aziagbe KA, Ako AM, Toundoh N, Gbadamassi AG, P. Efalou et al. Aspects épidémiologiques et évolutifs de la tuberculose multi résistante au Togo. Rev Mal Resp. 2020; 12 (1) : 165-362. |
| 24. Mtaraoui A, Soltani M, Ghannem H, Letaief M, Zayani R, Hdhiri H et al. Epidémiologie de la tuberculose dans le Sahel tunisien. Med Mal Inf. 1998; 28: 199-202. |
| 25. Berkchi M, Reguig N, Abdoulkader A, Soualhi M, Zehraoui R, Benamor J et al. Epidémiologie et facteurs de risque de développement de la tuberculose multiresistante : Rev mal Resp. 2021; 13(1) : 233-234. |
| 26. Mdivani N, Zangladze E, Volkova N, Koubatova G, Jibuti T, Shubladzae et al. High prevalence of multidrug-resistant tuberculosis in Georgia. Int J Infect Dis 2008; 12 : 635-44. |
| 27. Espinal MA, Laserson K, Camacho M, Fusheng Z, Kim SJ, Tlali RE et al. Determinants of drug-resistants tuberculosis analysis of 11 countries. Int J Tuberc Lung Dis 2001; 5 : 887-93. |
| 28. Mejri F, Tritar S, Dafghous H, Ben Khelifa M. Facteurs de risque de la tuberculose multi résistante : Rev Mal Resp. 2015 ; 32(S) : A233-A234. |
| 29. Snène H, Daghfous H, Ben Saad S, Ben Khalifa M, Zarrouk M, Slim L et al. La tuberculose multi résistante : état des lieux en Tunisie. Rev Mal Resp. 2015; 32 : A234. |
| 30. Fikal S, Sajari H, Serhane S, Antbatahar S, Rachid H et al. Tuberculose multi résistante. Rev Mal Resp. 2016; 33: A151-A152. |
| 31. Paz M, Argemi X, Schramm F, Mielcarek M, Kassegne L, Hansmann Y et al. Tuberculose multi résistante : Une prise en charge qui pèse lourde aux hôpitaux universitaires de Strasbourg. Rev Mal Resp. 2019 ; 36(9): 1011-1019. |
| 32. Djibril SK, Ndiaye M, Kane M, Sawadogo B, Laurent M, Diallo F et al. Profil épidémiologique de la tuberculose au Sénégal de 2009-2018. 2022; 70(3): S161-S162. |
| 33. Anon JC, Yeo L, Toh Y, Dembélé B, Dje-bi H, Samogo MN et al. Les défis de la prise en charge de la tuberculose multi résistante hors des capitales africaines. Rev Mal Resp. 2020; 12(1): 166-363. |
Tables
REFERENCE
| 1. Fourati SS, Mzid H, Marouane C, Kammoun S, Messadi-Akrout F. Tuberculose multi résistante. Epidémiologie et facteurs de risque. Rev pneumol clin. 2015 Août ; 71(4) : 233-241. |
| 2. Misombo-katabela A, Nguefack-Tsague G, kalla GCM, Zé EA, Diangs K, Pasida T, et al. Facteurs de risque de la tuberculose multi résistante dans la ville de Kinshasa en RDC. Pan African Med J. 2016 Avril ; 23(157) : 6137. |
| 3. Jabri H, Lakhdar N, El khattabi W, Afèf H. Les moyens diagnostiques de la tuberculose. Rev Pneumol clin.2016 ; 72(5) : 320-5. |
| 4. Veziris N, Robert J. Tuberculose multi résistante : Prise en charge. La lettre de l’infectiologue-Tom XVIII Numéro 5-septembre-octobre 2003 : 186-9. |
| 5. Knuchel J, Lador F, Soccal PM, Janssens JP. Le point sur la tuberculose résistante en suisse. Rev Med suisse. 2016 Novembre ; 12 (539) : 1948-1954. |
| 6. OMS. Rapport sur la tuberculose dans le monde 2019 : Résumé d’orientation ; 1-7. |
| 7. Ministère de la santé. Enquête de prévalence sur la résistance tuberculeuse dans la ville de Kinshasa : Programme National de Lutte contre la Tuberculose. Kinshasa, 1999. google scholar. |
| 8. PNT. Guide technique de prise en charge des cas de Tuberculose à Bacilles multi-résistantes. Edition 2017. |
| 9. Rapport de mission au centre hospitalier régional de Moundou. Octobre 2013 : 1-32. |
| 10. LaFreniere M, Dam D, Strudwick L, McDermott S. Résistance aux antituberculeux au Canada : 2018. Rel mal trans au Canada 2020 ; 46(1) : 10-6. |
| 11. Niang A, Konté HD, Sall R, Diop YM, Ba F, Sarr M et al. Profil épidémiologique des patients atteints de tuberculose multi résistante au Sénégal : Rev mal resp 2015 ; 32 suppl : A233. |
| 12. The WHO/IUATLD Global project on ant tuberculosis drug resistance surveillance. Antituberculosis drug resistance in the world; 2008. http://www.who.int/tb/publications/2008/drs report4 26feb08.pdf |
| 13. Camara LM, Diallo BD, Diallo MH, Diallo A, Diallo OH, Camara MH et al. Facteurs de risque de décès des patients tuberculeux multi-résistants traités par schéma court à Conakry. Jaccr Africa. 2019 ; 3(4) : 441-448. |
| 14. Ouédraogo SM, Ouédraogo AR, Birba E, Ouédraogo G, Badoum G, Boncoungou/Nikiéma K et al. Tuberculose multi résistante à Bobo-Dioulasso : Aspects épidémiologiques, cliniques, radiographiques et évolutifs. RAMI. 2014 ; 1(2) : 1-44. |
| 15. Shen X, De Riemer K, Yuan ZA, Shen M, Xia Z, Gui X, et al. Drug-resistant tuberculosis in Shanghai, China, 2000-2006: prevalence, trends and risk factors. Int J Tuberc Lung Dis. 2009; 13(2): 253-9. |
| 16. Ouédraogo SM, Sondo KA, Ouédraogo AR, Ouédraogo G, Badoum G, Boncoungou K et al. Etat des lieux sur la tolérance du traitement de la tuberculose multi résistante (Burkina Faso).Mali médical tome XXXI. 2016; (3) : 31-36. |
| 17. Okemba-Okombi FH, Ndinga Essango E, Kaswa Kayomo M, Ossale Abacka BK, Bopaka RG, Atipo Ibara BI. Tuberculose multi résistante à Brazzaville : Aspects épidémiologiques, cliniques, radiographiques et évolutifs. J Func Vent Pulm 2020 ; 33(11) :1-6. |
| 18. Ferchichi M, Saad SB, Mansour AB, Nafitti O, Hadj SB, Daghfous H et al. Comportement additifs ; quelle signification chez les patients ayant une Tuberculose multi résistante ? Rev mal resp .2020: 13(1) : 224-495. |
| 19. Essebaa S, Saad SB, Mansour AB, Channouffi A, Nafitti O, Hady SB et al . Tuberculose multi résistante Guérie : fin d’une tragédie ou début d’une autre ? Revues des maladies respiratoires. 2021; 13(1) : 233. |
| 20. Hirama T, Sabur N, Derkach P, McNamee J, Howard Song H, Marras T et al. Facteurs de risque associés à la tuberculose pharmaco résistante dans un centre de référence situé à Toronto (Ontario) au Canada : 2010 à 2016.Rel mal trans au Canada 2020; 46(4) : 95–103. |
| 21. Ruddy M, Balabanova Y, Graham C, Fedorin I, MalanovaN, Elisarova E et al. Rates of drug resistance and risk factor analysis in civilium and prison patients with tuberculosis in samara region, Russia. PMC. 2005; 60(2): 130-5. |
| 22. Barroso EC, Salani-Manta RM, Santos RO, Sousa ALO, Barroso JB, Rodrigues JLN. Risk factors for acquired multidrug-resistant tuberculosis. J Pneumol 2003; 29:89-97. |
| 23. Adambounou TAS, Aziagbe KA, Ako AM, Toundoh N, Gbadamassi AG, P. Efalou et al. Aspects épidémiologiques et évolutifs de la tuberculose multi résistante au Togo. Rev Mal Resp. 2020; 12 (1) : 165-362. |
| 24. Mtaraoui A, Soltani M, Ghannem H, Letaief M, Zayani R, Hdhiri H et al. Epidémiologie de la tuberculose dans le Sahel tunisien. Med Mal Inf. 1998; 28: 199-202. |
| 25. Berkchi M, Reguig N, Abdoulkader A, Soualhi M, Zehraoui R, Benamor J et al. Epidémiologie et facteurs de risque de développement de la tuberculose multiresistante : Rev mal Resp. 2021; 13(1) : 233-234. |
| 26. Mdivani N, Zangladze E, Volkova N, Koubatova G, Jibuti T, Shubladzae et al. High prevalence of multidrug-resistant tuberculosis in Georgia. Int J Infect Dis 2008; 12 : 635-44. |
| 27. Espinal MA, Laserson K, Camacho M, Fusheng Z, Kim SJ, Tlali RE et al. Determinants of drug-resistants tuberculosis analysis of 11 countries. Int J Tuberc Lung Dis 2001; 5 : 887-93. |
| 28. Mejri F, Tritar S, Dafghous H, Ben Khelifa M. Facteurs de risque de la tuberculose multi résistante : Rev Mal Resp. 2015 ; 32(S) : A233-A234. |
| 29. Snène H, Daghfous H, Ben Saad S, Ben Khalifa M, Zarrouk M, Slim L et al. La tuberculose multi résistante : état des lieux en Tunisie. Rev Mal Resp. 2015; 32 : A234. |
| 30. Fikal S, Sajari H, Serhane S, Antbatahar S, Rachid H et al. Tuberculose multi résistante. Rev Mal Resp. 2016; 33: A151-A152. |
| 31. Paz M, Argemi X, Schramm F, Mielcarek M, Kassegne L, Hansmann Y et al. Tuberculose multi résistante : Une prise en charge qui pèse lourde aux hôpitaux universitaires de Strasbourg. Rev Mal Resp. 2019 ; 36(9): 1011-1019. |
| 32. Djibril SK, Ndiaye M, Kane M, Sawadogo B, Laurent M, Diallo F et al. Profil épidémiologique de la tuberculose au Sénégal de 2009-2018. 2022; 70(3): S161-S162. |
| 33. Anon JC, Yeo L, Toh Y, Dembélé B, Dje-bi H, Samogo MN et al. Les défis de la prise en charge de la tuberculose multi résistante hors des capitales africaines. Rev Mal Resp. 2020; 12(1): 166-363. |
ARTICLE INFO DOI: 10.12699/jfvpulm.14.43.2023.27
Conflict of Interest
Non
Date of manuscript receiving
25/01/2023
Date of publication after correction
25/06/2023
Article citation
Dlinga, R. Ngakoutou, A. Ahmet , AM. Medila Moussa, KA. Adjougoulta, KDB. Adjougoulta, J. Madtoingue , KA. Aziagbe. Evaluation Of The Profiles Of Patients With Multidrug-Resistant Tuberculosis At The University Hospital Center The National Reference Of N'djamena-Chad. J Func Vent Pulm 2023;43(14):27-33