
 English
English
 French
French
Epidemiological, etiological, therapeutic and evolutionary aspects of pneumothorax at the University Hospital ylvanus Olympio of Lome - Togo
Aspects épidémiologiques, étiologiques, thérapeutiques et évolutif de pneumothorax au CHU Sylvanus Olympio de Lome - Togo
K.A. Aziagbe1, N.A. Ogounde1, D. Dlinga1, P. Efalou2, R. Ngakoutou3, M.D. Biaou1, S. Adambounou1, A.G. Gbadamassi1, K.S. Adjoh1
1: Service de Pneumologie du CHU Sylvanus Olympio de Lomé. Togo
2: Service de Pneumologie du CHU Kara. Togo
3:Service de Pneumologie du CHU N’Djamena. Tchad
Corresponding author: Koffi Atsu AZIAGBE. Service de Pneumologie du CHU Sylvanus Olympio de Lomé. Togo
E-mail: aziagbekoffiatsu@yahoo.fr
ABSTRACT
Introduction. Pneumothorax is common in Africa and particularly in Togo. This high frequency is linked to two diseases in our countries, namely bacterial pneumopathies and tuberculosis. The objective of this study was to update data on the different aspects of pneumothorax in Togo.
Method. This is a prospective and descriptive study on pneumothorax during the period from January 1, 2017 to December 31, 2019 in the pneumo-phtisiology service of the University Hospital Sylvanus Olympio of Lomé (Togo).
Results. 40 cases of pneumothorax were recorded, representing a hospital frequency of 2.38%. The most affected age groups were 26-45 years old (40%) with a predominance of males (M/F ratio=2.33). Smoking (32.5%) and undernutrition (55.5%) were the main contributing factors. Acute bacterial pneumopathy (59%) and tuberculosis (28.0%) were the main etiologies of secondary pneumothorax. Pleural drainage (62.5%) combined with antibiotic therapy (59.0%) or tuberculosis treatment (28.2%) were the main means of management. The evolution was favourable at 90.0%. In-hospital mortality was 7.5%.
Conclusion. Pneumothorax remains an emergency in our settings. The etiologies are dominated by bacterial infections and tuberculosis. The evolution is sometimes marked by complications such as residual pneumothorax or pachypleuritis.
KEYWORDS: Pneumothorax; Drainage; Lome.
RÉSUMÉ
Introduction. Le pneumothorax est fréquent en Afrique et en particulier au Togo. Cette fréquence élevée est liée à deux affections dans nos contrés notamment les pneumopathies aiguées bactériennes et la tuberculose. L’objectif de cette étude était d’actualiser les données sur les différents aspects de pneumothorax au Togo.
Méthode. Il s’agit d’une étude prospective et descriptive sur le pneumothorax durant la période du 1er janvier 2017 au 31 décembre 2019 dans le service de pneumo-phtisiologie du CHU Sylvanus Olympio de Lomé (Togo).
Résultats. 40 cas de pneumothorax ont été recensés représentant une fréquence hospitalière de 2,38%. Les tranches d’âge les plus touchées étaient de 26-45 ans (40%) avec une prédominance masculine (ratio H/F=2,33). Le tabagisme (32,5%), la dénutrition (55,5%) constituaient les principaux facteurs favorisants. La pneumopathie aiguée bactérienne (59%) et la tuberculose (28,0%) étaient les principales étiologies du pneumothorax secondaire. Le drainage pleural (62,5%) associé à l’antibiothérapie (59,0%) ou au traitement antituberculeux (28,2%) étaient les principaux moyens de prise en charge. L’évolution était favorable à 90,0%. Nous avons enregistré une mortalité hospitalière de 7,5%.
Conclusion. le pneumothorax reste une urgence dans nos milieux. Les étiologies sont dominées par les infections bactériennes et la tuberculose. L’évolution est parfois émaillée des complications à type de pneumothorax résiduel ou de pachypleurite.
MOTS CLÉS: Pneumothorax; Drainage; Lomé.
INTRODUCTION
Le pneumothorax se définit comme la présence d’air dans la cavité pleurale responsable d’un collapsus partiel ou complet du poumon adjacent. Un épanchement gazeux important surtout lorsqu’il survient sur un poumon pathologique peut compromettre sérieusement les échanges gazeux et l’hémodynamique respiratoire. Sa gravité est liée à sa répercussion cardio-respiratoire, quel que soit le contexte de survenue pouvant mettre en jeu le pronostic vital du patient en l’absence des mesures d’urgences. Le pneumothorax spontané est la forme la plus fréquente et la plus décrite dans la littérature [1–3]. Dans les pays en voie de développement, selon plusieurs études réalisées, la tuberculose est la principale étiologie infectieuse observée au cours des formes secondaires du pneumothorax [3,4]. Au Togo, le pneumothorax est fréquemment observé. Une étude réalisée en 2005 avait noté une fréquence hospitalière, de 1,4% [3]. Cependant du fait de son caractère rétrospectif, certains aspects notamment étiologiques, thérapeutiques et évolutifs n’ont pas été correctement documentés. Près de quinze (15) ans après cette étude, les pratiques du service en matière de la prise en charge des pathologies pleurales ont évolué avec notamment l’introduction de la pleurodèse médicale. Ainsi il parait licite d’actualiser les données sur les différents aspects à travers une étude prospective. L’objectif de ce travail était d’étudier le pneumothorax dans le service de pneumo-phtisiologie du CHU Sylvanus Olympio de Lomé au Togo.
METHODE
Il s’agit d’une étude prospective et descriptive qui s’est déroulée du 1er janvier 2017 au 31 décembre 2019 dans le service de pneumo-phtisiologie du CHU Sylvanus Olympio de Lomé (Togo). Etaient inclus dans notre étude, les patients de tout âge et des deux sexes, hospitalisés durant la période d’étude dans le service pour pneumothorax ou hydropneumothorax de confirmation radiologique. Les données étaient recueillies à l’aide d’un questionnaire établi sur une fiche d’enquête avec le consentement du malade à participer à l’étude. Les données épidémiologiques, cliniques, paracliniques, étiologiques, thérapeutiques, évolutives avaient été analysées. Le logiciel Epi info dans sa version 3.5.4 nous a permis d’analyser ces données. La comparaison des données a été réalisée par le test Chi2 ou le test exact de Fisher et le test Student avec une valeur de p<0,05 étant considérée comme significative. La recherche des facteurs associés à l’évolution non favorable a été réalisée grâce à une analyse bivariée.
RESULTATS
Sur un total de 1678 patients, nous avons enregistré 40
cas de pneumothorax correspondant à une fréquence hospitalière de 2,38%.
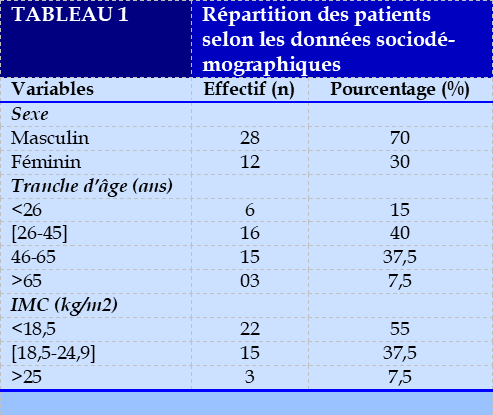
Données sociodémographiques
L’âge médian de nos patients était de 43,5 ans avec des extrêmes allant de 16 ans à 85 ans. Les tranches d’âge de 26-45 ans étaient la plus représentée dans 40% des cas (Tableau 1).
Données cliniques
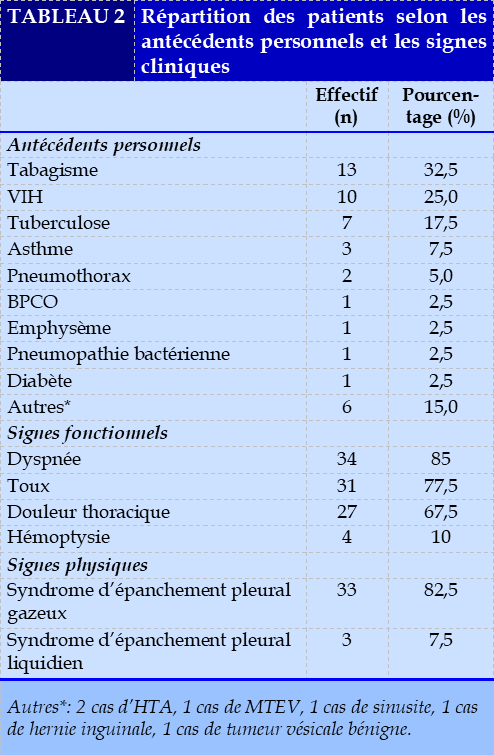
Antécédents des patients
Le Tableau 2 résume les antécédents pathologiques et les signes cliniques de notre population d’étude.
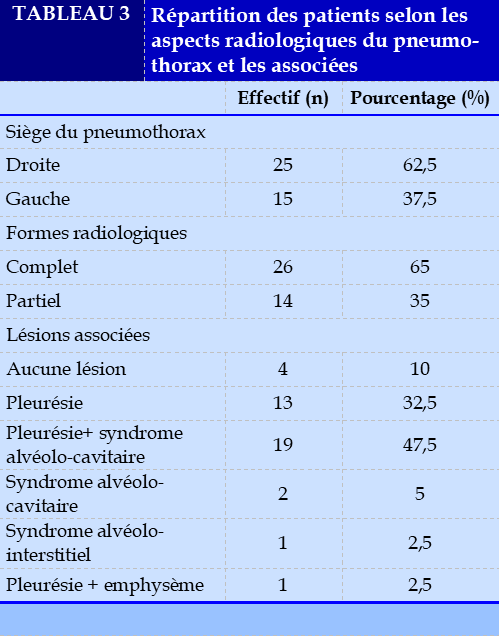
Données paracliniques
Tous nos patients ont bénéficié d’une radiographie pulmonaire. Le Tableau 3 résume les différents aspects radiologiques du pneumothorax ainsi que les lésions associées.
Données étiologiques
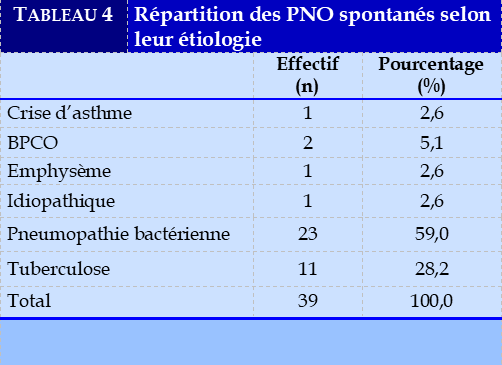
Le PNO spontané était l’étiologie la plus retrouvée dans 97,5%. Nous avons enregistré un cas (2,5%) de PNO iatrogène post-œsophagoscopie. Le Tableau 4 illustre les différentes étiologies des pneumothorax spontanés.
Données thérapeutiques
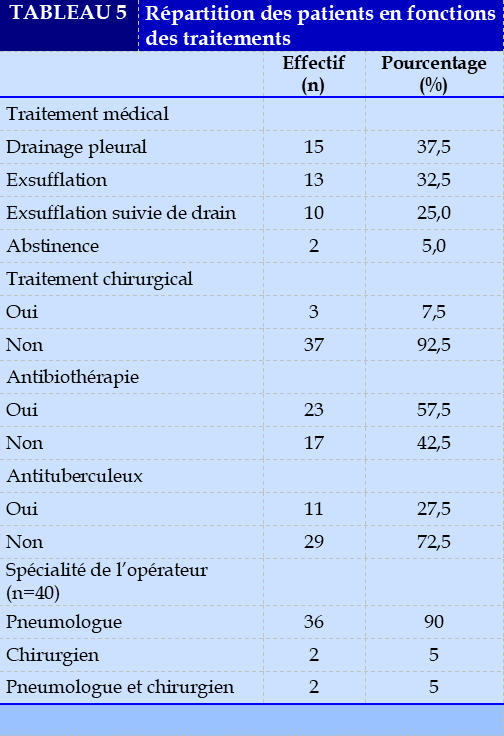
Le drainage thoracique était le geste le plus pratiqué (37,5% en première intention et 25% après échec de l’exsufflation). Les gestes médicaux étaient réalisés à 90% par le pneumologue. Le Tableau 4 résume la répartition des patients en fonctions des traitements.
Données évolutives
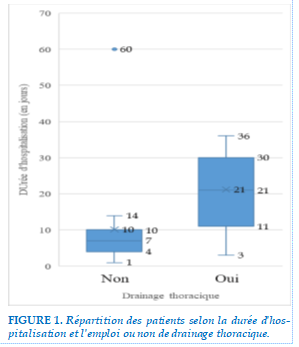
La durée médiane d’hospitalisation des patients était de 19±18 jours avec des extrêmes de 1 à 86 jours. La figure suivante illustre la répartition des patients selon la durée d’hospitalisation et l’emploi ou non du drainage pleural.
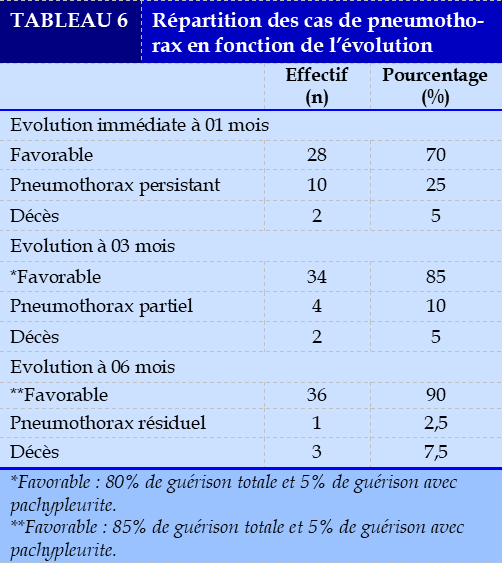
Le Tableau 6 montre la répartition en fonction de l’évolution.
Facteurs associés à l’évolution favorable ou non
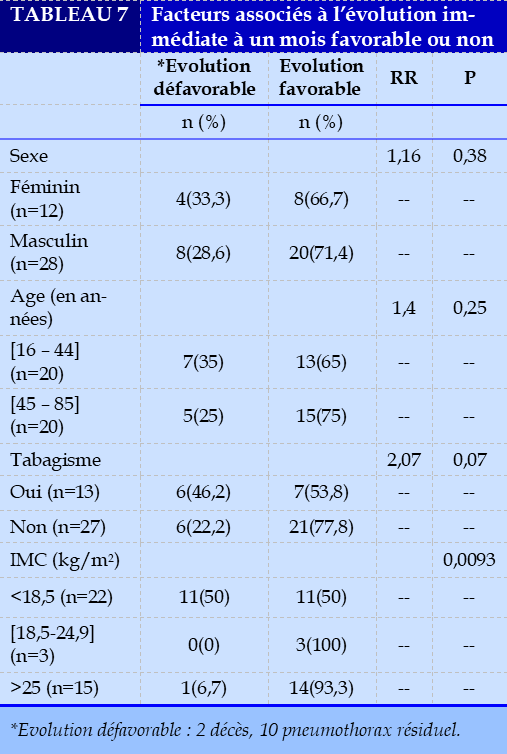
Le Tableau 7 résume les différents facteurs associés à l’évolution immédiate à un mois
DISCUSSION
La fréquence hospitalière du pneumothorax dans notre étude était de 2,38%. Mbatchou et al. [2] au Sénégal avaient retrouvé une fréquence supérieure à la nôtre dans 6,93%. En effet, la fréquence hospitalière du pneumothorax diffère selon études. Les tranches d’âge de 26-45 ans étaient la plus représentée dans 40% des cas. Des tranches d’âge similaires avaient été retrouvées par Hounkpati et al. [3] au Togo (21 à 40 ans), Mbatchou et al. [2] (21-40 ans) mais avec des taux légèrement supérieurs au notre dans 47,4% et 49,3 %. Cette tranche d’âge jeune pourrait s’expliquer par le fait que les principales étiologies du pneumothorax en Afrique (tuberculeuse et infection bactérienne) sont les pathologies des sujets jeunes dues à l’émergence du tabagisme et la recrudescence du VIH en Afrique. Les 40 patients étaient composés de 28 hommes (70%) soit une sex-ratio H/F de 2,33. La même prédominance masculine a été rapportée par plusieurs auteurs [2,5,6]. Cette prédominance masculine s’expliquerait par le fait que le sujet de sexe masculin s’expose plus à l’intoxication tabagique qui est un facteur favorisant de la fragilisation du parenchyme pulmonaire et des pneumothorax d’origine infectieuse comme la tuberculose. La majorité de nos patients (55%) étaient en insuffisance pondérale avec un IMC inférieur à 18,5 kg/m2. En effet, l’insuffisance pondérale est un facteur prédisposant au développement du pneumothorax selon les données de la littérature par la formation des bulles d’emphysème et de bleds [7].
Dans notre série, environ le tiers des patients avaient des antécédents de tabagisme (32,5%). Bel Hadj et al. [8] en Tunisie, Zegmout et al. [9], Habibi et al. [1] au Maroc avaient retrouvé les mêmes antécédents de tabagisme mais avec des taux plus élevés dans respectivement 75%, 80% et 81,2%. Ces taux plus élevés par rapport au notre seraient dus à un tabagisme plus élevé dans ces pays. Plusieurs études ont souligné l'imputabilité du tabagisme dans la survenue du pneumothorax du fait de l´obstruction chronique des voies respiratoires [10–12]. Les antécédents de VIH et de tuberculose étaient les plus retrouvés dans respectivement 25% et 17,5%. El Jeilany et al. [13] au Sénégal, Elkard et al. [14] au Maroc avaient retrouvé les antécédents de tuberculose dans respectivement 30,9% et 19% des cas. Les antécédents de tuberculose avec des lésions séquellaires à type de bulles peuvent être la cause de pneumothorax par rupture dans l’espace pleural. De même, l’infection au VIH expose au risque de développer une tuberculose active avec comme conséquence le pneumothorax par rupture des cavernes au cours des efforts de toux sans oublier le pneumothorax induit par les pneumopathies non tuberculeuses en occurrence la pneumocystose.
Dans notre étude, les signes fonctionnels les plus retrouvés étaient la dyspnée (85%), la toux (77,5%), la douleur thoracique (67,5%). Les mêmes symptômes ont été retrouvés dans plusieurs études [5,13,15]. Il s’agit des symptômes classiques des pathologies pleurales. L’examen pleuropulmonaire avait permis de retrouver un syndrome d’épanchement pleural mixte et gazeux dans respectivement 82,5% et 7,5% des cas. Notre taux diffère de celui de El Jeilany et al. [13] qui avaient retrouvé 52,7% de syndrome d’épanchement pleural mixte contre 38,9% de syndrome d’épanchement pleural gazeux.
Les pneumothorax complet et partiel étaient retrouvés respectivement dans 65% et 35%. Habibi et al [1] au Maroc avaient retrouvé aussi une prédominance de pneumothorax unilatéral complet (79,7%). Le pneumothorax était localisé majoritairement à droite dans 62,5%. Plusieurs auteurs avaient fait le même constat [1,3,5,13,16]. Cette prédominance du pneumothorax du côté droit pourrait s’expliquer par l’anatomie de la bronche souche droite, plus verticale facilitant les affections pleuropulmonaires. La pleurésie a été la lésion associée la plus retrouvée dans 82,5% des cas dans notre série. Ce résultat vient corroborer celui de Hounkpati et al. [3] qui avaient retrouvé 84,6% de pleurésie. Cette pleurésie peut être la conséquence de l’irritation de la plèvre par les lésions parenchymateuses. Par contre, Arfaoui et al. [17] au Maroc avaient retrouvé que plus du tiers des lésions associées au pneumothorax était de bulles (77,4%). En effet, en Afrique sub-saharienne, les pneumopathies bactériennes et la tuberculose sont les principales causes de pneumothorax entrainant le plus souvent des lésions parenchymateuses. Par contre, en Afrique du nord, l’association des bulles au pneumothorax s’explique par le fait que l’étiologie de pneumothorax est liée plus aux broncho-pneumopathies chroniques obstructives post-tabagiques.
Dans notre étude, les pneumothorax spontanés secondaires (97,4%) prédominaient par rapport aux formes spontanées primitives (2,6%). Le même constat a été fait par Moubachir et al. [6] au Maroc. Par contre Ayed et al. [18] au Koweit avaient noté dans leurs séries une prédominance des formes primitives contre les formes secondaires. Cette prédominance des pneumothorax spontanés secondaires en Afrique s’expliquerait par le fait que les pneumopathies bactériennes constituent la première cause des infections pulmonaires non tuberculeuses et la tuberculose qui sévit de façon endémique surtout en Afrique sub-saharienne. Mais dans les pays occidentaux, ce sont les broncho-pneumopathies chroniques obstructives qui prédominent dans les étiologies de pneumothorax spontané secondaire lié le plus souvent au tabagisme.
Les pneumothorax complet et partiel étaient retrouvés respectivement dans 65% et 35%. Habibi et al [1] au Maroc avaient retrouvé aussi une prédominance de pneumothorax unilatéral complet (79,7%). Le pneumothorax était localisé majoritairement à droite dans 62,5%. Plusieurs auteurs avaient fait le même constat [1,3,5,13,16]. Cette prédominance du pneumothorax du côté droit pourrait s’expliquer par l’anatomie de la bronche souche droite, plus verticale facilitant les affections pleuropulmonaires. La pleurésie a été la lésion associée la plus retrouvée dans 82,5% des cas dans notre série. Ce résultat vient corroborer celui de Hounkpati et al. [3] qui avaient retrouvé 84,6% de pleurésie.
Cette pleurésie peut être la conséquence de l’irritation de la plèvre par les lésions parenchymateuses. Par contre, Arfaoui et al. [17] au Maroc avaient retrouvé que plus du tiers des lésions associées au pneumothorax était de bulles (77,4%). En effet, en Afrique sub-saharienne, les pneumopathies bactériennes et la tuberculose sont les principales causes de pneumothorax entrainant le plus souvent des lésions parenchymateuses. Par contre, en Afrique du nord, l’association des bulles au pneumothorax s’explique par le fait que l’étiologie de pneumothorax est liée plus aux broncho-pneumopathies chroniques obstructives post-tabagiques. Dans notre étude, les pneumothorax spontanés secondaires (97,4%) prédominaient par rapport aux formes spontanées primitives (2,6%). Le même constat a été fait par Moubachir et al. [6] au Maroc. Par contre Ayed et al. [18] au Koweit avaient noté dans leurs séries une prédominance des formes primitives contre les formes secondaires. Cette prédominance des pneumothorax spontanés secondaires en Afrique s’expliquerait par le fait que les pneumopathies bactériennes constituent la première cause des infections pulmonaires non tuberculeuses et la tuberculose qui sévit de façon endémique surtout en Afrique sub-saharienne. Mais dans les pays occidentaux, ce sont les broncho-pneumopathies chroniques obstructives qui prédominent dans les étiologies de pneumothorax spontané secondaire lié le plus souvent au tabagisme.
CONCLUSION
Le pneumothorax reste une urgence surtout s’il est compressif ou suffocant ou associé à d’autres lésions. Sa prévention repose sur l’éviction des principaux facteurs favorisant qui sont le tabagisme et la dénutrition. Son traitement de référence qui est le drainage pleural impose des politiques sanitaires dans nos pays pour son accessibilité à tous.
CONFLIT D’INTERETS
Non.
REFERENCE
| 1. Habibi B, Achachi L, Hayoun S, Raoufi M, Herrak L, Ftouh M El. La prise en charge du pneumothorax spontané: à propos de 138 cas. Pan Afr Med J 2017;26. |
| 2. Mbatchou Ngahane BH, Dia Kane Y, Diatta A, Toure Badiane NO, et al. Etiologies du pneumothorax spontané au Sénégal: étude prospective au CHU de Fann-Dakar. Médecine Trop 2010;70(5‑6):505‑8. |
| 3. Hounkpati A, Tidjani O. 438 Pneumothorax spontané : épidémiologie et prise en charge en milieu africain. Rev Mal Respir 2007;24:132. |
| 4. Atlaoui N, Berkat H, Hamache N. Prise en charge du pneumothorax spontané : à propos de 154 cas. Rev Mal Respir 2017;34:A116‑7. |
| 5. Azzeddine R, Zegmout A, Souhi H, Elouazzani H, Rhorfi IA, Abid A. Profil clinique, étiologique thérapeutique et évolutif des pneumothorax spontanés. Rev Mal Respir 2018;35:A159‑60. |
| 6. Moubachir H, Zaghba N, Benjelloun H, Bakhatar A, Yassine N. Prise en charge du premier épisode de pneumothorax spontané. Rev Mal Respir 2015; |
| 7. Tan J, Yang Y, Zhong J, Zuo C, et al. Association Between BMI and Recurrence of Primary Spontaneous Pneumothorax. World J Surg 2017;41(5):1274‑80. |
| 8. Bel Hadj N, Fezai N, Aissa S, et al. Pneumothorax spontané : aspect clinique, thérapeutique et évolutif. Rev Mal Respir 2018;35:A161. |
| 9. Zegmout A, Tiresse N, Souhi H, El Ouazzani H, Rhorfi A, Abid A. Profil clinique, thérapeutique et évolutif des pneumothorax spontanés. Rev Mal Respir 2017;34:A107. |
| 10. MacDuff A, Arnold A, Harvey J. Management of spontaneous pneumothorax: British Thoracic Society pleural disease guideline 2010. Thorax 2010;65. |
| 11. Ruppert AM, Perrin J, Khalil A, Vieira T, Abou-Chedid D, et al. Effect of cannabis and tobacco on emphysema in patients with spontaneous pneumothorax. Diagn Interv Imaging 2018;99(7‑8):465‑71. |
| 12. Underner M, Urban T, Perriot J, Peiffer G, Harika-Germaneau G, Jaafari N. Spontaneous pneumothorax and lung emphysema in cannabis users. Rev Pneumol Clin 2018;74(6):400‑15. |
| 13. El Jeilany A, Ka W, Fafa Cisse M, Oumar Toure N, Thiam K, Dia Y, et al. Pneumothorax: profil épidémiologique, clinique, paraclinique et évolutif chez les patients hospitalisés en pneumologie. Rev des Mal Respir Actual 2020;12(1):255‑6. |
| 14. Elkard I, Benjelloun H, Zaghba N, Yassine N. Prise en charge du pneumothorax spontané. Rev Mal Respir 2016;33:A253‑4. |
| 15. Jaafar M, Noureddine R, Ouledlaid H, Gharnaout M. Profil épidémiologique, clinique et évolutif du pneumothorax spontané : à propos de 100 cas. Rev Mal Respir 2016;33:A253. |
| 16. Moubachir H, Mahboub FZ, Jabri H, Elkhattabi W, Afif H. Particularités du pneumothorax chez le sujet jeune : 97 cas. Rev Mal Respir 2017;34:A111. |
| 17. Arfaoui H, Jabri H, Elkhattabi W, Moubachir H, Afif H. Pneumothorax spontané secondaire : profil étiologique et évolutif. Rev Mal Respir 2016;33:A255. |
| 18. Ayed AK, Bazerbashi S, Ben-Nakhi M, Chandrasekran C, Sukumar M, Al-Rowayeh A, et al. Risk factors of spontaneous pneumothorax in Kuwait. Med Princ Pract 2006;15(5):338‑42. |
| 19. Cunnington J. Spontaneous pneumothorax. Clin Evid 2002;(7):1384‑90. |
| 20. Baumann MH, Noppen M. Pneumothorax. Respirology2004;9(2):157‑64. |
| 21. Noppen M, Alexander P, Driesen P, Slabbynck H, Verstraeten A. Manual aspiration versus chest tube drainage in first episodes of primary spontaneous pneumothorax: A multicenter, prospective, randomized pilot study. Am J Respir Crit Care Med 2002;165(9):1240‑4. |
Figure - Tables
REFERENCE
| 1. Habibi B, Achachi L, Hayoun S, Raoufi M, Herrak L, Ftouh M El. La prise en charge du pneumothorax spontané: à propos de 138 cas. Pan Afr Med J 2017;26. |
| 2. Mbatchou Ngahane BH, Dia Kane Y, Diatta A, Toure Badiane NO, et al. Etiologies du pneumothorax spontané au Sénégal: étude prospective au CHU de Fann-Dakar. Médecine Trop 2010;70(5‑6):505‑8. |
| 3. Hounkpati A, Tidjani O. 438 Pneumothorax spontané : épidémiologie et prise en charge en milieu africain. Rev Mal Respir 2007;24:132. |
| 4. Atlaoui N, Berkat H, Hamache N. Prise en charge du pneumothorax spontané : à propos de 154 cas. Rev Mal Respir 2017;34:A116‑7. |
| 5. Azzeddine R, Zegmout A, Souhi H, Elouazzani H, Rhorfi IA, Abid A. Profil clinique, étiologique thérapeutique et évolutif des pneumothorax spontanés. Rev Mal Respir 2018;35:A159‑60. |
| 6. Moubachir H, Zaghba N, Benjelloun H, Bakhatar A, Yassine N. Prise en charge du premier épisode de pneumothorax spontané. Rev Mal Respir 2015; |
| 7. Tan J, Yang Y, Zhong J, Zuo C, et al. Association Between BMI and Recurrence of Primary Spontaneous Pneumothorax. World J Surg 2017;41(5):1274‑80. |
| 8. Bel Hadj N, Fezai N, Aissa S, et al. Pneumothorax spontané : aspect clinique, thérapeutique et évolutif. Rev Mal Respir 2018;35:A161. |
| 9. Zegmout A, Tiresse N, Souhi H, El Ouazzani H, Rhorfi A, Abid A. Profil clinique, thérapeutique et évolutif des pneumothorax spontanés. Rev Mal Respir 2017;34:A107. |
| 10. MacDuff A, Arnold A, Harvey J. Management of spontaneous pneumothorax: British Thoracic Society pleural disease guideline 2010. Thorax 2010;65. |
| 11. Ruppert AM, Perrin J, Khalil A, Vieira T, Abou-Chedid D, et al. Effect of cannabis and tobacco on emphysema in patients with spontaneous pneumothorax. Diagn Interv Imaging 2018;99(7‑8):465‑71. |
| 12. Underner M, Urban T, Perriot J, Peiffer G, Harika-Germaneau G, Jaafari N. Spontaneous pneumothorax and lung emphysema in cannabis users. Rev Pneumol Clin 2018;74(6):400‑15. |
| 13. El Jeilany A, Ka W, Fafa Cisse M, Oumar Toure N, Thiam K, Dia Y, et al. Pneumothorax: profil épidémiologique, clinique, paraclinique et évolutif chez les patients hospitalisés en pneumologie. Rev des Mal Respir Actual 2020;12(1):255‑6. |
| 14. Elkard I, Benjelloun H, Zaghba N, Yassine N. Prise en charge du pneumothorax spontané. Rev Mal Respir 2016;33:A253‑4. |
| 15. Jaafar M, Noureddine R, Ouledlaid H, Gharnaout M. Profil épidémiologique, clinique et évolutif du pneumothorax spontané : à propos de 100 cas. Rev Mal Respir 2016;33:A253. |
| 16. Moubachir H, Mahboub FZ, Jabri H, Elkhattabi W, Afif H. Particularités du pneumothorax chez le sujet jeune : 97 cas. Rev Mal Respir 2017;34:A111. |
| 17. Arfaoui H, Jabri H, Elkhattabi W, Moubachir H, Afif H. Pneumothorax spontané secondaire : profil étiologique et évolutif. Rev Mal Respir 2016;33:A255. |
| 18. Ayed AK, Bazerbashi S, Ben-Nakhi M, Chandrasekran C, Sukumar M, Al-Rowayeh A, et al. Risk factors of spontaneous pneumothorax in Kuwait. Med Princ Pract 2006;15(5):338‑42. |
| 19. Cunnington J. Spontaneous pneumothorax. Clin Evid 2002;(7):1384‑90. |
| 20. Baumann MH, Noppen M. Pneumothorax. Respirology2004;9(2):157‑64. |
| 21. Noppen M, Alexander P, Driesen P, Slabbynck H, Verstraeten A. Manual aspiration versus chest tube drainage in first episodes of primary spontaneous pneumothorax: A multicenter, prospective, randomized pilot study. Am J Respir Crit Care Med 2002;165(9):1240‑4. |
ARTICLE INFO DOI: 10.12699/jfvpulm.13.39.2022.20
Conflict of Interest
Non
Date of manuscript receiving
18/01/2022
Date of publication after correction
18/04/2022
Article citation
K.A. Aziagbe, N.A. Ogounde, D. Dlinga, P. Efalou, R. Ngakoutou, M.D. Biaou, S. Adambounou, A.G. Gbadamassi, K.S. Adjoh. Epidemiological, etiological, therapeutic and evolutionary aspects of pneumothorax at the University Hospital ylvanus Olympio of Lome - Togo. J Func Vent Pulm 2022;39(13):20-25