
 English
English
 French
French
Diffuse interstitial lung disease and mixed connective tissue disease: about two cases
Pneumopathie interstitielle diffuse et connectivite mixte: à propos de deux cas
F.Z.Yousfi, S. Guerrouj, T.M. Sandouno, H. Kouismi
Service de Pneumologie, CHU Mohammed VI
Faculté de médecine, Université Mohammed Premier. Oujda
Corresponding author:
F.Z.Yousfi. Service de Pneumologie, CHU Mohammed VI
Faculté de médecine, Université Mohammed Premier. Oujda.
E-mail: yousfifatimazahra112@gmail.com
ABSTRACT
Introduction. Pulmonary damage, including interstitial damage, is frequent, heterogeneous and of variable prognosis in systemic autoimmune diseases. We report two cases of diffuse infiltrative pneumonitis associated with mixed connectivity.
Observation. Diffuse infiltrative pneumonitis (DIP) is one of the main pulmonary manifestations of mixed connective tissue disease (CD). Along with pulmonary hypertension, it represents a major prognostic factor. Its presence is not always associated with an unfavorable outcome, with some cases responding satisfactorily to corticosteroid therapy. We report two cases of diffuse infiltrative pneumonitis associated with mixed connectivity.
Conclusion. The characteristics of DIP/CD are heterogeneous and can be considered as a combination of those of PID associated with other major connectivities. Treatment varies with disease severity and organ involvement but usually includes corticosteroids with or without immunosuppressants.
KEYWORDS: Interstitial lung disease; Mixed connective tissue disease; Anti-ribonucleoprotein antibodies.
RÉSUMÉ
Introduction. Les atteintes pulmonaires dont les atteintes interstitielles sont fréquentes, hétérogènes et de pronostic variable au cours des maladies systémiques auto-immunes. Nous rapportons deux observations d’une pneumopathie infiltrative diffuse associée à une connectivité mixte.
Observation. La pneumopathie infiltrative diffuse (PID) constitue une des principales manifestations pulmonaires de la connectivite mixte (CM). Elle représente avec l’hypertension pulmonaire, un facteur pronostic majeur. Sa présence n’est pas toujours associée à une évolution défavorable, certains cas répondant de manière satisfaisante à la corticothérapie. Nous rapportons deux observations d’une pneumopathie infiltrative diffuse associée à une connectivité mixte.
Conclusion. Les caractéristiques de la PID/CM sont hétérogènes et peuvent être considérées comme une combinaison de celles des PID associées aux autres connectivites majeures. Le traitement varie selon la gravité des maladies et l’atteinte d’organes mais comprend habituellement des corticostéroïdes avec ou sans immunosuppresseurs.
MOTS CLÉS: Pneumopathie interstitiel diffuse; Connectivite mixte; Anticorps anti-ribonucléoprotéine.
INTRODUCTION
La pneumopathie infiltrative diffuse (PID) constitue une des principales manifestations pulmonaires de la connectivite mixte (CM). Elle représente avec l’hypertension pulmonaire, un facteur pronostic majeur.
Sa présence n’est pas toujours associée à une évolution défavorable, certains cas répondant de manière satisfaisante à la corticothérapie [1].
Nous rapportons deux observations d’une pneumopathie infiltrative diffuse associée à une connectivité mixte.
Observation n°1
Patiente âgée de 29 ans, sans antécédents pathologiques notable qui présentait des polyarthragies d’ allure inflammatoire, un syndrome sec buccal, oculaire et des myalgies associées à une dyspnée d’ effort et une toux sèche chronique depuis une année évoluant dans un contexte d’ apyrexie et de conservation de l’ état général.
L’examen physique objectivait une douleur à la mobilisation active et passive des articulations, une bouffissure de visage, un déficit modéré des ceintures scapulaires et pelviennes, un hippocratisme digital bilatéral et des rals crépitants basithoracique bilatéraux.
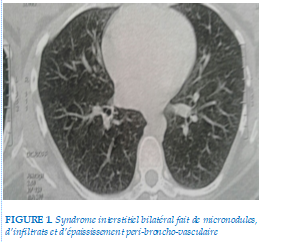
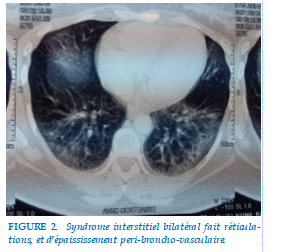
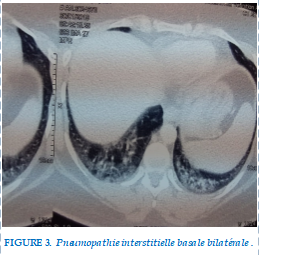
Bilan radiologique fait d’une TDM thoracique coupe millimétrique objectivait pneumopathie interstitielle bilatérale fait de micronodules, d’infiltrats et d’épaississement peribroncho-vasculaire (Figure 1, 2, 3).
Les explorations fonctionnelles respiratoires étaient en faveur d’un syndrome restrictif sévère.
La Fibroscopie bronchique objectivait un aspect inflammatoire de la muqueuse bronchique et un LBA marqué par un taux élevé de lymphocyte.
La BGSA objectivant une siladenite lymphocytaire focale de grade 4 de Chisholm et Mason, typique d’un syndrome de Gougerot Jorgen.
Un EMG était en rapport avec un tracé myogène
Devant ce faisceau d’arguments cliniques, radiologiques et biologiques nous avons retenu le diagnostic de PID dans le cadre d’une connectivite mixte faite de l’association d’une myosite et d’un syndrome de Goujerot shogren avec polyarthrite rhumatoïde:
Patient était traitée par un bolus de corticoïde puis relais par voie orale à la dose de 1mg /kg/j avec bonne évolution clinique et biologique.
Observation n°2
Patiente âgée de 47 ans, admise pour une faiblesse musculaire des deux membres supérieures et une déformation du deuxième doigt de la main gauche associé à une toux sèche chronique.
Examen physique objectivait une limitation de l’ouverture buccale Une sclérose cutané Une atteinte musculaire : (Signe tabouret) positif Rals crépitants secs basi thoracique bilatéraux
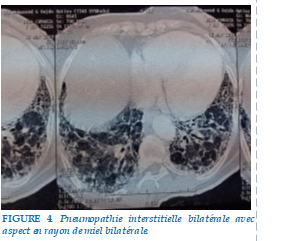
Une TDM thoracique : une pneumopathie interstitielle bilatérale avec Aspect en rayon de miel des bases, Images en verre dépoli Bronchectasies de traction (Figure 4).
l’alternative thérapeutique était de démarrer le rituxumab 1g J1 et J15.
DISCUSSION
La connectivite mixte (CM) est une connectivite rare caractérisée par la combinaison de manifestations cliniques de lupus érythémateux aigu disséminé (LEAD), de polymyosite dermatomyosite (PM/DM), de sclérodermie systémique (SS) et de polyarthrite rhumatoïde (PR) associée à la présence dans le sérum d’anticorps anti-nucléaires de type small nuclear ribonucleoprotein (snRNP) à titre élevé[1]. Les manifestations cliniques de la connectivite mixte associent trois éléments constants : le phénomène de Raynaud, l’infiltration des doigts et la polyarthrite non destructrice [1].
L’atteinte pulmonaire est un élément majeur de la connectivite mixte avec une prévalence rapportée de 20 à 87 % [2-3]. Les manifestations respiratoires sont dominées par l’épanchement pleural (50 % des cas), l’hypertension pulmonaire (HTP) (1045 % des cas) et la pneumopathie interstitielle diffuse (PID) [9]. La PID est fréquente lors des connectivites et constitue un facteur pronostique majeur car sa présence est classiquement associée à une plus grande morbimortalité [4].
Sur le plan clinique, la PID/CM n’a pas de spécificité et possède les mêmes caractéristiques que la pneumopathie interstitielle non spécifique ou les fibroses pulmonaires idiopathiques [5].
Dans une étude sur 93 patients porteurs de PID/CM, l’apparition des signes respiratoires était plus fréquente entre deux et quatre ans après le diagnostic [6]. Chez nos deux patientes l’apparition des signes respiratoires étaient notés dans les deux premières années suivant le diagnostic de la connectivite mixte.
Le mode de présentation des PID était progressif chez les deux cas. Il s’agit du mode de survenu le plus fréquemment rapporté dans la CM [5].
Les éléments radiologiques retrouvés chez nos deux patientes sont des réticulations, l’image en verre dépoli, le rayon de miel et les bronchectasies de traction. La plupart des travaux rapporte que le tableau radiologique de la PID/CM n’a pas de caractéristique particulière et s’apparente à celui de la fibrose pulmonaire idiopathique (FPI) ou de la pneumopathie interstitiel non spécifique [7] [8].
Les données sur le lavage broncho alvéolaire dans la connectivite mixte sont peu décrites.
Le lavage broncho alvéolaire était fait chez nos deux patientes revenant en faveur d’un taux élevé de lymphocytes et un liquide inflammatoire chez l’autre cas.
Les anomalies histologiques de la PID/CM comportent une infiltration des septa interalvéolaires par des lymphocytes, des cellules inflammatoires et des fibres collagène de type III [9].
La réponse de la pneumopathie infiltrative diffuse associée aux connectivite mixte à la corticothérapie systémique ou aux immunosuppresseurs non stéroïdiens était initialement décrite comme bonne [5][10][11]. Chez nos deux patientes la réponse observée après traitement corticoïdes était favorable. Sullivan et al ont suivi 20 patients avec PID/CM traités par corticothérapie systémique et ils ont observés une amélioration respiratoire dans 50 % des cas. Certaines études ont observées des réponses encore meilleures : sur 96 PID/CM traités par corticothérapie et cyclophosphamide, 70 % ont présenté une disparition complète de leurs images radiologiques [3].
Le pronostic des patients atteints de connectivite mixte est variable, considéré comme le plus souvent bénin [1] mais pouvant évoluer vers une maladie plus sévère [11].
La principale cause de mortalité de la connectivte mixte est l’hypertension pulmonaire [12]. La pneumopathie infiltrative diffuse n’est pas décrite comme faisant partie des causes directes de mortalité.
Dans la littérature le pronostic de la PID/CM est mal précisé, notamment par rapport à celui de la FPI et des PID associé aux autres connectivites. Néanmoins, de manière générale les PID associées aux connectivites sont reconnues pour avoir un meilleur pronostic que celui des PID idiopathiques.
Le risque néoplasique a été évalué dans une série de 40 patients porteurs de CM : quatre ont développés un cancer, ce qui, par comparaison à une population témoin, semble montrer un risque anormalement élevé, semblable à celui des polymyosites et dermatomyosites [13].
CONCLUSION
Les caractéristiques de la pneumopathie interstitielle associée à une connectivite mixte sont hétérogènes et non spécifiques. Le traitement varie selon la gravité des maladies et l’atteinte d’organes mais comprend habituellement des corticostéroïdes avec ou sans immunosuppresseurs.
CONFLICT OF INTERESTS
Non.
REFERENCE
| 1. Sharp GC, Irvin WS, Tan EM, Gould RG, Holman HR. Mixedconnective tissue disease — an apparently distinct rheuma-tic disease syndrome associated with a specific antibody to anextractable nuclear antigen (ENA). Am J Med 1972;52:148—59. |
| 2. Smolen JS, Steiner G. Mixed connective tissue disease: to beor not to be? Arthritis Rheum 1998;41:768—7. |
| 3. Bodolay E, Szekanecz Z, Devenyi K, Galuska L, Csipo I, VeghJ, et al. Evaluation of interstitial lung disease in mixedconnective tissue disease (MCTD). Rheumatology (Oxford)2005;44:656—61. |
| 4. Antoniou KM, Margaritopoulos G, Economidou F, SiafakasNM. Pivotal clinical dilemmas in collagen vascular diseasesassociated with interstitial lung involvement. Eur Respir J2009;33:882—96. |
| 5. Prakash UB. Respiratory complications in mixed connective tis-sue disease. Clin Chest Med 1998;19:733—46. |
| 6. Vegh J, Szilasi M, Soos G, Devenyi K, Dezso B, Soltesz P, et al.Interstitial lung disease in mixed connective tissue disease. OrvHetil 2005;146:2435—4. |
| 7. Kim EA, Lee KS, Johkoh T, Kim TS, Suh GY, Kwon OJ, etal. Interstitial lung diseases associated with collagen vasculardiseases: radiologic and histopathologic findings. Radiographics2002;22:S151—65. |
| 8. Saito Y, Terada M, Takada T, Ishida T, Moriyama H, Ooi H, etal. Pulmonary involvement in mixed connective tissue disease:comparison with other collagen vascular diseases using highresolution CT. J Comput Assist Tomogr 2002;26:349—5. |
| 9. Wiener-Kronish JP, Solinger AM, Warnock ML, Churg A, OrdonezN, Golden JA. Severe pulmonary involvement in mixed connec-tive tissue disease. Am Rev Respir Dis 1981;124:499—503. |
| 10. Ullivan WD, Hurst DJ, Harmon CE, Esther JH, Agia GA, MaltbyJD, et al. A prospective evaluation emphasizing pulmonaryinvolvement in patients with mixed connective tissue disease.Medecine (Baltimore) 1984;63:92—107. |
| 11. Lundberg IE. The prognosis of mixed connective tissue disease.Rheum Dis Clin North Am 2005;31:535—47. |
| 12. Kasukawa R, Nishimaki T, Takagi T, Miyawaki S, Yokohari R,Tsunematsu T. Pulmonary hypertension in connective tissuedisease. Clinical analysis of sixty patients in multi-institutionalstudy. Clin Rheumatol 1990;9:56—62 |
| 13. Black KA, Zilko PJ, Dawkins RL, Armstrong BK, MastagliaGL. Cancer in connective tissue disease. Arthritis Rheum1982;25:1130 |
Figure
REFERENCE
| 1. Sharp GC, Irvin WS, Tan EM, Gould RG, Holman HR. Mixedconnective tissue disease — an apparently distinct rheuma-tic disease syndrome associated with a specific antibody to anextractable nuclear antigen (ENA). Am J Med 1972;52:148—59. |
| 2. Smolen JS, Steiner G. Mixed connective tissue disease: to beor not to be? Arthritis Rheum 1998;41:768—7. |
| 3. Bodolay E, Szekanecz Z, Devenyi K, Galuska L, Csipo I, VeghJ, et al. Evaluation of interstitial lung disease in mixedconnective tissue disease (MCTD). Rheumatology (Oxford)2005;44:656—61. |
| 4. Antoniou KM, Margaritopoulos G, Economidou F, SiafakasNM. Pivotal clinical dilemmas in collagen vascular diseasesassociated with interstitial lung involvement. Eur Respir J2009;33:882—96. |
| 5. Prakash UB. Respiratory complications in mixed connective tis-sue disease. Clin Chest Med 1998;19:733—46. |
| 6. Vegh J, Szilasi M, Soos G, Devenyi K, Dezso B, Soltesz P, et al.Interstitial lung disease in mixed connective tissue disease. OrvHetil 2005;146:2435—4. |
| 7. Kim EA, Lee KS, Johkoh T, Kim TS, Suh GY, Kwon OJ, etal. Interstitial lung diseases associated with collagen vasculardiseases: radiologic and histopathologic findings. Radiographics2002;22:S151—65. |
| 8. Saito Y, Terada M, Takada T, Ishida T, Moriyama H, Ooi H, etal. Pulmonary involvement in mixed connective tissue disease:comparison with other collagen vascular diseases using highresolution CT. J Comput Assist Tomogr 2002;26:349—5. |
| 9. Wiener-Kronish JP, Solinger AM, Warnock ML, Churg A, OrdonezN, Golden JA. Severe pulmonary involvement in mixed connec-tive tissue disease. Am Rev Respir Dis 1981;124:499—503. |
| 10. Ullivan WD, Hurst DJ, Harmon CE, Esther JH, Agia GA, MaltbyJD, et al. A prospective evaluation emphasizing pulmonaryinvolvement in patients with mixed connective tissue disease.Medecine (Baltimore) 1984;63:92—107. |
| 11. Lundberg IE. The prognosis of mixed connective tissue disease.Rheum Dis Clin North Am 2005;31:535—47. |
| 12. Kasukawa R, Nishimaki T, Takagi T, Miyawaki S, Yokohari R,Tsunematsu T. Pulmonary hypertension in connective tissuedisease. Clinical analysis of sixty patients in multi-institutionalstudy. Clin Rheumatol 1990;9:56—62 |
| 13. Black KA, Zilko PJ, Dawkins RL, Armstrong BK, MastagliaGL. Cancer in connective tissue disease. Arthritis Rheum1982;25:1130 |
ARTICLE INFO DOI: 10.12699/jfvpulm.13.39.2022.32
Conflict of Interest
Non
Date of manuscript receiving
18/01/2022
Date of publication after correction
18/04/2022
Article citation
F.Z.Yousfi, S. Guerrouj, T.M. Sandouno, H. Kouismi. Diffuse interstitial lung disease and mixed connective tissue disease: about two cases. J Func Vent Pulm 2022;39(13):32-35