
 English
English
 French
French
Outcome of patients affected by pulmonary tuberculosis with pre-ultraresistant and ultraresistant bacilli in Burkina Faso
Devenir des patients atteints de la tuberculose pulmonaire à bacilles pré-ultraresistants et ultraresistants au Burkina Faso
Boncoungou1, S. Halidou Moussa2, S. Maiga1, AR. Ouédraogo3, GA. Ouédraogo4, G. Ouédraogo1, G. Badoum1, M. Ouédraogo1
1: Service de Pneumologie, Centre Hospitalier Universitaire Yalgado OUEDRAOGO. Ouagadougou – Burkina Faso
2: Service de Pneumologie, Centre Hospitalier Universitaire de Niamey - Niger.
3: Service de Pneumologie, Centre Hospitalier Universitaire de TENGANDOGO. Ouagadougou – Burkina Faso.
4: Service de Pneumologie, Centre Hospitalier Régional de OUAHIGOUYA - Burkina Faso
Corresponding author:
Boncoungou Kadiatou. Service de Pneumologie, Centre Hospitalier Universitaire Yalgado OUEDRAOGO. Ouagadougou – Burkina Faso. E-mail: boncoungou_kadiatou@yahoo.fr
ABSTRACT
Introduction. Pulmonary tuberculosis with pre-extensively drug-resistant (pre-XDR) and extensively drug-resistant (XDR) bacilli are serious forms of drug-resistant tuberculosis and constitute a major public health problem due to their morbidity and mortality. The objective of our study was to determine the outcome of patients suffering from pulmonary tuberculosis with pre-ultra-drug-resistant and ultra-drug-resistant bacilli in Burkina Faso from January 1, 2006 to December 31, 2020. Methods. This was a retrospective cohort study of patients followed for pulmonary tuberculosis with pre-ultra-resistant and ultra-resistant bacilli in the pulmonology department of the Yalgado Ouedraogo University Hospital Center. Results. Out of 308 suspected resistant tuberculosis samples tested, 14 cases of Pre-XDR and XDR tuberculosis were detected, representing a prevalence of 4.54%. The average age of the patients was 46.3 years ± 9.46 with a male predominance of 85.7%. The average diagnostic time was 7.58 months. HIV serology was positive in 21.4% of patients. Eighty-five point seven percent of patients (85.7%) had a history of anti-tuberculosis treatment. The radiographic lesions were extensive in 92.85% of patients. Resistance to fluoroquinolones was present in all patients. Out of ten patients put on treatment for XDR tuberculosis according to the national protocol, the therapeutic success was 66.7%. Major adverse effects such as hypoacusis, severe anemia and psychiatric disorders were recorded. The overall mortality rate was 64.3%. Conclusion. Extensively resistant tuberculosis occurs mainly in patients already treated for tuberculosis. Therapeutic success is low with a very high mortality rate.
KEYWORDS: Extensively resistant tuberculosis; Pre-ultraresistant tuberculosis; Burkina Faso.
RÉSUMÉ
Introduction. La tuberculose pulmonaire à bacilles pré-ultrarésistants (pré-XDR) et et ultrarésistants (XDR) sont des formes graves de tuberculose pharmaco résistante et constituent un problème majeur de santé publique du fait de leur morbidité et de leur mortalité. L’objectif de notre étude était de déterminer le devenir des patients atteints de la tuberculose pulmonaire à bacilles pré-ultrarésistants et ultrarésistants au Burkina Faso du 1er janvier 2006 au 31 décembre 2020. Méthodes. Il s’est agit d’une étude de cohorte rétrospective de patients suivis pour une tuberculose pulmonaire à bacilles pré-ultrarésistants et ultrarésistants dans le service de pneumologie du Centre Hospitalier Universitaire Yalgado Ouedraogo. Résultats. Sur 308 échantillons suspects de tuberculose résistante testés, 14 cas de tuberculose Pré- XDR et XDR ont été dépistés soit une prévalence de 4,54% . La moyenne d’âge des patients était de 46,3 ans ± 9,46 avec une prédominance masculine de 85,7%. Le délai diagnostique moyen était de 7,58 mois. La sérologie VIH était positive chez 21,4% des patients. Quatre vingt cinq virgule sept pourcent des patients (85,7%) avaient un antécédent de traitement antituberculeux. Les lésions radiographiques étaient étendues chez 92,85% des patients. La résistance aux fluoroquinolones était présente chez tous les patients. Sur dix patients mis sous traitement de tuberculose XDR selon le protocole national le succès thérapeutique a été 66,7%. Des effets indésirables majeurs à type d’hypoacousie, d’anémie sévère, de trouble psychiatrique ont été enregistrés. Le taux de mortalité globale a été de 64,3%. Conclusion. La tuberculose ultra résistante survient surtout chez les patients déjà traités pour tuberculose. Le succès thérapeutique est faible avec un taux de mortalité très élevé.
MOTS CLÉS: Tuberculose Ultrarésistante; Tuberculose Pré-ultrarésistante; Burkina Faso.
INTRODUCTION
La tuberculose pharmaco-résistante constitue un défi majeur pour la santé publique. En 2019, l’Organisation Mondiale de la Santé (OMS) estimait à plus de 10 800 le nombre de cas de tuberculose ultrarésistante (XDR-TB) confirmés dans le monde [1].
La tuberculose multirésistante (TB-MR) se définit comme la résistance à l’isoniazide et à la rifampicine. Jusqu’en décembre 2020, la XDR-TB se définissait par une TB-MR résistante à une fluoroquinolone et à au moins un des trois médicaments injectables de deuxième intention, et la tuberculose pré-ultrarésistante (Pré-XDR-TB) par une TB-MR résistante à une fluoroquinolone ou à un des trois médicaments injectables de deuxième intention [1]. Ces définitions ont connu une évolution et depuis le 1er janvier 2021 la Pré-XDR-TB se définit comme toute MDR/RR-TB résistante aux fluoroquinolones. Quant à la XDR-TB elle correspond à une MDR/RR-TB résistante aux fluoroquinolones et à un des médicaments du groupe A (lévofloxacine or moxifloxacine, bédaquiline et linézolide) [2].
A la mi-Septembre 2018, 129 pays et territoires du monde avaient signalé des cas XDR-TB. Les informations provenant de pays disposant de données fiables suggèrent qu'environ 8,5% des cas de TB-MR dans le monde sont susceptibles de développer une XDR-TB [1].
La XDR-TB est associée à un plus mauvais pronostic clinique, une surmortalité, une augmentation des effets indésirables et un surcoût en soins [3]. Selon les données de l’Organisation Mondial de la Santé (OMS) de 2018, 34% des patients avaient terminé leur traitement avec succès, 26% étaient décédés et 21% étaient perdus de vue ou les résultats du traitement n'avaient pas été évalués [1].
En Afrique, on estimait en 2020 à 867 le nombre de cas de XDR-TB confirmés et 568 le nombre de cas de XDR-TB qui avaient commencé leur traitement [1]. Il existe dans cette partie du monde une sous notification probablement due à l’accessibilité aux moyens diagnostiques.
La rareté des données en Afrique sub-saharienne et en particulier au Burkina Faso qui a notifiés ses premiers cas en 2006 [4] nous a conduit à mener cette étude dont l’objectif est de déterminer le devenir des patients atteints de tuberculose pulmonaire à bacilles pré-ultrarésistants et ultrarésistants au Burkina Faso, de 2006 à Décembre 2020.
METHODES
Type et cadre de l’étude
Il s’est agi d’une étude de cohorte rétrospective des patients suivis pour une tuberculose pulmonaire à bacilles pré-ultrarésistants et ultrarésistants au Burkina Faso. Cette étude a été réalisée dans le service de pneumologie du Centre Hospitalier Universitaire Yalgado Ouédraogo (CHU-YO) de Ouagadougou qui est le principal centre de référence pour la prise en charge des cas de tuberculose pré-ultrarésistante et ultrarésistante dans le pays.
Dans notre pays, les activités de prise en charge de la tuberculose sont coordonnées par le Programme National Tuberculose (PNT) à travers ses structures de diagnostic et de traitement, dont le niveau central est représenté par le Centre National de Lutte Antituberculeuse (CNLAT), les deux services de Pneumologie de référence des Centres Hospitaliers Universitaires Yalgado Ouédraogo (CHU-YO) de Ouagadougou et Souro Sanou (CHU-SS) de Bobo-Dioulasso [5].
Population et période de l’étude
La population cible était l’ensemble des patients atteints de tuberculose pulmonaire à bacilles pré-ultrarésistants et ultrarésistants dépistés bactériologiquement par génotypage ou phénotypage et suivis pendant la période allant du 1er janvier 2006 au 31 décembre 2020.
Notons que les patients qui n’avaient pas encore terminé leur traitement avant le 31 décembre 2020 n’ont pas été inclus.
Recueil des données
Les données ont été recueillies à partir d’une fiche d’enquête anonyme. La fiche d’enquête a été remplie à partir des informations contenues dans les dossiers médicaux individuels des patients, les fiches individuelles de suivi thérapeutique des patients, le registre de la tuberculose à bacilles résistant du laboratoire national, le registre de traitement de la tuberculose à bacilles résistant du service de pneumologie du CHU-YO.
Protocole de prise en charge au Burkina Faso
La prise en charge de la tuberculose est gratuite au Burkina Faso. Deux schémas thérapeutiques ont été utilisé en fonction de la période d’inclusion du patient et du protocole thérapeutique en vigueur : La cohorte I (avant 2012) a reçu le protocole suivant : 6 (Capréomycine - Moxifloxacine - Cyclosérine - Acide para - aminosalicylique-Ethambutol/15 (Moxifloxacine - Cyclosérine - Acide para - amino-salicylique-Ethambutol)
La cohorte II (à partir de 2017) a reçu le protocole standardisé suivant : 6 (Amikacine - Bédaquiline- Lévofloxacine - Linézolide - Clofazimine - Pyrazinamide - Ethambutol - Acidepara - amino - salicylique)/14
(Lévofloxacine - Clofazimine - Pyrazinamide—Ethambutol - Acide para - amino -salicylique).
Entre 2012 et 2016, aucun cas de XDR-TB ou de pré-XDR-TB n’a été diagnostiqué, faute de moyen diagnostique.
Les patients de la cohorte I étaient hospitalisés pendant toute la durée du traitement.
Les patients de la cohorte II étaient hospitalisés pendant la phase intensive du traitement. L’hospitalisation pouvait être prolongée en cas de complications (effets indésirables des médicaments). Le Traitement directement observé (TDO) pendant la phase de continuation se faisait en ambulatoire sous supervision du Centre de diagnostic et de traitement (CDT) le plus proche de la zone de résidence du patient.
Les patients étaient revus mensuellement en consultation externe au niveau du CHUYO. Une évaluation clinique et un prélèvement des crachats pour la bacilloscopie et la culture étaient réalisés chaque mois tout le long du traitement. La glycémie, l’ionogramme sanguin, la fonction hépatique et la fonction rénale ont été évalués chaque mois durant les phases intensives. La fonction de la thyroïde et l’audition ont été évalués au début du traitement et à la fin de la phase intensive. Une radiographique pulmonaire a été pratiquée lors de l’enrôlement et à la fin du traitement, tandis que les tests de grossesse, la sérologie VIH et l’ECG ont été réalisés lors de l’enrôlement. Les effets indésirables ont été rapidement pris en charge. Les patients recevaient tous les mois un soutien nutritionnel et financier pour leur transport.
Analyse des données
Les données ont été analysées à l’aide du logiciel Epi-info dans sa version 7.1.5. La comparaison de la probabilité de survie entre les catégories a été réalisée par un test de Log-Rank. La différence a été considérée comme significative lorsque p<0,05.
Considérations éthiques et déontologiques
La confidentialité des informations recueillies à partir des dossiers médicaux et fiches de suivi des patients avait été respectée. Cette étude a été réalisée en conformité avec la loi bioéthique, la loi informatique et de liberté ainsi qu’en accord avec les bonnes pratiques cliniques.
RESULTATS
Données générales et sociodémographiques
Sur 308 échantillons suspects de TB XDR ou pré-XDR (rechute de TBMR, échec de TBMR, sujet contacts de TB PREXDR OU XDR) analysés entre 2006 et 2020, 14 cas de TB XDR et de pré-XDR soit 4,54% de
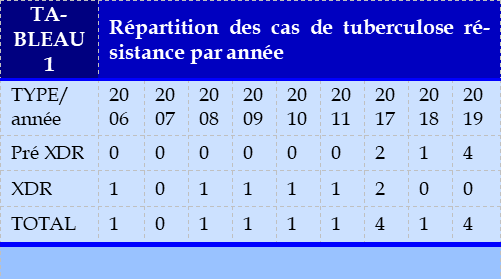
l’effectif ont été diagnostiqués et répartis comme suit : sept cas de XDR (7/308 ; 2,27%) et sept cas de Pré-XDR (7/308 ; 2,27%). Les bacilloscopies et les cultures étaient positives chez tous les patients. Le tableau 1 donne la répartition du nombre de cas de TB pharmacorésistante diagnostiquées de 2006 à 2019. (Tableau 1)
Les patients de sexe masculin représentaient 85,7% (12/14) de l’effectif. La moyenne d’âge des patients était de 46,3 ans ± 9,46 ans avec des extrêmes d’âge de 21 ans et 54 ans. Trent sept virgule sept pour cent (35,7%) des patients résidaient dans la ville de Ouagadougou et 28,6% provenaient de la Côte d’Ivoire.
Quatre-vingt-cinq virgule sept pour cent (85,7%) des patients étaient mariés et 71,4% avaient un niveau d’étude du secondaire. Tous les patients étaient des professionnels du secteur informel sauf deux agents de santé (un infirmier et une fille de salle) soit 14,3%. Cinquante pourcents (50%) des patients étaient tabagiques et 29% consommeraient de l’alcool.
Données cliniques et paracliniques
Douze patients soit 85,7% avaient un antécédent de traitement pour TB-MR. Deux patients (14,3%) ayant une résistance primaire étaient issus d’une même famille dont le père de famille serait le cas index. La moyenne des sujets contact était de 6,25 personnes par patient avec des extrêmes allant de 3 à 12 personnes. Cinq sujets contact avaient un âge < 5 ans.
Une notion de tabagisme et de consommation d’alcool a été retrouvée chez respectivement 6 et 4 patients soit 42,86% et 28,57 %. Un patient était traité pour un diabète de type 2. Le délai diagnostique moyen était de 7,58 mois avec des extrêmes de 1 mois et 18 mois.
Une altération de l’état général a été note chez 10 patients (71,42%).
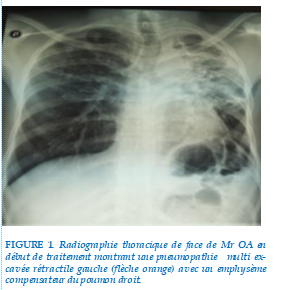
Les signes fonctionnels prédominant chez les patients étaient la toux (100% des patients), l’asthénie (100%), l’anorexie (100%) et l’amaigrissement (85,7%) avec un IMC < 18,5kg/m2. de surface corporelle. Les lésions radiographiques en début de traitement étaient dominées par des opacités excavées chez 92,8% patients (Figure 1). Selon la classification de Wilcox [6], les lésions radiographiques étaient de degré 2 chez 64,28 % (9 patients) des patients et de degré 3 chez 28,57% (4 patients).
La sérologie VIH était positive chez trois patients soit une séropositivité de 21,4% et tous étaient sous traitement antirétroviral (ARV) au moment du diagnostic avec des taux de lymphocytes T CD4 < 500 cellules /mm3.
Le profil de la résistance était dominé par une résistance aux fluoroquinolones chez tous les patients avec une résistance supplémentaire aux injectables de 2 ème ligne chez 50% d’entre eux. L’espace QTc avant l’initiation du traitement était normal chez tous les patients.
Données thérapeutiques et évolutives
Avant la mise sous traitement trois patients sont décédés (21,4%) et une perdue de vue (7,1%). Le traitement a donc été initié chez dix patients (4 de la cohorte I et 6 de la cohorte II) soit 71,4%.
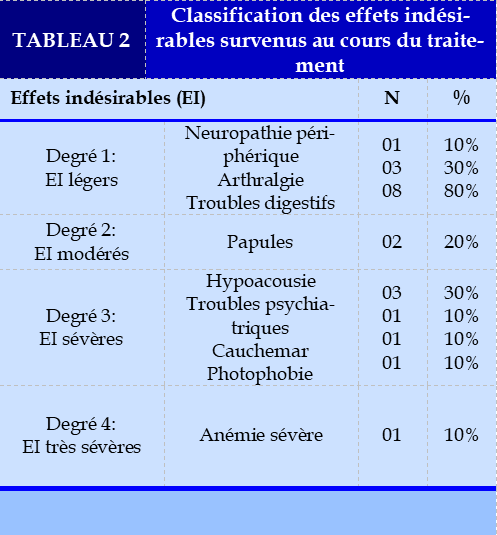
L’évolution a été marquée par la survenue d’effets indésirables du traitement chez tous les patients avec une prédominance des troubles digestifs chez 90% des patients (Tableau 2).
Une anémie sévère a été notée au 10ème mois chez une patiente de la cohorte II imputable probablement aux effets indésirables du linézolide. Aucun allongement de l’espace QT n’a été observé au cours du traitement.
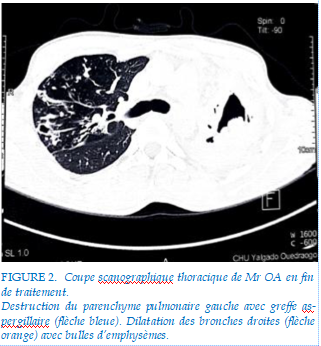
A l’issue du suivi, six patients sont décédés dont tous les patients de la cohorte I (4/4, 100%) et deux patients de la cohorte II (2/6, 33,3%). Un succès thérapeutique de 66,7% (4/6) a été noté dans la cohorte II avec deux patients guéris (2/6 ; 33,3%) et deux patients déclarés traitement terminé (2/6 ; 33,3%). Le taux de mortalité globale dans notre étude a été de 64,3% (9/14). En fin de traitement chez les patients ayant réalisés des examens d’imagerie, des séquelles pulmonaires à type de fibrose associée à des cavernes (figure 1) ont été notées chez 4 patients. Un cas insuffisance respiratoire chronique a été mis sous oxygénothérapie de longue durée à domicile (OLD). (figure 2)
Le taux de survie des patients de la cohorte I était de 0% à 19 mois et de 66,67% à 23 mois dans la cohorte II.
DISCUSSION
La tuberculose résistante constitue un problème de santé majeur du fait de sa prévalence croissante et des conséquences néfastes sur les individus et la communauté.
Comme dans toutes les formes de tuberculose notre population d’étude était constituée majoritairement de sujets jeunes, de sexe masculin ayant un niveau socio-économique bas.
Contrairement aux cas diagnostiqués par Andrews en Afrique du Sud, où la plupart des cas de tuberculose ultrarésistante étaient des cas de résistance primaire survenue chez des patients infectés par le VIH [7] la majorité des patients de notre étude soient 85,71% avaient un antécédent de traitement antituberculeux pour tuberculose multirésistante. Seulement deux cas de résistance primaire issue d’une contamination familiale ont été diagnostiqués. Les mécanismes de survenue de la résistance sont nombreux. Si les facteurs environnementaux sont incriminés dans les cas de résistances primaires, chez les patients déjà traités il s’agit d’une résistance acquise liée principalement soit à l’administration d’un traitement inadéquat par les prestataires de soins, soit à la mauvaise qualité des médicaments administrés, á la mauvaise gestion de l’approvisionnement, à la mauvaise prise des médicaments par les patients ou à la mauvaise réponse du traitement [8].
La co-infection tuberculose /VIH était de 21% ce qui est supérieur à la prévalence nationale qui était de 7,8% en 2020. Si l’infection à VIH est le plus puissant moteur de développement de la tuberculose du fait du déficit immunitaire elle est aussi un facteur d’échec du traitement antituberculeux par inobservance thérapeutique liée aux interactions médicamenteuses ou aux effets indésirables cumulés des traitements antituberculeux et antirétroviral.
La symptomatologie clinique de la tuberculose résistante n’étant pas différente de celle d’une tuberculose pharmaco sensible, un retard diagnostique moyen de 7,58 mois a été noté. Ce retard est source de mutilation pulmonaire (lésions étendues, excavations) comme chez la plupart de nos patients avec des risques de complications à plus ou moins long terme à type de dilatation des bronches, de greffe aspergillaire dans les cavités résiduelles, de fibrose pulmonaire ou d’insuffisance respiratoire chronique restrictive. Outre ce retentissement sur l’individu, le retard diagnostic est aussi source de propagation de la maladie dans l’environnement familial, professionnel ou dans la communauté. L’utilisation précoce de méthodes de diagnostic rapide de la tuberculose ultra résistante telle la LPA (Line Probe Assay) en cas de résistance à la Rifampicine permettront de réduire ce long délai diagnostic. Toutefois un engagement des agents de santé dans la lutte contre la tuberculose, une sensibilisation de la population pour une consultation précoce en cas de toux sont des préalables pour le succès de la lutte antituberculeuse.
La présence de deux agents de santé dans notre cohorte met en exergue les risques courus par les professionnels de santé face à cette maladie grave et souligne aussi l’importance de la prévention de l’infection nosocomiale et le respect de l’hygiène de la toux. Le nombre moyen de sujets contact était de 6,25 par patients avec des extrêmes de 3 et 12. La recherche de sujet contacts des malades a permis le dépistage et la prise en charge précoce de deux cas de transmission familiale permettant ainsi de rompre la chaine de transmission.
Le taux de mortalité avant la mise sous traitement a été de 21,4% (3 patients) chez des patients qui avaient une altération importante de l’état général associée à des lésions parenchymateuses étendues. Selon Sreeramareddy il existe une corrélation positive entre le taux de mortalité dû à la tuberculose et l’étendue des lésions à la radiographie thoracique [9].
Dix patients soit 71,4% ont été mis sous traitement. De façon classique, il est rapporté qu’au cours du traitement de la pré-XDR et XDR-TB, des effets indésirables d’ordre digestif, articulaire, vestibulo-cochléaire, neurologique, psychiatrique, ophtalmique, dermatologique, cardiaque, rénale et hématologique peuvent être observés [10].
Les effets indésirables les plus rencontrées chez nos patients étaient des troubles digestifs à type de nausée, vomissement, douleur abdominale, diarrhée. Des effets indésirables très sévères à type d’hypoacousie (chez 3 patients sous capréomycine), de trouble psychiatrique, et un cas d’anémie sévère (chez une patiente sous linozélide) ont été notifiés.
L’évolution sous traitement a été marquée par le décès de tous les patients de la cohorte I avec une survie globale de 19 mois. Dans le cohorte II (6 patients) le taux de succès thérapeutique était de 66,7% (4 patients) et le taux de décès de 33,3% (2 patients). Le taux de survie de cette cohorte II était de 66,67% à 23 mois. Si l’introduction de la bédaquiline recommandé par l’OMS dans les protocoles a amélioré le pronostic des patients il reste que l’état général altéré, la présence de comorbidité (infection á VIH, diabète…), le retard diagnostique, sont des facteurs de mauvais pronostic. La mortalité globale était élevée dans notre série par rapport à d’autres. En effet, Ritu Banerjee [11] en Californie, Bonilla Cesar A [12] au Pérou , retrouvaient respectivement des taux de mortalité de 29,4% et 22%. Cependant un taux de mortalité plus élevée (98%) était retrouvé dans le groupe initial de Tugela Ferry au Kwazulu Natal, chez les patients XDR [13] vivant avec le VIH. L’inhomogénéité de ces résultats reflète la diversité des stratégies thérapeutiques choisies et de possibles biais méthodologiques. Contrairement aux données de la littérature [14-15] qui rapportent beaucoup de perdu de vue au cours du traitement, du fait des effets indésirables, de la durée du traitement et l’utilisation de médicaments injectables, notre série n’a enregistré aucun cas de perdu de vu sous traitement.
CONCLUSION
La tuberculose ultra résistante et pré ultrarésistante sont une préoccupation majeure pour le programme national de lutte contre la tuberculose du Burkina Faso. Elles surviennent surtout chez des sujets jeunes ayant un antécédent de traitement antituberculeux. Leur diagnostic est tardif avec une morbidité et une mortalité importante.
En attendant la mise á disposition de schémas thérapeutiques plus efficaces et moins contraignants la meilleure prévention reste le dépistage précoce et le traitement adapté de tous les cas de tuberculose pharmaco sensible, une bonne éducation thérapeutique des patients, l’hygiène de la toux et la lutte contre l’infection à VIH.
CONFLIT D ‘INTERETS
Aucun.
REFERENCE
| 1. World Health Organization. Global TB Report. WHO/HTM/TB/2020.20. Geneva, Switzerland: WHO, 2020. |
| 2. World Health Organization. Concept note: Expert Consultation on the definition of extensively drug resistant tuberculosis 27-29 October 2020 Global TB Programme. Geneva, Switzerland: WHO, 2020. |
| 3. Kim DH, Kim HJ, Park S-K, Kong S-J, Kim YS, Kim T-H, et al. Treatment outcomes and survival based on drug resistance patterns in multidrug-resistant tuberculosis. Am J Respir Crit Care Med. 2010; 182(1):113‑9. |
| 4. Saleri N, Badoum G, Ouedraogo M, Dembélé SM, Nacanabo R, Bonkoungou V,et al . Extensively drug-resistant tuberculosis, Burkina Faso. Emerg Infect Dis. 2010 ; 16(5):840. |
| 5. Programme National Tuberculose. Guide de prise en charge de la tuberculose résistante. 2019.143p. PNT, Ouagadougou, Burkina Faso. |
| 6. Wilcox PA, Ferguson AD. Chronic obstructive airways disease following treated pulmonary tuberculosis. Respir Med. mai1989;83(3):195‑8. |
| 7. Andrews JR, Gandhi NR. Moodlcy P. Shah S. Bohlken L. Moll AP,et at. Exogenous reinfection as a cause of multidrug-resistant and extensively drug-resistant tuberculosis in rural South Africa, J Infect Dis. 2008;198:1582-9, DOI: 10.1086/592991 |
| 8. Programme National de lutte contre la Tuberculose. Rapport annuel d’activités du programme national de lutte contre la tuberculose Burkina Faso, Ouagadougou, 2017,24p. |
| 9. Sreeramareddy CT, Panduru KV, Menten J, Van den Ende J. Time delays in diagnosis of pulmonary tuberculosis: a systematic review of literature. BMC Infect Dis. 11 juin 2009 ;9(1) :91. |
| 10. Borisov SE, Dheda K, Enwerem M, Leyet RR, D’Ambrosio L, Centis R, et al. Effectiveness and safety of bedaquiline-containing regimens in the treatment of MDR- and XDR-TB: a multicentre study. Eur Respir J. 1 mai 2017;49(5):1700387. |
| 11. Banerjee R, Allen J, Westenhouse J, Oh P, Elms W, Desmond E, et al. Extensively Drug-Resistant Tuberculosis in California, 1993–2006. Clin Infect Dis. 15 août 2008;47(4):450‑7. |
| 12. Bonilla CA, Crossa A, Jave HO, Mitnick CD, Jamanca RB, Herrera C, et al. Management of Extensively Drug-Resistant Tuberculosis in Peru: Cure Is Possible. PLoS ONE [Internet]. 13 août 2008 [cité 13 août 2019];3(8). Disponible sur: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2495032/ |
| 13. Gandhi NR, Andrews JR, Brust JCM, Montreuil R, Weissman D, Heo M, et al. Risk factors for mortality among MDR- and XDR-TB patients in a high HIV prevalence setting. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. janv 2012;16(1):90‑7. |
| 14. Caminero JA, ed. Guidelines for Clinical and Operational Management of Drug-Resistant Tuberculosis. Paris, France: International Union Against Tuberculosis and Lung Disease, 2013. |
| 15. Caminero JA, Scardigli A. Classification of antituberculosis drugs: a new proposal based on the most recent evidence. Eur Respir J. 1 oct 2015 ; 46 (4):887‑93. |
Figures - Tables
REFERENCE
| 1. World Health Organization. Global TB Report. WHO/HTM/TB/2020.20. Geneva, Switzerland: WHO, 2020. |
| 2. World Health Organization. Concept note: Expert Consultation on the definition of extensively drug resistant tuberculosis 27-29 October 2020 Global TB Programme. Geneva, Switzerland: WHO, 2020. |
| 3. Kim DH, Kim HJ, Park S-K, Kong S-J, Kim YS, Kim T-H, et al. Treatment outcomes and survival based on drug resistance patterns in multidrug-resistant tuberculosis. Am J Respir Crit Care Med. 2010; 182(1):113‑9. |
| 4. Saleri N, Badoum G, Ouedraogo M, Dembélé SM, Nacanabo R, Bonkoungou V,et al . Extensively drug-resistant tuberculosis, Burkina Faso. Emerg Infect Dis. 2010 ; 16(5):840. |
| 5. Programme National Tuberculose. Guide de prise en charge de la tuberculose résistante. 2019.143p. PNT, Ouagadougou, Burkina Faso. |
| 6. Wilcox PA, Ferguson AD. Chronic obstructive airways disease following treated pulmonary tuberculosis. Respir Med. mai1989;83(3):195‑8. |
| 7. Andrews JR, Gandhi NR. Moodlcy P. Shah S. Bohlken L. Moll AP,et at. Exogenous reinfection as a cause of multidrug-resistant and extensively drug-resistant tuberculosis in rural South Africa, J Infect Dis. 2008;198:1582-9, DOI: 10.1086/592991 |
| 8. Programme National de lutte contre la Tuberculose. Rapport annuel d’activités du programme national de lutte contre la tuberculose Burkina Faso, Ouagadougou, 2017,24p. |
| 9. Sreeramareddy CT, Panduru KV, Menten J, Van den Ende J. Time delays in diagnosis of pulmonary tuberculosis: a systematic review of literature. BMC Infect Dis. 11 juin 2009 ;9(1) :91. |
| 10. Borisov SE, Dheda K, Enwerem M, Leyet RR, D’Ambrosio L, Centis R, et al. Effectiveness and safety of bedaquiline-containing regimens in the treatment of MDR- and XDR-TB: a multicentre study. Eur Respir J. 1 mai 2017;49(5):1700387. |
| 11. Banerjee R, Allen J, Westenhouse J, Oh P, Elms W, Desmond E, et al. Extensively Drug-Resistant Tuberculosis in California, 1993–2006. Clin Infect Dis. 15 août 2008;47(4):450‑7. |
| 12. Bonilla CA, Crossa A, Jave HO, Mitnick CD, Jamanca RB, Herrera C, et al. Management of Extensively Drug-Resistant Tuberculosis in Peru: Cure Is Possible. PLoS ONE [Internet]. 13 août 2008 [cité 13 août 2019];3(8). Disponible sur: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2495032/ |
| 13. Gandhi NR, Andrews JR, Brust JCM, Montreuil R, Weissman D, Heo M, et al. Risk factors for mortality among MDR- and XDR-TB patients in a high HIV prevalence setting. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. janv 2012;16(1):90‑7. |
| 14. Caminero JA, ed. Guidelines for Clinical and Operational Management of Drug-Resistant Tuberculosis. Paris, France: International Union Against Tuberculosis and Lung Disease, 2013. |
| 15. Caminero JA, Scardigli A. Classification of antituberculosis drugs: a new proposal based on the most recent evidence. Eur Respir J. 1 oct 2015 ; 46 (4):887‑93. |
ARTICLE INFO DOI: 10.12699/jfvpulm.14.44.2023.13
Conflict of Interest
Non
Date of manuscript receiving
25/04/2023
Date of publication after correction
25/10/2023
Article citation
Boncoungou, S. Halidou Moussa, S. Maiga, AR. Ouédraogo, GA. Ouédraogo, G. Ouédraogo, G. Badoum, M. Ouédraogo. J Func Vent Pulm 2023;44(14):13-18