
 English
English
 French
French
Surgery for primary spontaneous pneumothorax, what pleurodesis technique? Pleurectomy versus pleural abrasion
Chirurgie du pneumothorax spontané primaire, quelle technique de pleurodèse ? Pleurectomie versus abrasion pleurale
Ghebouli 1, MA. Kecir 2, M. Belbekri 2, H. Larkem 2, A. Nekhla3, K. Achour 4
1: Service de Chirurgie thoracique cardiovasculaire et Transplantation d’Organe CHU Mustapha Alger, Algérie
2: Service de Chirurgie thoracique CHU Constantine, Algérie
3: Service de Chirurgie thoracique Tizi Ouzou, Algérie
4: Service de Chirurgie thoracique Beb El Oued Alger, Algérie
Corresponding author: Khalil GHEBOULI. Service de Chirurgie thoracique cardiovasculaire et Transplantation d’Organe CHU Mustapha Alger, Algérie. E-mail: ghebouli_khalil@yahoo.fr
ABSTRACT
Introduction. PSP primary spontaneous pneumothorax remains a public health problem due to its frequency and its occurrence in an often young population. This is a pathology whose natural evolution is marked by the occurrence of recurrence. Surgery when indicated, including the treatment of bullous lesions and pleurodesis, has significantly reduced the recurrence rate. The main objective of this work is to define which of the two techniques will reduce the risk of PSP recurrence by contrasting pleurectomy with pleural abrasion. Materials and methods. This is a randomized clinical trial, which spanned a period of four years (January 2019-December 2022). 103 patients were operated on in our department divided into two groups according to the pleurodesis technique performed. Group P for pleurectomy had 61 (n=61) patients and group A abrasion had 42 (n=42) patients. The average follow-up rate for patients is 26 months for group P and 21 months for group A. Results. Our results showed a homogeneous distribution of the two groups. Recurrent PSP largely dominated the surgical indications with a rate of 73.8%. In group P the recurrence rate is around 3.27%, that of group A 7.14% (p=0.384). Complications were seen at a rate of 16.39% in group P and 11.9% in group A. These complications required surgical revision in 3 cases all in group P. The average duration of drainage was significantly lower in group P(p=0.03). However, postoperative pain was more marked in this same group (p=0.004). The mortality rate was zero in both groups. Conclusion. Our results tipped the scales for pleurectomy in the control of PSP recurrence but at the cost of higher morbidity compared to abrasion.
KEYWORDS: Primary spontaneous pneumothorax; Surgery; Pleurodesis; Pleurectomy; Abrasion.
RÉSUMÉ
Introduction. Le pneumothorax spontané primaire PSP reste un point voir un problème de santé publique de par sa fréquence et sa survenue chez une population souvent jeune. Il s’agit d’une pathologie dont l’évolution naturelle est marquée par la survenue de récidive. La chirurgie lorsqu’elle est indiquée, comportant le traitement des lésions bulleuses et la pleurodèse a nettement réduit le taux de récidive. Ce travail a pour objectif principal de définir laquelle des deux techniques permettra de diminuer le risque de récidive du PSP en opposant la pleurectomie à l’abrasion pleurale. Matériels et Méthodes. Il s’agit d’un essai clinique randomisé, qui s’étalait sur une période de quatre ans (janvier 2019- décembre 2022). 103 patients ont été opérés dans notre service répartis en deux groupes selon la technique de pleurodèse pratiquée. Le groupe P pour pleurectomie comptait 61(n=61) patients et le groupe A abrasion comptait 42 (n=42) patients. Le taux moyen de suivi des malades est de 26mois pour le groupe P et 21 mois pour le groupe A. Résultats. Nos résultats ont montrés une répartition homogène des deux groupes. Le PSP récidivant dominait largement les indications opératoires avec un taux de 73.8%. Dans le groupe P le taux de récidive avoisine 3.27%, celui du groupe A 7.14% (p=0.384). Les complications se voyaient à un taux de 16.39% dans le groupe P et 11.9% dans le groupe A. Ces complication ont nécessité une reprise chirurgicale dans 3 cas tous dans le groupe P. La durée moyenne du drainage était significativement plus faible dans le groupe P (p= 0.03). Cependant la douleur post opératoire a été plus marquée dans ce même groupe (p=0.004). Le taux de mortalité était nul dans les deux groupes. Conclusion. Nos résultats ont penché la balance pour la pleurectomie dans le contrôle de la récidive du PSP mais au prix d’une morbidité plus élevée par rapport à l’abrasion.
MOTS CLÉS: Pneumothorax spontané primaire; Chirurgie, Pleurodèse, Pleurectomie; Abrasion.
INTRODUCTION
Le pneumothorax spontané primaire (PSP) est défini comme un épanchement d’air dans l’espace pleural sans lésions pulmonaires sous-jacentes dû à la rupture de petites lésions bulleuses ou blebs, qui ne sont cependant pas constamment retrouvées (75 à 100% des cas selon les études) [1,2].
La distinction initiale entre PSP et le pneumothorax spontané primaire PSS était essentielle car la plus grande pourvoyeuse de PSS à l’époque était la tuberculose. Cette distinction n’est plus aussi pertinente, et en réalité dans la mesure où la première cause des pneumothorax spontanés dit primaires est le tabagisme, il parait inexact de parler de poumon sain dans ce contexte tant on sait que, très tôt dans l’histoire du fumeur, on peut mettre en évidence des anomalies ultrastructurales du parenchyme pulmonaire. Grâce aux techniques scannographiques notamment, la distinction primaire-secondaire devient progressivement floue, les patients souffrants de pneumothorax « primaire » se voyant de plus en plus souvent découvrir des anomalies qui seraient passées inaperçues sur une simple radiographie du thorax.
L’incidence du PSP par rapport à la population générale est difficile à préciser, car il est vraisemblable que le nombre de pneumothorax spontané évoluant vers la résorption sans être diagnostiqué n’est pas négligeable. En outre les moyens de diagnostic mis en œuvre varient d’une région ou d’un pays à l’autre.
Certaines séries font état de fréquences de 2,4 à 17,8 pour 100.000 habitants [3].
Dans une étude effectuée dans le Compté d’Olmsted (Minnesota) entre 1950 et 1974 [4], l’incidence annuelle du pneumothorax spontané idiopathique était de 7,4 par 100.000 chez l’homme et 1,2/100.000 chez la femme, soit un sex-ratio de 6,2/1
Il s’agit là d’une pathologie pas rare, en France l’incidence observée ajustée pour l’âge varie entre 7.4 et 18 cas par 100.000 habitants par an pour les hommes et entre 2.1 et 10 cas pour 100.000 par an chez la femme. Ainsi un hôpital servant une population de 200.000 habitants reçoit en moyenne de 20 à 25 cas annuels de PSP [5].
En suède l’incidence est de 18 cas par 100.000 par an chez les hommes et de 6 cas par 100.000 par an chez les femmes, un rien plus élevé au royaume uni selon Wynn-Williams [6].
En Algérie, notre recherche n’a pas permis de trouver des données épidémiologiques menées dans ce sens, mais nous pouvons rapporter celle retrouvée dans notre étude.
Bien que les principaux facteurs de risque soient bien codifiés : « une taille élevée, un BMI faible, des modifications de la pression atmosphérique mais surtout le tabagisme auxquels s’ajoute l’usage plus récent de « canabis » ; son évolution naturelle est marquée par le risque de récidive dont la probabilité varie entre 16 et 57% avec une moyenne de 30% [7] ; constituant ainsi un point, voir un problème de santé publique important du fait que le PSP atteint surtout une population très jeune.
Sur le plan thérapeutique, l’aspiration simple et le drainage thoracique sont souvent utilisés pour traiter le PSP avec un taux de récidive à un an de 30% [8,9]. Ainsi la gestion chirurgicale est nécessaire pour diminuer la récurrence des PSP, cependant même avec chirurgie la récidive du PSP survient dans 5 à 10% des cas [10].
Le PSP récurrent une entité clinique qui nécessite une pleurodèse afin d’éviter l’accumulation d’air dans l’espace pleural. Pour réaliser avec succès cette pleurodèse, la symphyse complète entre la plèvre viscérale et pariétale est nécessaire. Les méthodes utilisées pour prévenir la récidive comprennent la pleurectomie ou l’abrasion qu’elle soit par lavage chimique ou la pleurodèse mécanique.
L’abrasion pleurale décrite par Tyson en 1941 induit l’adhérence entre les deux feuillets pleuraux par irritation chimique ou mécanique de la plèvre.
Un peu plus après en 1956 Gaenster décrit la pleurectomie qui consiste à une rection partielle ou totale de la plèvre pariétale.
Pleurectomie ou abrasion pleurale ?
Il s’agit d’un débat de longue date. Dans les séries publiées, le taux de récidive est sensiblement le même pour les pleurectomies et les avivements. Dès 1968 Clagett [11] avait condamné très fermement la pleurectomie en lui rapportant d’être responsable d’un plus grand taux d’hémothorax post opératoire et de rendre difficile toute intervention thoracique ultérieure en supprimant l’espace extra pleural.
Bien que l’abrasion pleurale soit l’une des techniques les plus utilisées de pleurodèse, il y a peu de preuve que cette méthode réduit effectivement la récurrence du PSP [12]. Les lignes directrices du British Thoracic Society BTS indiquent que le taux de récidive avec l’abrasion pleurale est plus élevé que celui avec la pleurectomie [13].
Ces deux procédures sont couramment pratiquées en chirurgie thoracique, mais peu d’études ont évalués l’efficacité des options du traitement chirurgical, cependant la controverse existe encore en ce qui concerne les avantages et les inconvénients de l’abrasion pleurale par rapport à la pleurectomie dans la prévention des récidives du PSP.
Méthodes
Il s’agit d’un essai clinique randomisé, comparant deux techniques chirurgicales dans la prise en charge du PSP et portant sur 103 malades.
Dans notre étude, deux groupes de patients sont étudiés et analysés. Les patients sont admis sur la base de critères cliniques, et radiologiques puis sub divisés en deux groupes selon la technique :
PSP Persistant : la définition du caractère persistant dépend du traitement entrepris. Si le malade était en observation simple, il faut en général 8 semaines pour qu’un pneumothorax complet se réexpande. Si le malade a bénéficié de la mise en place d’un drain, la persistance du PSP est retenue lorsque le bullage persiste au-delà de 5 jours.
PSP récidivant : La BTS définit la récidive par un deuxième pneumothorax ipsilatéral [80] alors que dans ses recommandations récentes l’ERS ne fait pas cette distinction et considère comme récidive toute épisode de pneumothorax qui survient après un premier épisode ipsi- ou controlatéral [14].
Dans notre étude la définition retenue et celle de la BTS.
Le PSP bilatéral.
Le premier épisode du PSP, pour des impératifs socio professionnelle (personnel navigant ou plongeurs).
Tous nos malades ont bénéficié d’un examen clinique minutieux, une radiographie thoracique et une TDM thoracique.
Ce travail a pour objectif principal de définir laquelle des deux techniques permettra de diminuer le risque de récidive du PSP en opposant la pleurectomie à l’abrasion pleurale.
Les objectifs secondaires assignés à ce travail viseront à préciser la technique qui a un faible taux de morbidité, appréciée par la survenue de complications post opératoires à savoir:
La douleur post opératoire et la durée d’hospitalisation.
L’analyse statistique s’est faite à l’aide d’un logiciel informatique « Epi-info » version 3.2.5.
Pour la comparaison des variables qualitatives, les données ont été analysées avec les tests statistiques : Chi –deux, test T de Student et écart réduit.
Pour les variables quantitatives l’analyse des données est faite à l’aide du test ANOVA.
Le seuil de significativité accepte un risque d’erreur à 5% et un travail de confiance à 95%.
RESULTATS
La population d’étude est composée de 103 malades des deux sexes, éligibles aux critères d’inclusion.
On note une nette prédominance masculine, Le sexe ratio est de 8.3, autrement dit, il y a 83 hommes pour 10 femmes; le rapport de masculinité est de 834 %.
L’étendue correspond à 21 ans (différence entre les âges extrêmes), l’âge moyen est de 23.7 ± 1.3. La médiane est de 23 ans : 50 % de l’effectif a un âge < 23 ans et 50 % à un âge > 23 ans.
La classe modale ou la classe dominante correspond à la tranche d’âge 20-25 ans avec une fréquence de 40.77%.
La distribution de la population d’étude en fonction de l’indice de masse corporelle montre une moyenne de 19.7 ± 0.5 kg/m2. La médiane est de 20 kg/m2. Le poids est normal chez 35 % des patients tandis que la maigreur a été retrouvée chez 62.1 % des cas.
Sur l’ensemble de la population d’étude, 100 patients (soit 97%) ont présentés au moins un épisode de pneumothorax, le nombre total d’épisodes réparti sur les 100 malades est de 204 épisodes, 72.5% des patients ont bénéficiés préalablement de la mise en place d’un drain thoracique.
La répartition des patients en fonction des indications chirurgicales, a révélé une prédominance du pneumothorax récidivant dans 73.8%, suivie du pneumothorax résistant dans 23.3%, le pneumothorax bilatéral dans 1.9% et enfin 1% pour des impératifs socio-professionnels.
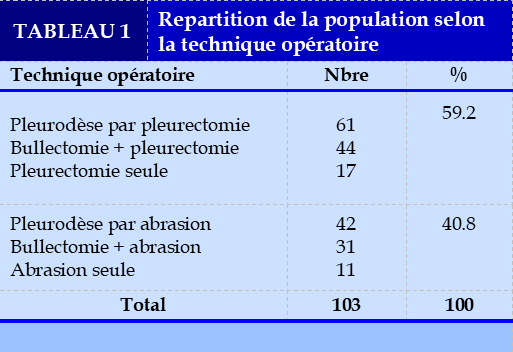
Au moment de l’exploration chirurgicale, des lésions bulleuses ont été retrouvé chez 75 patients (72.8%), la pleurectomie a été pratiquée comme pleurodèse dans 59.2%, elle a été combinée à la bullectomie chez 44 patients, isolée chez 17 patients .
Quant à l’abrasion pleurale, elle a été pratiquée dans 40.8% des cas, elle a été combinée à la bullectomie chez 31 patients, isolée chez 11 patients (Tableau 1).
Sur l’ensemble de la population d’étude, les complications post opératoires immédiates sont survenues chez 13.6 % des patients.
L’hémothorax représente la complication post opératoire la plus fréquente, survenu chez 6.8 % des patients, suivi du bullage prolongé supérieur à 3 jours après l’intervention constaté chez 4.9 % des patients, le défaut de ré-expansion pulmonaire quant à lui a été observé dans 1.9% des patients et en fin et en dernier viennent les complications infectieuses observées dans 1% des cas.
Sur l’ensemble des patients qui ont présenté des complications post opératoires, soit 13.6 % des cas, une évolution favorable a été constatée chez 46.7 % des patients après redrainage, et dans 33.3% après traitement médical associé à une kinésithérapie active. Cependant, trois patients 20 % ont bénéficié d’une reprise chirurgicale qui a consisté évacuation de l’épanchement pleurale dans deux cas et suture parenchymateuse dans un seul cas.
L’évolution des reprises chirurgicales était favorable, et on a déploré aucun cas de décès, le taux de mortalité était nulle.
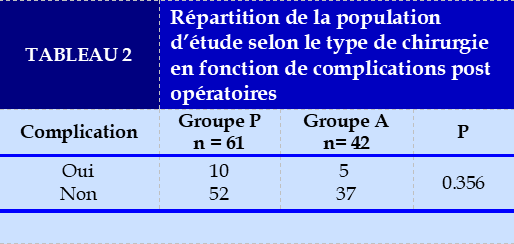
Sur l’ensemble de la population d’étude, le taux de complications post opératoires n’a pas montré de différences significative entre les deux populations (P = 0.356) (Tableau 2).
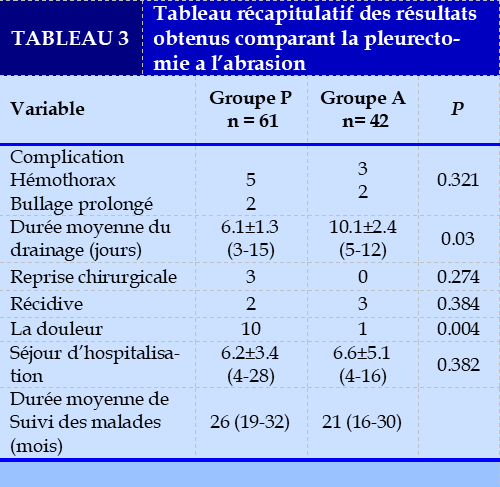
En fonction du type de complication la balance a penché un peu plus vers le groupe P avec un taux de l’ordre de 16.39% contre 11.90 % pour le groupe A.
Dans le groupe P l’hémothorax représentait la complication la fréquente avec un taux de touchant 8.2%, suivi du bullage prolongé dans 4.9% des cas. Dans le groupe A, l’hémothorax et le bullage prolongé partageaient le même taux de 4.8%.
Une comparaison des deux groupes concernant les deux principales complications à savoir l’hémothorax et le bullage prolongé n’a pas montré en fait une différence significative P = 0.321
En effet, on a noté une différence significatif entre les deux groupes (P=0.03), concernant la durée moyenne du drainage qui a été plus prolongée dans le groupe A (10.1±3.2 jours) par rapport au groupe P (6.1±1.1 jour)
Une reprise chirurgicale a été indiquée dans trois cas, dans deux cas en rapport avec un hémothorax, et un seul cas en rapport avec un bullage prolongée, tous les malades appartenaient au groupe P.
Le taux de récidive montre un taux plus élevé pour le groupe A 7.14% contre 2.27% pour le groupe P, cependant la différence n’est pas significative entre les deux populations (P = 0.084)
L’étude de la douleur post opératoire a montré une différence significative P < 0.05. En effet les malades du groupe P ont rapporté la notion de douleurs thoracique résiduelle dans 10 cas, alors on note un seul cas dans le groupe A.
L’analyse du séjour moyen post opératoire ne montre pas de différence significative entre les différents groupes.
L’étude des deux groupe n’a pas montré de différence significative en matière de complications et de séjour d’hospitalisation, cependant il semble que le taux de récidive est un peu plus important dans le groupe A (7.14%) contre (3.27%) dans le groupe P, à l’inverse la population du groupe P est sujette à plus de complication post opératoire notamment l’hémothorax. La durée de séjour reste pratiquement la même pour les deux populations.
L’étude de la durée moyenne du drainage et la notion de douleur montre une différence significative (p=0.03 et p=0.045) respectivement, donnant l’avantage à l’abrasion par rapport à la pleurectomie (Tableau 3).
DISCUSSION
Il s’agit d’un essai clinique randomisé comparant deux techniques de pleurodèse chirurgicale, la répartition s’est faite après explication des deux procédures aux malades et leur consentement, le recrutement des malades s’est étalé sur une durée de 4ans.
L’étude de notre série a encore confirmé fortement la nette prédominance masculine du PSP avec un sexe ratio de 8.3 ; elle est comparable à cette retrouvée dans la littérature internationale: 8.78 dans la série de RENA et 9.08 dans la série HUG [15,16]. Notre population d’étude est un plus âgée puisque l’âge moyen est de 23.7 ans contrairement aux publications internationales où l’âge moyen est de 21 ans pour ANDREA [17] et 21.3 ans pour HUG [16]. Tous nos patients n’ont pas connu de complications pré ou per opératoires pouvant influencer la fiabilité de nos résultats. La bullectomie associée à la pleurodèse reste le gold standard dans la prise en charge des PSP [14, 18-20]. Dans notre série tous les patients présentant une lésion bulleuse individualisable macroscopiquement ont bénéficiés de cette procédure, en absence de lésions bulleuse la pleurodèse par pleurectomie ou abrasion pleurale était la règle. Plusieurs études ont démontré l’intérêt de la pleurodèse. Hatz et al [21], comparaient la résection par VATS des bulles/blebs sans pleurodèse chez 72 patients avec résection et pleurodèse chez 37 patients, et observaient 4,6 % de récidives dans le premier groupe et aucune récidive dans le deuxième groupe. Loubani et Lynch [22] observaient 20 % de récidives après bullectomie isolée et seulement 4 % de récidives après bullectomie plus pleurodèse. Enfin, Horio et al ont observé un taux de récidives de 16 % chez 50 patients traités par bullectomie et de 1,9 % seulement chez 53 patients traités par bullectomie plus pleurodèse [18].
Cependant, des preuves limitées et incohérentes sont disponibles en ce qui concerne si une pleurectomie ou une abrasion est la procédure la plus efficace.
Deux facteurs affectent cette décision: le taux de récurrence et le taux de morbidité.
Allant dans ce sens, notre travail nous a permis d’effectuée une étude comparative entre s’est deux techniques en opposant la pleurectomie à l’abrasion pleurale. Certains auteurs [11] avaient condamné très fermement la pleurectomie en lui reprochant d’être responsable d’un plus grand taux d’hémothorax post opératoire et de rendre très difficile toute intervention thoracique ultérieure en supprimant l’espace extra pleurale. Bien que l’abrasion pleurale a été largement utilisée pour contrôler la récidive du PSP, la controverse existe encore en ce qui concerne les avantages et les inconvénients de cette technique. Dans l’étude de RENA et al [15], incluant 220 patients, 112 ont subi une abrasion pleurale mécanique, et 108 ont subi une pleurectomie apicale et on a constaté que le pneumothorax est réapparu dans cinq cas (4.6%) après pleurectomie apicale et dans sept cas (6.2%) après l’abrasion pleurale mécanique.
Dans l’étude HUH [16] publiée en 2012, comparant 207 patients répartis en deux groupes A et B traités respectivement par pleurectomie et abrasion pleurale a montré des taux de 9.1% et 12.8% (p=0.014).
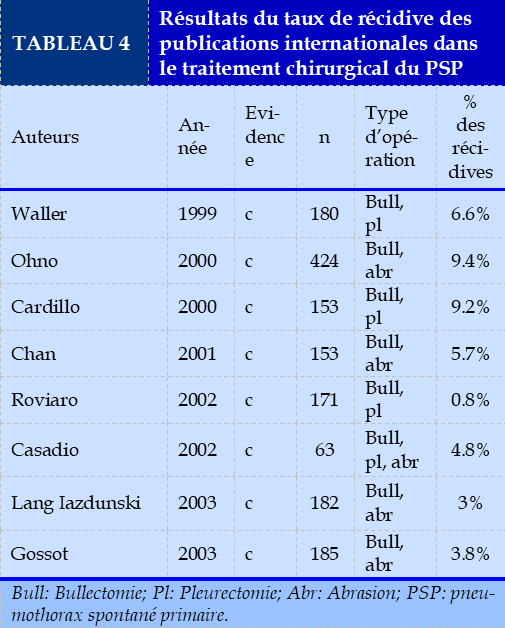
L’analyse de la littérature internationale a montré un taux de récidive allant de 0.8% à 9.2% après pleurectomie et de 2.1% à 9.4% après abrasion pleurale que résume le Tableau 4.
IBien qu’elles soient non comparatives les résultats de ces études ont légèrement penchés la balance vers la pleurectomie dans la prévention des récidives des PSP.
Notre étude viens de confirmer cette hypothèse, en effet le taux de récidive pour le groupe de pleurectomie était de l’ordre de 3.27%, contre 7.14% pour le groupe abrasion, mais cette différence reste non significative (p= 0.384).
Concernant la morbidité, l’étude RENA a montré dans les deux groupes un taux similaire de fuite aérienne post opératoire (5.3% dans le groupe abrasion et 5.5%, dans le groupe pleurectomie), le saignement post opératoire était plus significatif après pleurectomie (7.4%) qu’après abrasion (0.9%), (p= 0.036).
Nos premiers résultats postopératoires ont été un autre facteur en faveur des pleurectomies. Dans le groupe P, la durée moyenne du drainage thoracique et la durée moyenne de l'hospitalisation étaient plus courte que dans le groupe P. Ceci était une découverte inattendue parce que l'abrasion pleurale est réputée d’être une procédure moins invasive que la pleurectomie, en plus le saignement post opératoire attendu est généralement plus important après une pleurectomie. Cependant, on a constaté que les complications hémorragiques étaient légèrement plus fréquentes après une pleurectomie. Les Fuites d'air résolue rapidement après la pleurectomie, probablement à cause de soit l'apparition d'une inflammation plus forte comparée à l’abrasion pleurale ou à la couverture du ligne de résection parenchymateuse par un caillot sanguin. Cela a mené à un retrait précoce du drain thoracique.
Malgré ces résultats, la reprise chirurgicale n’a intéressé que la population du groupe P dans trois cas, ceci n’a pas affecté la durée moyenne du drainage et d’hospitalisation qu’on peut expliquer par la précocité de la reprise chirurgicale, alors qu’aucun reprise chirurgicale n’a été enregistrée dans le groupe A. En fin, On reproche à la pleurectomie une douleur thoracique beaucoup plus longue et un inconfort plus marqué (16.39%) par rapport aux patients traités par abrasion pleurale (2.38%) (p=0.004), ceci va de pair avec l’étude de RENA (P=0.001).
CONCLUSION
Les patients atteints de PSP nécessitent un traitement chirurgical pour divers indications, et l’un des principaux objectifs est de prévenir la récidive. Néanmoins, un pneumothorax récidivant peut se développer chez certains patients malgré la chirurgie. La « bullectomie combinée à la pleurodèse » reste le gold standard de la prise en charge des PSP.
Au travers notre étude deux groupes de patients ont été décrit opposant deux techniques opératoire de pleurodèse la pleurectomie et l’abrasion pleurale. On peut remarquer d’emblée quelques éléments intéressants : la principale indication chirurgicale était la récidive du pneumothorax, il s’agit d’une maladie volontiers récurrente. Bien que le choix entre les deux techniques étant souvent question d’école, notre modeste expérience n’a pas montré de différence significative. Il est vrai que la pleurectomie permet une symphyse plus solide mais au prix d’une morbidité plus élevée par rapport à l’abrasion.
CONFLIT D’INTERETS
Aucun.
REFERENCES
| 1. Lesur O, Delorme N, Fromaget JM, Bernadac P, Polu JM. Computed tomography in etiologic assessment of idiopathic spontaneous pneumothorax. Chest 1990-98:341-7. |
| 2. Sihoe AD, Yim AP, Lee TW, Wan S, Yuen EH, Wan IY et al. Can CT Scaning be used to select patients with unilateral spontaneous pneumothorax for bilateral surgery ? Chest 2000 ; 118 : 380-3 . |
| 3. Killen DA, Gobbel WG. Spontaneous pneumothorax 1968 ; 1st Ed : 4-5 et 37-75 |
| 4. Melton LJ, Hepper NG, Offord KP. Incidence of spontaneous pneumothorax in Olmsted Country, Minnesota 1950 to 1974. |
| 5. Noppen M. Pneumothorax spontané. Encycl Méd Chir (Editions scientifique et médicales Elservier SAS) ; pneumologie, 6-045-A-10, 2003. |
| 6. Wynn-Williams N. A ten year’s Study of Spontaneous pneumothorax in a Community thorax 1957; 12: 253-257. |
| 7. Schramel FM, Postmus PE, Vanderschueren RG. Current aspect of pneumothorax spontaneous. Euro Respir ; 1997 ; 10 : 1372-9. |
| 8. Sermetis MG. La gestion du pneumothorax spontané, thorax 1970 ; 57 : 65-68. PMID5410433 doi : 101378/chest 57.1.6. |
| 9. Ayed Ak, Chandrasekaran C, Sukumar M. Aspiration contre drainage tube pneumothorax spontané primaire : une étude randominée. Eur Respir J. 2006 ; 27 : 477-82. PMID 16507846 doi : 10, 1183,0903.1936.06.0009150. |
| 10. Massard G, Thomas P, Whillra JM. La gestion minimalement invasive pour le premier et récurrent pneumothorax. Ann thorac Surg 1998 ; 66 : 592-599. |
| 11. Clagett OT. The management of spontaneous pneumothorax. J thorac. Cardio Vasc surg 1968 ; 55 : 761-762. |
| 12. Parc JS, Han WS, Kim HK, Choi YS. Pleural abrasion forme chemical pleurodesis in surgery for primary spontaneous pneumothorax is it effective ? Surg. Erolosc. Laparosc percuten tech 2012 ; 22 : 62-64. |
| 13. Harvey M, Arnold T. Lignes directrices Harvey J. BTS pour la gestion de pneumothorax. Thorax 2003 ; 58 suppl 2 : ii39-52. |
| 14. Tschopp JM, et Coll. Eur Resp. J 2015 ; 46 : 321- 335. |
| 15. Rena O, Masseraabustellini M, Casadio C. Pleurodeses chirurgicale pour le stade III du pneumothorax spontané primaire de Vanderschuren. Eur Respir J ; 2008 ; 31 :837-841. |
| 16. Huh U, Kim YD, Cho JS, IH, Lee JH. The effect of thoracoscopic pleurodesis in primary spontaneous pneumothorax apical pleurale pleurectomie versus plaural abrasion. Korean J Thorac Cardiovasc Surg 2012; 45: 316-319. |
| 17. Andrea B, Allanoh B, Electric M, Lyn E, Lieu E; surgical acces rater than method of pleurodesis (pleurectomy or pleural abrasion) général thoracic and cardiovasc surg june 2012; vol 60 issu 6;321-325. |
| 18. Horio H, Nomori H, Kobayashi R, Naruke T ; Suemasu K. Impact of additional pleurodesis in video-assisted thoracoscopic bullectomy for primary spontaneous pneumothorax. Surg Endosc 2002 ; 16 : 630-4. |
| 19. Bauman MH, Strange C, Heffner JE, Light R, Kirby TJ, Klein J et al. Management of spontaneous pneumothorax: An American College of Chest physicians Delphi Consensus statement. Chest 2001 ; 119 : 590- 602. |
| 20. Gossot D, Galetta D, Stern JB, Debosse D, Caliandro R, Girard P, et al. Resultats of thoracoscopic pleural abrasion for primary spontaneous pneumothorax. Surg Endosc 2004 18:466-71. |
| 21. Hatz RA, Kaps MF, Meimarakis G, Loehe F, Muller C, Furst H. Long-term results after video assisted thoracoscopic surgery for first time and recurrent spontaneous pneumothorax. Ann thorac Surg 2000 ; 70 : 253-7. |
| 22. Loubani M, Lunch V, Video Assisted thoracoscopic bullectomie and aureomycin pleurodesis an effective treatment for spontaneous pneumothorax. Respir Med 2000 ; 94 : 888-90. |
Figures - Tables
REFERENCES
| 1. Lesur O, Delorme N, Fromaget JM, Bernadac P, Polu JM. Computed tomography in etiologic assessment of idiopathic spontaneous pneumothorax. Chest 1990-98:341-7. |
| 2. Sihoe AD, Yim AP, Lee TW, Wan S, Yuen EH, Wan IY et al. Can CT Scaning be used to select patients with unilateral spontaneous pneumothorax for bilateral surgery ? Chest 2000 ; 118 : 380-3 . |
| 3. Killen DA, Gobbel WG. Spontaneous pneumothorax 1968 ; 1st Ed : 4-5 et 37-75 |
| 4. Melton LJ, Hepper NG, Offord KP. Incidence of spontaneous pneumothorax in Olmsted Country, Minnesota 1950 to 1974. |
| 5. Noppen M. Pneumothorax spontané. Encycl Méd Chir (Editions scientifique et médicales Elservier SAS) ; pneumologie, 6-045-A-10, 2003. |
| 6. Wynn-Williams N. A ten year’s Study of Spontaneous pneumothorax in a Community thorax 1957; 12: 253-257. |
| 7. Schramel FM, Postmus PE, Vanderschueren RG. Current aspect of pneumothorax spontaneous. Euro Respir ; 1997 ; 10 : 1372-9. |
| 8. Sermetis MG. La gestion du pneumothorax spontané, thorax 1970 ; 57 : 65-68. PMID5410433 doi : 101378/chest 57.1.6. |
| 9. Ayed Ak, Chandrasekaran C, Sukumar M. Aspiration contre drainage tube pneumothorax spontané primaire : une étude randominée. Eur Respir J. 2006 ; 27 : 477-82. PMID 16507846 doi : 10, 1183,0903.1936.06.0009150. |
| 10. Massard G, Thomas P, Whillra JM. La gestion minimalement invasive pour le premier et récurrent pneumothorax. Ann thorac Surg 1998 ; 66 : 592-599. |
| 11. Clagett OT. The management of spontaneous pneumothorax. J thorac. Cardio Vasc surg 1968 ; 55 : 761-762. |
| 12. Parc JS, Han WS, Kim HK, Choi YS. Pleural abrasion forme chemical pleurodesis in surgery for primary spontaneous pneumothorax is it effective ? Surg. Erolosc. Laparosc percuten tech 2012 ; 22 : 62-64. |
| 13. Harvey M, Arnold T. Lignes directrices Harvey J. BTS pour la gestion de pneumothorax. Thorax 2003 ; 58 suppl 2 : ii39-52. |
| 14. Tschopp JM, et Coll. Eur Resp. J 2015 ; 46 : 321- 335. |
| 15. Rena O, Masseraabustellini M, Casadio C. Pleurodeses chirurgicale pour le stade III du pneumothorax spontané primaire de Vanderschuren. Eur Respir J ; 2008 ; 31 :837-841. |
| 16. Huh U, Kim YD, Cho JS, IH, Lee JH. The effect of thoracoscopic pleurodesis in primary spontaneous pneumothorax apical pleurale pleurectomie versus plaural abrasion. Korean J Thorac Cardiovasc Surg 2012; 45: 316-319. |
| 17. Andrea B, Allanoh B, Electric M, Lyn E, Lieu E; surgical acces rater than method of pleurodesis (pleurectomy or pleural abrasion) général thoracic and cardiovasc surg june 2012; vol 60 issu 6;321-325. |
| 18. Horio H, Nomori H, Kobayashi R, Naruke T ; Suemasu K. Impact of additional pleurodesis in video-assisted thoracoscopic bullectomy for primary spontaneous pneumothorax. Surg Endosc 2002 ; 16 : 630-4. |
| 19. Bauman MH, Strange C, Heffner JE, Light R, Kirby TJ, Klein J et al. Management of spontaneous pneumothorax: An American College of Chest physicians Delphi Consensus statement. Chest 2001 ; 119 : 590- 602. |
| 20. Gossot D, Galetta D, Stern JB, Debosse D, Caliandro R, Girard P, et al. Resultats of thoracoscopic pleural abrasion for primary spontaneous pneumothorax. Surg Endosc 2004 18:466-71. |
| 21. Hatz RA, Kaps MF, Meimarakis G, Loehe F, Muller C, Furst H. Long-term results after video assisted thoracoscopic surgery for first time and recurrent spontaneous pneumothorax. Ann thorac Surg 2000 ; 70 : 253-7. |
| 22. Loubani M, Lunch V, Video Assisted thoracoscopic bullectomie and aureomycin pleurodesis an effective treatment for spontaneous pneumothorax. Respir Med 2000 ; 94 : 888-90. |
ARTICLE INFO DOI: 10.12699/jfvpulm.14.44.2023.33
Conflict of Interest
Non
Date of manuscript receiving
25/04/2023
Date of publication after correction
25/10/2023
Article citation
Ghebouli , MA. Kecir , M. Belbekri , H. Larkem , A. Nekhla, K. Achour. J Func Vent Pulm 2023;44(14):33-39