
 English
English
 French
French
Assessment of sleep apnea syndrome treatment by continuous positive airway pressure in Togo
Evaluation du traitement du syndrome d’apnées du sommeil par pression positive continue au Togo
ADAMBOUNOU Tété Amento Stéphane1,2, OUATTARA Khadidia3,4, AKO Akouvi Mawussé Edjodjinam2, MOUZOU Tchilalo2,5, OGOUNDE Nadjibé Aladé2, ADJOH Komi Séraphin1,2
1: Faculté des sciences de la santé, université de Lomé, Togo
2: Service de pneumologie, CHU Sylvanus OLYMPIO, Lomé, Togo
3: Faculté de médecine et d’odontostomatologie, Bamako, Mali
4: Service de pneumologie, CHU Point G, Bamako, Mali
5: Service de santé des armées du Togo
Corresponding author: ADAMBOUNOU Tété Amento Stéphane. Faculté des sciences de la santé, université de Lomé, Togo.
E-mail: amentos@yahoo.fr
ABSTRACT
Introduction. Continuous positive airway pressure (CPAP) is the standard treatment for obstructive sleep apnea (OSA). Its efficacy depends on good compliance and tolerance. The aim of this study was to evaluate this type of treatment in Togo.
Methods. This was a descriptive and analytical series of cases of OSA treated with CPAP for at least three months. Participants completed a questionnaire and compliance data were extracted from the CPAP memory card for analysis. Factors associated with good compliance were investigated using logistic regression.
Results. Thirty-three cases of OSA, with a mean age of 52.3±10.3 years, were enrolled. A proportion of 90.91% of patients had an auto- CPAP, and 81.82% had a nasal mask. CPAP titration was performed in 66.67% of cases. The mean residual apnea-hypopnea index was 7.42±3.58/h. Aerophagia was the main adverse effect (48.48%). Well-being improved significantly in 57.58% of cases. Compliance was good in 60.61% of cases. Factors associated with good compliance were male gender (p=0.003; OR=3.39 [1.64-13.1]), severity of OSAS (p= 0.002; OR=2.28 [1.05-3.33]), medical follow-up (p=0.002; OR=2.5 [1.05-3.12]) and improved well-being (p=0.003; OR=4.63 [1.74-13.1]).
Conclusion. Compliance with CPAP is influenced by gender, severity of OSA, medical follow-up and patient feelings. Targeted therapeutic education of apneic patients would improve acceptance of CPAP.
KEYWORDS: Continuous positive airway pressure; Sleep apnea; Compliance; Togo.
RÉSUMÉ
Introduction. La ventilation en pression positive continue (PPC) est le traitement de référence du syndrome d’apnées obstructives du sommeil (SAOS). Son efficacité est conditionnée par une bonne compliance et tolérance. L’objectif de l’étude était d’évaluer ce type de traitement au Togo.
Méthodes. Il s’est agi d’une série descriptive et analytique de cas de SAOS appareillés par PPC depuis au moins trois mois. Les participants ont renseigné un questionnaire et les données d’observance ont été extraites de la carte mémoire de la PPC pour analyse. Les facteurs associés à une bonne observance ont été recherchés par régression logistique.
Résultats. Trente-trois cas de SAOS, âgés en moyenne de 52,3±10,3 ans, ont été enrôlés. Une proportion de 90,91 % des patients avait une PPC autopilotée, et 81,82 % un masque nasal. La titration de la PPC a été faite dans 66,67 % des cas. L’index d’apnées hypopnées résiduel moyen était de 7,42±3,58/h. L’aérophagie était le principal effet indésirable (48,48 %). Le bien-être s’était considérablement amélioré dans 57,58 % des cas. L’observance était bonne dans 60,61 % des cas. Les facteurs associés à une bonne observance étaient le sexe masculin (p=0,003 ; OR=3,39 [1,64-13,1]), la sévérité du SAOS (p= 0,002 ; OR=2,28 [1,05-3,33]), le suivi médical (p=0,002 ; OR=2,5 [1,05-3,12]) et l’amélioration de la qualité de vie (p=0,003 ; OR=4,63 [1,74-13,1]).
Conclusion. L’observance de la PPC est influencée par le genre, la sévérité du SAOS, le suivi médical et les ressentis du patient. Une éducation thérapeutique ciblée du patient apnéique permettrait d’améliorer l’acceptation de la PPC.
MOTS CLÉS: Pression positive continue; apnées du sommeil; observance; Togo.
INTRODUCTION
Le syndrome d’apnées obstructives du sommeil (SAOS) est le principal trouble respiratoire lié au sommeil [1]. Ses nombreuses complications médicales (atteintes cardiovasculaires, métaboliques, neurologiques) et ses répercussions socio-professionnelles (accidents de la voie publique et du travail, détérioration de la qualité de vie) en font un véritable enjeu de santé publique [2]. C’est une pathologie chronique encore sous diagnostiquée particulièrement en Afrique sub-saharienne. Au Togo, la proportion de sujets à risque de la maladie était estimée à 5,47 % [3]. Le traitement de référence reste la ventilation par pression positive continue (PPC) dont l’efficacité serait conditionnée par une bonne observance et une compliance du patient [4]. Dans les pays occidentaux, le traitement du SAOS par PPC remonte à une quarantaine d’années [4]. Au Togo, la prise en charge diagnostique et thérapeutique du SAOS est récente [5]. Les premiers cas de SAOS modéré à sévère ont bénéficié d’une prescription de PPC. L’objectif général de cette étude était d’évaluer le traitement des cas de SAOS appareillés par PPC au Togo.
MÉTHODES
Type, période et cadre d’étude
Il s’est agi d’une étude transversale à visée descriptive et analytique qui a porté sur la période du 1er janvier 2016 au 31 décembre 2022, comparant des données avant et après la mise sous PPC. L’étude s’est déroulée à la clinique Laennec de Lomé, une structure médicale spécialisée dans la prise en charge des affections respiratoires en particulier le SAOS.
Nous avons enrôlé tous les patients, âgés d’au moins 18 ans, résidant au Togo, appareillés par PPC pour SAOS et l’utilisant depuis au moins 3 mois. N’ont pas été inclus dans l’étude, les patients:
- dans l’impossibilité de répondre aux questions,
- qui n’avaient pas pu mettre à notre disposition la carte mémoire de leur PPC,
- traités pour un SAS central,
- qui étaient sous traitement antidépresseur ou sous somnifère,
- diagnostiqués et mis sous PPC en dehors du Togo,
- qui ont refusé de participer à l’enquête,
- connus apnéiques et sous PPC mais n’ont pas pu être joints ou décédés.
Nous avons exclu de cette étude, les patients qui utilisaient une PPC dont nous ne disposons pas le logiciel d’analyse des données d’observance.
Nous avons procédé à un recensement exhaustif de tous les patients, souffrant d’un SAOS modéré à sévère
diagnostiqué entre le 1er janvier 2016 et le 31 décembre 2022, à qui une PPC avait été prescrite. Contactés par téléphone, ils ont été entretenus sur le but de l’étude. Les patients qui disposaient d’un appareil de PPC, étaient priés de l’apporter pour l’extraction des données de rapports d’observance des trois derniers mois. A chaque patient, ayant consenti de participer à l’étude, un auto-questionnaire était administré et les données anthropométriques collectées.
A l’aide d’une fiche d’enquête pré-établie, nous avons recueilli :
- les caractéristiques sociodémographiques : âge, sexe, statut matrimonial, profession, lieu de résidence ;
- les antécédents et habitudes de vie : antécédents médicaux et chirurgicaux, consommation d’alcool et/ou de tabac, prise de médicament au long cours ;
- les données cliniques :
+ les données anthropométriques : poids (Kg), taille (m), IMC (Kg/m2), tension artérielle (mmHg), tour de cou (cm), tour de taille (cm)
+ signes fonctionnels (nocturnes et diurnes) avant et après mise sous PPC
- les données polygraphiques avant la mise sous PPC ;
- les données thérapeutiques (marque de PPC et le type, pressions (cmH2O)) ;
- les données d’observance sous PPC (Index d’apnées hypopnées (IAH) résiduel (/h), fuites non intentionnelles (l/min), nombre de jours d’utilisation d’au moins 4h, proportion de jours d’utilisation durant le dernier trimestre).
Analyse des données
Un contrôle de qualité de remplissage des auto-questionnaires a été fait. Les données ont été analysées avec le logiciel Epi info dans sa version 7. Les valeurs moyennes ont été présentées avec l’écart type comme indice de dispersion. Le test de Chi2 ou le test exact de Fisher ont été utilisés pour la comparaison des variables catégorielles lorsque nécessaire. Les liaisons entres les variables étaient considérées comme statistiquement associées au seuil de probabilité de 0,05. Une régression logistique a été faite en vue d’identifier les facteurs associés à une bonne observance.
Dans le cadre de cette étude, les définitions opérationnelles suivantes ont été retenues :
Tour de cou excessif
Le tour de cou était qualifié d’excessif quand le périmètre cervical (PC) était supérieur à 41 cm chez la femme, à 43 cm chez l’homme [6].
Obésité abdominale
Il y’a obésité abdominale lorsque le tour de taille, mesuré à hauteur de l’ombilic, était supérieur à 80 cm chez la femme, à 94 cm chez l’homme [6].
Fuites non intentionnelles
Le seuil des fuites non intentionnelles varie selon les constructeurs. A partir des rapports d’observance, nous avons considéré:
- une fuite non intentionnelle d’origine buccale lorsque la fuite au 95ème centile était supérieure à 24 l/min et
- une fuite non intentionnelle liée à un mauvais ajustement du masque lorsque la fuite médiane était supérieure à 12 l/min [7].
Observance thérapeutique de la PPC
L’observance thérapeutique était ‘bonne’ lorsque la PPC était effectivement utilisée pendant au moins 4 h par nuit, et ce pendant au moins 80% des nuits, soit pendant au moins 72 jours sur le dernier trimestre précédent l’enrôlement dans l’étude.
Lorsqu’une des deux conditions n’était pas réunie, l’observance était qualifiée ‘mauvaise’ [7].
L’étude a été réalisée en conformité avec les lois bioéthiques et avec les bonnes pratiques cliniques. Les patients ont été informés du but de l’étude et de leur droit de refuser ou de participer à l’étude. Leur anonymat a été respecté par la codification des fiches d’enquête. Les patients non observants, du fait d’un mauvais réglage de leur PPC, ont bénéficié d’une titration gratuite. Tous les patients ont été encouragés à respecter le traitement et à signaler toutes difficultés pour assistance médicale.
RÉSULTATS
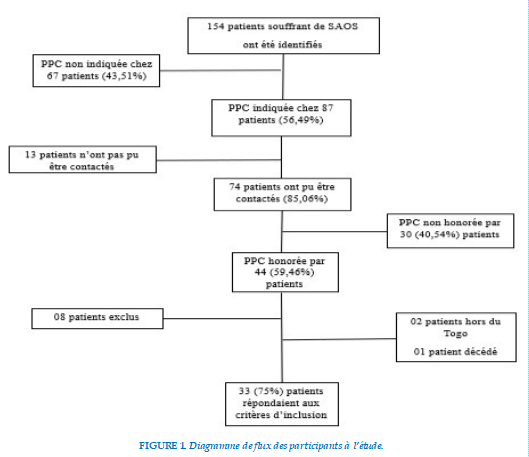
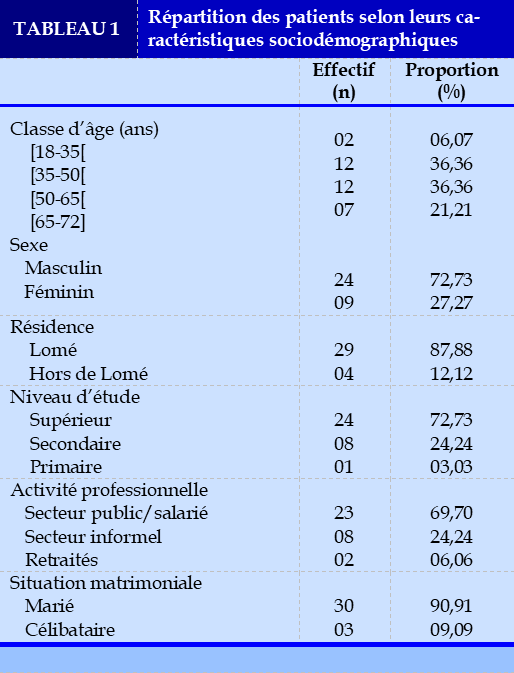
Sur un effectif de 154 patients recensés, 33 patients (soit une proportion de 21,43 %) ont constitué notre population d’étude (Figure 1). La prédominance était masculine avec un sex ratio de 2,67. Les patients étaient âgés en moyenne de 52,3±10,3 ans avec des extrêmes de 21 et 72 ans. Les autres caractéristiques sociodémographiques sont présentées dans le Tableau 1.
Aspects cliniques
Les antécédents médicaux étaient une hypertension artérielle (45,45 %), une dyslipidémie (39,39 %), un syndrome métabolique (24,24 %) ou un diabète (18,18 %). La consommation d’alcool et de tabac était retrouvée respectivement chez 51,51 % et 6,06 % des patients.
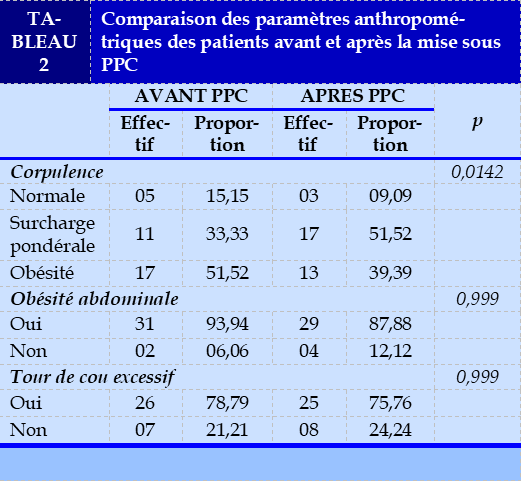
L’IMC moyen des patients était de 32,85±3,10 kg/m2 contre 33,62±2,77 kg/m2 avant la mise sous PPC (p = 0,89). Après la mise sous PPC, un gain pondéral était observé chez deux patients et une perte de poids chez quatre patients. Le Tableau 2 présente la répartition des patients selon les paramètres anthropométriques avant et après la mise sous PPC.
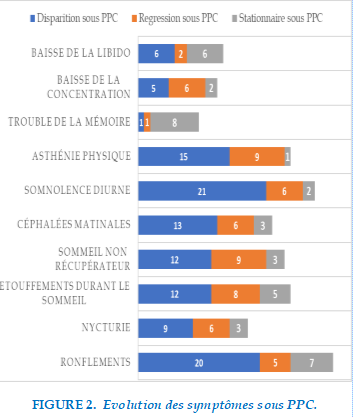
La Figure 2 nous présente l’évolution des symptômes sous PPC. La somnolence diurne avait disparu chez 21/29 patients, l’asthénie physique chez 15/25, la nycturie chez 9/18 .
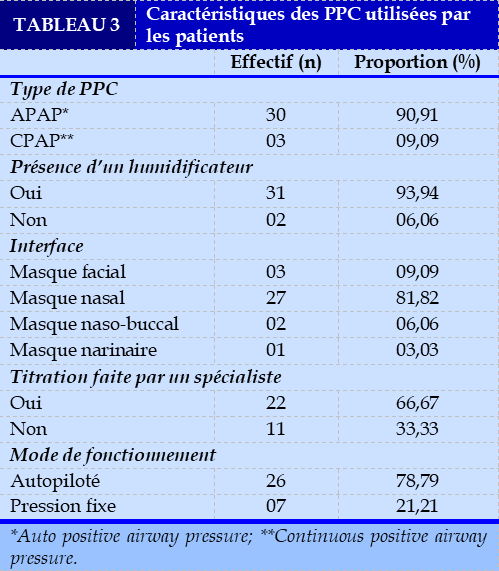
La majorité des patients avait une PPC auto-pilotée (90,91 %) et un masque nasal (81,82 %). Une titration de l’appareil a été faite dans 66,67 % des cas. La pression thérapeutique était fixe dans 21,21 % des cas. Les pressions prescrites étaient en moyenne de 14,6±2,8 cmH2O. Les autres caractéristiques des PPC sont présentées dans le Tableau 3.
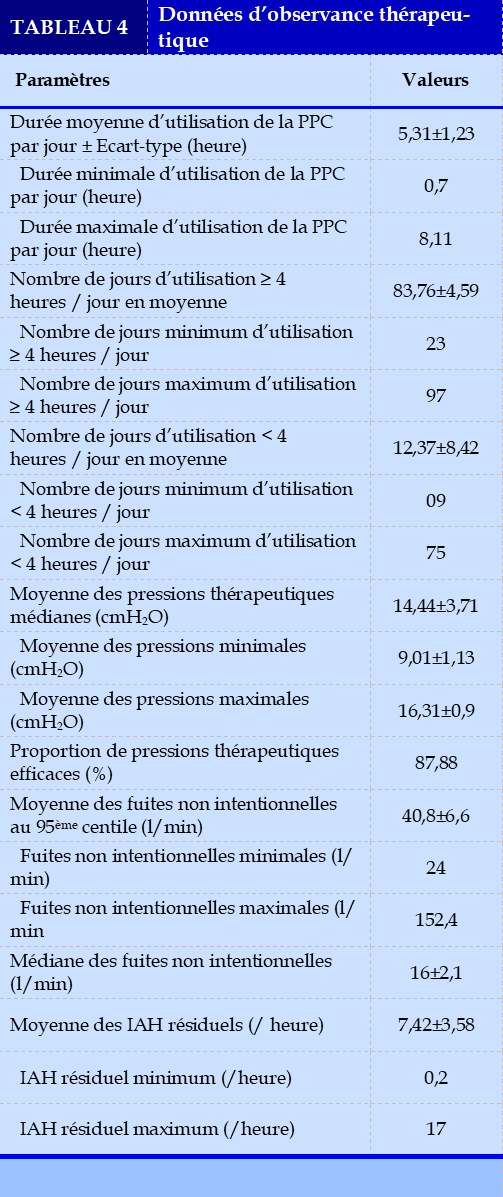
Une proportion de 93,06 % des patients ont utilisé leur PPC pendant au moins 72 jours lors du dernier trimestre. Le nombre de jours d’utilisation, supérieure à 4h/jour, était en moyenne de 83,76±4,59 jours. La durée moyenne d’utilisation de la PPC par jour était de 5,3±1,2 heures par nuit. L’observance était bonne dans 60,61 % des cas contre 39,39 %. Le tableau 4 présente les données générales d’observance des patients.
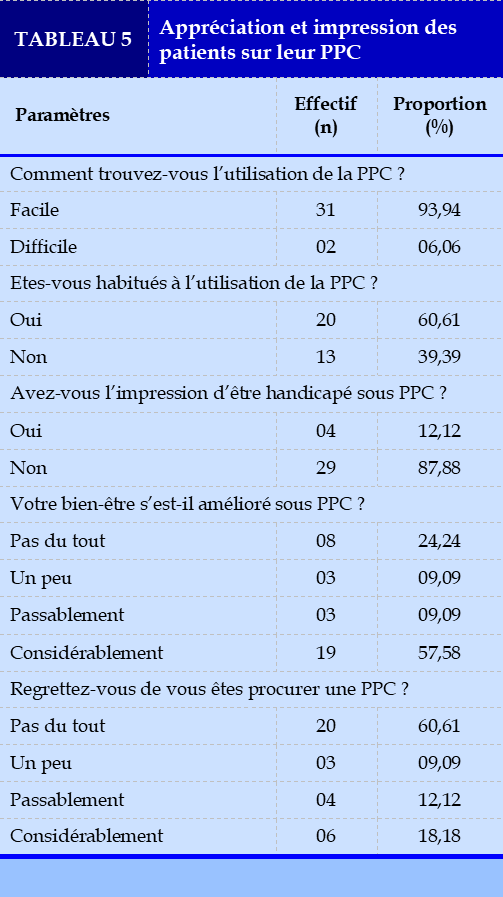
Le principal motif de mauvaise observance était la survenue d’effets secondaires (30,30 %). Les autres motifs étaient l’absence d’amélioration clinique (24,24 %), la régression des symptômes (12,12 %), la sensation d’étouffements (09,09 %) ou la perte d’estime de soi (06,06 %).
Les effets indésirables de la PPC étaient l’aérophagie (48,48 %), l’obstruction nasale (24,24 %), la sécheresse oro-pharyngée (24,24 %), les quintes de toux (21,21 %), l’irritation oculaire (09,09 %), la blessure de la racine du nez (06,06 %) ou l’allergie au masque (03,03 %).
Une proportion de 60,61 % des patients s’était habituée à l’usage de la PPC et le bien-être se serait considérablement amélioré dans 57,58 % des cas (Tableau 5).
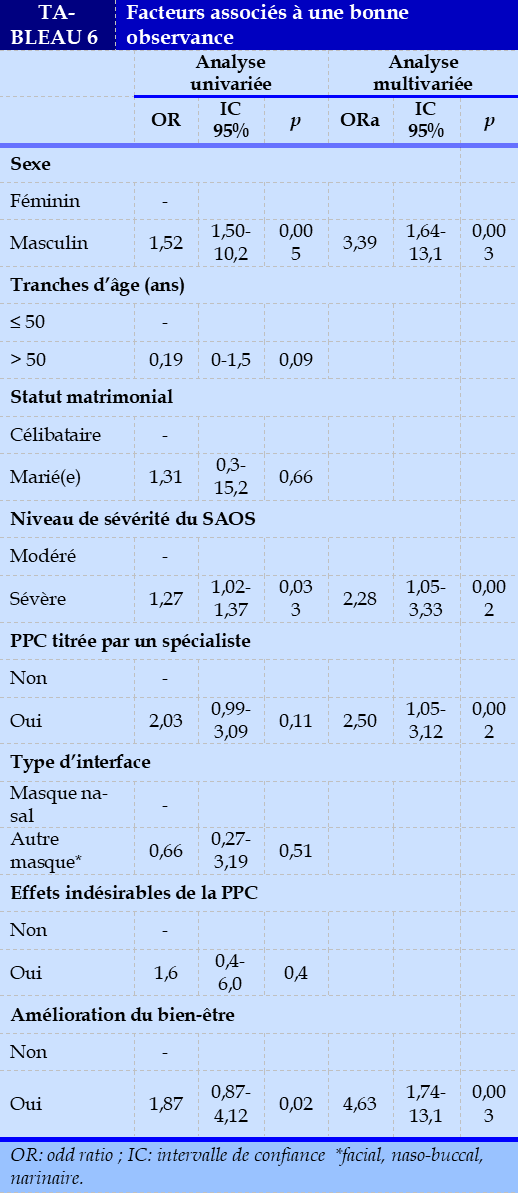
un SAOS sévère et un bien-être sous PPC étaient associés à une bonne observance avec des odds ratios respectifs de 2,28 et 4,63 (Tableau 6).
DISCUSSION
La majorité des patients résidait à Lomé, capitale du Togo. Il en était de même dans l’étude de Ouédraogo AR et al. où la majorité des patients résidait à Ouagadougou, capitale du Burkina Faso [8]. Dans les pays à ressources limitées, les examens spécialisés sont plus disponibles dans les capitales économiques. La majorité des patients avait un niveau d’étude supérieur. Plus un patient est instruit, plus il a accès aux bonnes informations médicales. La vulgarisation de l’internet a facilité la communication et la diffusion des informations médicales. La forte proportion des patients mariés pourrait s’expliquer par le fait que les partenaires des patients apnéiques, gênés par les ronflements de leur conjoint(e) et inquiets des épisodes de pauses respiratoires, motiveraient ces derniers à honorer l’ordonnance de PPC, une fois le diagnostic établi et l’indication posée [9,10]. Les représentations que se fait la population des différents symptômes du SAOS pourraient, dans certains cas, influencer négativement l’adhésion au traitement par PPC. En effet, au Togo, pour 51 % de la population générale, les ronflements seraient l’expression d’un bon sommeil [11].
Dans notre étude, la majorité des patients était en surcharge pondérale voire obèse. Si l’obésité est reconnue comme étant le principal facteur de risque de SAOS, une corpulence normale n’exclut pas le SAOS car il y’a d’autres facteurs de risque, tels l’obésité abdominale ou un tour de cou excessif, qui peuvent être incriminés [6]. Sous PPC, on observa une évolution du poids dans les deux sens. En effet, alors que certains avaient perdu du poids, d’autres en avaient plutôt gagné. Cela pourrait s’expliquer par le fait que l’amélioration de l’hygiène de vie contribuerait à une perte de poids. D’autre part, l’amélioration des symptômes et du bien-être induit par la PPC pourrait favoriser un relâchement des mesures hygiéno-diététiques, occasionnant ainsi une prise de poids. Le patient, devenu moins asthénique, peut avoir tendance à ne pas être rigoureux vis-à-vis des mesures hygiéno-diététiques. Par ailleurs, il a été démontré que le SAS serait responsable d’une perturbation hormonale marquée par une inhibition de la leptine au profit de la ghréline. Il en résulte une attitude boulimique responsable d’une prise progressive du poids, entretenant le cycle de dysrégulation hormonale [12]. Il est certain qu’une perte de poids a un effet bénéfique sur le SAS et pourrait amener à réduire la pression de traitement [13]. D’une façon générale, on nota une amélioration des symptômes du SAOS, qui régressaient voire disparaissaient. Plusieurs études s’accordent sur l’efficacité de la PPC [4, 14] sur les symptômes isolés du SAOS et sur l’amélioration du bien-être. La persistance d’une SDE peut faire émettre plusieurs hypothèses. En effet, certains patients avaient signalé être consommateurs d’alcool. Certes l’importance de l’intoxication éthylique n’a pas été précisée. Une consommation importante d’alcool, avant le coucher, peut induire une SDE [15]. Une mauvaise observance thérapeutique, les horaires de travail posté ou de nuit, la prise de certains médicaments, de mauvaises habitudes de sommeil avec l’usage abusif des écrans sont autant de facteurs d’une SDE.
Une proportion de 33,33 % des patients utilisaient leur PPC sans l’avoir fait titrer préalablement. La détermination des pressions thérapeutiques efficaces, prenant en compte les particularités cliniques, polygraphiques, est un gage d’une meilleure efficacité thérapeutique avec moins d’effets indésirables (EI) [16]. Quatre patients, disposant d’une PPC auto-pilotée, se sont vus prescrire une pression fixe. Gagnadoux et al ainsi que Galekte W et al n’ont pas retrouvé d’efficacité supérieure d’un mode contre l’autre. Toutefois, il a été rapporté que le mode autopiloté serait associé à moins d’effets indésirables que le mode fixe [16, 17]. Il s’agit véritablement d’une médecine personnalisée.
Le masque nasal était l’interface le plus utilisé dans notre série. Cela semble être le cas d’une façon générale selon la littérature [18]. Selon Rowland S et al., le type d’interface n’avait pas d’influence sur l’adhérence du traitement à la PPC. Cependant, ils ont noté que la PPC était plus efficace avec le masque nasal car l’IAH résiduel était plus faible [19]. Les patients rapportaient un meilleur confort et un meilleur sommeil avec un masque nasal. Le masque facial et le bucco-nasal sont moins appréciés par les patients car ils seraient plus encombrants et augmenteraient la perte d’estime de soi. Le masque narinaire est plus instable mais a l’avantage d’être moins encombrant. Il reste une alternative intéressante chez les patients claustrophobes.
Une proportion de 87,88 % des enquêtés de notre série avait une pression thérapeutique efficace. La pression prescrite était en moyenne de 14,44±3,71 cmH2O. Ce résultat est supérieur à celui de Ouédraogo AR et al. qui retrouvaient une pression thérapeutique moyenne de 12 cmH2O [8]. La pression thérapeutique devrait tenir compte de plusieurs paramètres : la sévérité du SAOS, l’importance du tour de cou, la présence ou non d’une cardiopathie sous-jacente. Une pression trop élevée pourrait non seulement donner une impression d’étouffement, mais aussi entrainer une importante aérophagie. Une bonne titration aurait permis non seulement de régler les meilleurs paramètres de traitement pour le patient, mais aussi lui apprendre à porter au mieux son interface.
Des EI, liés à l’utilisation de la PPC, ont été rapportés dans 30,30 % des cas. La fréquence des EI avoisinait celle notifiée dans l’étude de Pépin JL et al. en France [20]. Ghadiri M et al., en Tunisie, ont rapporté des fréquences plus élevées de 50 à 75,9 % des cas [21]. Cela témoigne que la PPC est un véritable traitement qui doit faire l’objet d’une prescription et d’un suivi médical. Il est important de maintenir la communication entre le médecin, le prestataire de services à domicile (PSAD) et le patient pour une gestion efficace des EI selon Damjanovic D et al. [22]. Les principaux EI étaient l’aérophagie, l’obstruction nasale et la sécheresse oro-pharyngée. L’aérophagie est souvent due à des pressions de traitement trop élevées. Une mauvaise mise en place de l’interface, à l’origine d’importantes fuites non intentionnelles, peut induire une augmentation des pressions en mode auto-piloté occasionnant ainsi le passage de plus d’air dans les voies digestives. L’obstruction nasale et la sécheresse oro-pharyngée sont imputables à une mauvaise humidification, soit en excès, soit par défaut. Un humidificateur, réglable par le patient, souvent associé à la PPC, permet d’éviter ces incidents [7].
L’observance était bonne dans 60,61 % des cas. La régression, voire la disparition, des symptômes était observée chez 57,58% des patients, renforçait la motivation à utiliser davantage la PPC. En effet, une proportion de 93,06 % des patients avait utilisé la PPC pendant au moins 80 % du temps au cours du dernier trimestre. Les patients, qui ressentaient un bien-être, étaient 4,63 fois plus compliants au traitement. La diminution voire la disparition des symptômes diurnes, qui impactaient négativement la vie socio-professionnelle, constitue une véritable motivation à l’observance thérapeutique [23].
Une méta-analyse avait conclu à une amélioration de la qualité de vie des cas de SAOS modéré à sévère sous ventilation en PPC bien conduite [24]. L’âge n’était pas un facteur favorisant ou non de l’observance thérapeutique ; ce qui n’était pas le cas dans l’étude de Pelletier-Fleury N. et al. où les sujets âgés de moins de la soixantaine étaient nettement plus observants [25]. Les hommes étaient 3,39 fois plus observants que les femmes. La perte de l’estime de soi pourrait être un facteur démotivant pour les femmes [25]. A l’inverse, les femmes encourageraient plus leur conjoint à l’utilisation de la PPC. Il est ressorti, dans l’étude de Cartwright R et al., que l’observance de la PPC était positivement corrélée au nombre de nuits passées en couple [26].
Selon Gagnadoux F et al., le risque d’inobservance thérapeutique était majoré chez les patients vivants seuls ou professionnellement inactifs [27]. Enfin, les patients qui avaient bénéficié d’un accompagnement médical, à travers la titration de leur PPC, étaient 2,5 fois plus observants. Le SAOS est une maladie chronique qui impose une véritable éducation thérapeutique afin d’améliorer la compliance au traitement par PPC et de réduire sa morbi-mortalité [28]. Le développement de l’internet a permis de faciliter le télésuivi des appareils de PPC par les PSAD [29].
Dans les pays à ressources limitées, le développement du télésuivi pourrait aider à optimiser le traitement par PPC.
CONCLUSION
L’observance conditionne l’efficacité de la PPC dans le traitement du SAOS. L’analyse des données d’observance a révélé une utilisation satisfaisante malgré quelques EI notifiés. Les facteurs associés à une bonne observance thérapeutique étaient le sexe masculin, le caractère sévère du SAS, l’amélioration du bien-être et l’assistance d’un médecin pour la titration de la PPC. Les patients devraient être mieux informés sur la nécessité d’un accompagnement médical lors de l’initiation du traitement par PPC. Cela devra s’intégrer systématiquement dans l’éducation thérapeutique du patient apnéique.
CONFLIT D’INTERÊTS
Aucun.
REFERENCE
| 1. Morgenthaler TI, Kagramanov V, Hanak V, Decker PA. Complex sleep apnea syndrome : is it a unique clinical syndrome? Sleep 2006 ; 29 : 1203‑9. |
| 2. Escourrou P, Roisman GL. Epidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte et de ses complications. Médecine du sommeil 2010 ; 7 : 119‑28. |
| 3. Adambounou AS, Adjoh KS, Aziagbé KA, Foma W, Gbadamassi AG, Tougan A and al. Prevalence des symptoms du syndrome d’apnées du sommeil à Lomé. J Func Vent Pulm 2016 ; 22(7) : 32-9. |
| 4. Sullivan CE, Berthon-Jonas M, Issa FG, Eves L. Reversal of obstructive sleep apnea by continuous positive airway pressure applied through the nares. Lancet 1981 ; 4 : 862-5. |
| 5. Adjoh KS, Adambounou AS, Gbadamassi AG, Efalou P, Ouédraogo AR, Aziagbé KA and al. Syndrome d’apnées obstructives durant le sommeil : aspects épidémiologiques, cliniques et paracliniques des premiers cas à Lomé. J Func Vent Pulm 2017 ; 24(8) : 10-7. |
| 6. Janssen I, Katzmarzyk PT, Ross R. Body Mass Index, waist circumference and health risk. Arch Intern Med 2002 ; 162 : 2074-9. |
| 7. Société Française de Recherche et de Médecine du Sommeil. Recommandations pour la pratique clinique Syndrome d’apnées hypopnées obstructives du sommeil. Rev Mal Respir 2010 ; 27 : 806-33. |
| 8. Ouédraogo AR, Kunakey EK, Sourabié A, Tiendrebeogo A, Ouédraogo JCRP, Ouédraogo GA et al. Suivi thérapeutiques des patients apnéiques sous ventilation à pression positive continue au Burkina Faso. Médecine du sommeil 2022 ; 19 : 175-81. |
| 9. Meslier N., Vol S., Balkau B. et al. Prévalence des symptômes du syndrome d'apnées du sommeil. Étude dans une population française d'âge moyen. Rev Mal Respir 2007 ; 24 :305-13. |
| 10. Ouédraogo AR, Ouédraogo G, Bemba EL, Adambounou AS, Boncoungou K, Maiga S et al. Motifs de référence en consultation sommeil au Burkina Faso: A Propos du syndrome d’apnées obstructif du sommeil. Médecine du sommeil 2018 ; 15(4) : 191-7. https://doi.org/10.1016/j.msom.2018.07.002 |
| 11. Adambounou TAS, Gbeasor-Komlanvi FA, Foma W, Biaou DM, Doubidji AM, Adjoh KS. Connaissances et croyances des utilisateurs de réseaux sociaux sur le syndrome d’apnées du sommeil au Togo. Médecine du sommeil 2022 ; 19 : 89-100. |
| 12. Harsch IA, Konturek PC, Koebnick C, Kuehnlein PP, Fuchs FS, Wiest GH et al. Leptin and ghrelin levels in patients with obstructive sleep apnea : effect of CPAP treatment. Eur Respir J 2003 ; 22(2) : 251-7. |
| 13. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. J Am Med Assoc 2000 ; 284 : 3015‑21. |
| 14. Patil SP, Ayappa IA, Caples SM, Kimoff RJ, Patel SR, Harrod CG. Treatment of adult obstructive sleep apnea with positive airway pressure: an American Academy of Sleep Medicine systematic review, meta-analysis, and grade assessment. J Clin Sleep Med 2019 ; 15 : 301-34. |
| 15. Simou E, Britton J, Leonardi-Bee J. Alcohol and the risk of sleep apnea: a systematic review and meta-analysis. Sleep Med 2018 ; 42 : 38-46. |
| 16. Gagnadoux F, Gindre L, Meslier N, Person C, Racineux J-L. Le suivi pratique des patients sous pression positive continue. Revue de Pneumologie Clinique 2009 ; 65 : 219-24. |
| 17. Galetke W, Anduleit N, Richter K, Stieglitz S, Randerath WJ. Comparison of automatic and continuous positive airway pressure in a night by night analysis : a randomized, crossover study. Respiration 2008 ; 75(2) : 163-9. |
| 18. Chai CL, Pathinathan A, Smith BJ. Continuous positive airway pressure delivery interfaces for obstructive sleep apnea. Cochrane Database of Syst Rev 2006 ; 18(4) : CD005308. |
| 19. Rowland S, Aiyappan V, Hennessy C, Catcheside P, Chai-Coetzer CL, McEvoy RD et al. Comparing the efficacy, mask leak, patient adherence, and patient preference of three different CPAP interfaces to treat moderate-severe obstructive sleep apnea. J Clin Sleep Med 2018 ; 14 : 101-8. |
| 20. Pepin JL, Leger P, Veale D, Langevin B, Robert D, Levy P. Side Effects of Nasal Continuous Positive Airway Pressure in Sleep Apnea Syndrome. Chest 1995 ; 107 : 375-81. |
| 21. Ghadiri M, Grunstein RR. Clinical side effects of continuous positive airway pressure in patients with obstructive sleep apnea. Respirology 2020;25: 593-602. |
| 22. Damjanovic D, Fluck A, Bremer H, Müller-Quernheim J, Idzko M, Sorichter S. Compliance in sleep apnoea therapy: influence of home care support and pressure mode. Eur Respir J 2009 ; 33 : 804‑11. |
| 23. Hoffstein V, Viner S, Mateika S, Conway J. Treatment of obstructive sleep apnea with nasal continuous positive airway pressure. Patient compliance, perception of benefits, and side effects. Am Rev Respir Dis 1992 ; 145 : 841-5. |
| 24. Giles TL, Lasserson TJ, Smith B, White J, Wright JJ, Cates CJ. Continuous positive airways pressure for obstructive sleep apnea in adults, Cochrane Database of Syst Rev 2006 ; (1) : CD001106. |
| 25. Pelletier-Fleury N., Rakotonanahary D, Fleury B. The age and other factors in the evaluation of compliance with nasal continuous positive airway pressure for obstructive sleep apnea syndrome. A Cox's proportional hazard analysis Sleep Medicine 2001 ; 2(3) : 225-32 |
| 26. Cartwright R. Sleeping together : a pilot study of the effects of shared sleeping on adherence to CPAP treatment in obstructive sleep apnea. J Clin Sleep Med 2008 ; 4 : 123-7. |
| 27. Gagnadoux F, Le Vaillant M, Goupil F, Pigeanne T, Chollet S, Masson P, and al. Influence of marital status and employment status on long-term adherence with continuous positive airway pressure in sleep apnea patients. PloS One. 2011 ; 6 : e22503. |
| 28. Bizieux-Thaminy G. Long term use of nCPAP therapy in sleep apnea patients. Rev Mal Respir 2005; 22:951-7. |
| 29. Sparrow D, Aloia M, Demolles DA, Gottlieb DJ. A telemedicine intervention to improve adherence to continuous positive airway pressure: a randomised controlled trial. Thorax 2010 ; 65(12) : 1061-6. |
FIGURE - TABLES
REFERENCE
| 1. Morgenthaler TI, Kagramanov V, Hanak V, Decker PA. Complex sleep apnea syndrome : is it a unique clinical syndrome? Sleep 2006 ; 29 : 1203‑9. |
| 2. Escourrou P, Roisman GL. Epidémiologie du syndrome d’apnées-hypopnées obstructives du sommeil de l’adulte et de ses complications. Médecine du sommeil 2010 ; 7 : 119‑28. |
| 3. Adambounou AS, Adjoh KS, Aziagbé KA, Foma W, Gbadamassi AG, Tougan A and al. Prevalence des symptoms du syndrome d’apnées du sommeil à Lomé. J Func Vent Pulm 2016 ; 22(7) : 32-9. |
| 4. Sullivan CE, Berthon-Jonas M, Issa FG, Eves L. Reversal of obstructive sleep apnea by continuous positive airway pressure applied through the nares. Lancet 1981 ; 4 : 862-5. |
| 5. Adjoh KS, Adambounou AS, Gbadamassi AG, Efalou P, Ouédraogo AR, Aziagbé KA and al. Syndrome d’apnées obstructives durant le sommeil : aspects épidémiologiques, cliniques et paracliniques des premiers cas à Lomé. J Func Vent Pulm 2017 ; 24(8) : 10-7. |
| 6. Janssen I, Katzmarzyk PT, Ross R. Body Mass Index, waist circumference and health risk. Arch Intern Med 2002 ; 162 : 2074-9. |
| 7. Société Française de Recherche et de Médecine du Sommeil. Recommandations pour la pratique clinique Syndrome d’apnées hypopnées obstructives du sommeil. Rev Mal Respir 2010 ; 27 : 806-33. |
| 8. Ouédraogo AR, Kunakey EK, Sourabié A, Tiendrebeogo A, Ouédraogo JCRP, Ouédraogo GA et al. Suivi thérapeutiques des patients apnéiques sous ventilation à pression positive continue au Burkina Faso. Médecine du sommeil 2022 ; 19 : 175-81. |
| 9. Meslier N., Vol S., Balkau B. et al. Prévalence des symptômes du syndrome d'apnées du sommeil. Étude dans une population française d'âge moyen. Rev Mal Respir 2007 ; 24 :305-13. |
| 10. Ouédraogo AR, Ouédraogo G, Bemba EL, Adambounou AS, Boncoungou K, Maiga S et al. Motifs de référence en consultation sommeil au Burkina Faso: A Propos du syndrome d’apnées obstructif du sommeil. Médecine du sommeil 2018 ; 15(4) : 191-7. https://doi.org/10.1016/j.msom.2018.07.002 |
| 11. Adambounou TAS, Gbeasor-Komlanvi FA, Foma W, Biaou DM, Doubidji AM, Adjoh KS. Connaissances et croyances des utilisateurs de réseaux sociaux sur le syndrome d’apnées du sommeil au Togo. Médecine du sommeil 2022 ; 19 : 89-100. |
| 12. Harsch IA, Konturek PC, Koebnick C, Kuehnlein PP, Fuchs FS, Wiest GH et al. Leptin and ghrelin levels in patients with obstructive sleep apnea : effect of CPAP treatment. Eur Respir J 2003 ; 22(2) : 251-7. |
| 13. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. J Am Med Assoc 2000 ; 284 : 3015‑21. |
| 14. Patil SP, Ayappa IA, Caples SM, Kimoff RJ, Patel SR, Harrod CG. Treatment of adult obstructive sleep apnea with positive airway pressure: an American Academy of Sleep Medicine systematic review, meta-analysis, and grade assessment. J Clin Sleep Med 2019 ; 15 : 301-34. |
| 15. Simou E, Britton J, Leonardi-Bee J. Alcohol and the risk of sleep apnea: a systematic review and meta-analysis. Sleep Med 2018 ; 42 : 38-46. |
| 16. Gagnadoux F, Gindre L, Meslier N, Person C, Racineux J-L. Le suivi pratique des patients sous pression positive continue. Revue de Pneumologie Clinique 2009 ; 65 : 219-24. |
| 17. Galetke W, Anduleit N, Richter K, Stieglitz S, Randerath WJ. Comparison of automatic and continuous positive airway pressure in a night by night analysis : a randomized, crossover study. Respiration 2008 ; 75(2) : 163-9. |
| 18. Chai CL, Pathinathan A, Smith BJ. Continuous positive airway pressure delivery interfaces for obstructive sleep apnea. Cochrane Database of Syst Rev 2006 ; 18(4) : CD005308. |
| 19. Rowland S, Aiyappan V, Hennessy C, Catcheside P, Chai-Coetzer CL, McEvoy RD et al. Comparing the efficacy, mask leak, patient adherence, and patient preference of three different CPAP interfaces to treat moderate-severe obstructive sleep apnea. J Clin Sleep Med 2018 ; 14 : 101-8. |
| 20. Pepin JL, Leger P, Veale D, Langevin B, Robert D, Levy P. Side Effects of Nasal Continuous Positive Airway Pressure in Sleep Apnea Syndrome. Chest 1995 ; 107 : 375-81. |
| 21. Ghadiri M, Grunstein RR. Clinical side effects of continuous positive airway pressure in patients with obstructive sleep apnea. Respirology 2020;25: 593-602. |
| 22. Damjanovic D, Fluck A, Bremer H, Müller-Quernheim J, Idzko M, Sorichter S. Compliance in sleep apnoea therapy: influence of home care support and pressure mode. Eur Respir J 2009 ; 33 : 804‑11. |
| 23. Hoffstein V, Viner S, Mateika S, Conway J. Treatment of obstructive sleep apnea with nasal continuous positive airway pressure. Patient compliance, perception of benefits, and side effects. Am Rev Respir Dis 1992 ; 145 : 841-5. |
| 24. Giles TL, Lasserson TJ, Smith B, White J, Wright JJ, Cates CJ. Continuous positive airways pressure for obstructive sleep apnea in adults, Cochrane Database of Syst Rev 2006 ; (1) : CD001106. |
| 25. Pelletier-Fleury N., Rakotonanahary D, Fleury B. The age and other factors in the evaluation of compliance with nasal continuous positive airway pressure for obstructive sleep apnea syndrome. A Cox's proportional hazard analysis Sleep Medicine 2001 ; 2(3) : 225-32 |
| 26. Cartwright R. Sleeping together : a pilot study of the effects of shared sleeping on adherence to CPAP treatment in obstructive sleep apnea. J Clin Sleep Med 2008 ; 4 : 123-7. |
| 27. Gagnadoux F, Le Vaillant M, Goupil F, Pigeanne T, Chollet S, Masson P, and al. Influence of marital status and employment status on long-term adherence with continuous positive airway pressure in sleep apnea patients. PloS One. 2011 ; 6 : e22503. |
| 28. Bizieux-Thaminy G. Long term use of nCPAP therapy in sleep apnea patients. Rev Mal Respir 2005; 22:951-7. |
| 29. Sparrow D, Aloia M, Demolles DA, Gottlieb DJ. A telemedicine intervention to improve adherence to continuous positive airway pressure: a randomised controlled trial. Thorax 2010 ; 65(12) : 1061-6. |
ARTICLE INFO DOI: 10.12699/jfvpulm.15.45.2024.14
Conflict of Interest
Non
Date of manuscript receiving
11/9/2023
Date of publication after correction
25/01/2024
Article citation
ADAMBOUNOU Tété Amento Stéphane, OUATTARA Khadidia, AKO Akouvi Mawussé Edjodjinam, MOUZOU Tchilalo, OGOUNDE Nadjibé Aladé, ADJOH Komi Séraphin. Assessment of sleep apnea syndrome treatment by continuous positive airway pressure in Togo. J Func Vent Pulm 2024;45(15):14-22