
 English
English
 French
French
Antibiotic resistance profile of bacteria isolated during lower respiratory infections in Lomé
Profil de résistance aux antibiotiques des bactéries isolées au cours des infections respiratoires basses à Lomé
Zoutené 1, D.M. Biaou 1, A.M. Godonou 2, T.N.V. Gateu 1, A.M.E. Ako 1, K.A. Aziagbe1,3, Y.A. Dagnra 2,3, K.S. Adjoh 1,3
1: Service de pneumologie, CHU Sylvanus Olympio, Togo.
2: Laboratoire de bactériologie, CHU Sylvanus Olympio, Togo
3: Faculté des Sciences de la Santé, Université de Lomé, Togo.
Corresponding author:
ZOUTENE Maïssala. Service de pneumologie, CHU Sylvanus Olympio, Lomé, Togo
E-mail: zoutenemaissala@gmail.com
ABSTRACT
Introduction. Antibiotic resistance is a major risk factor for mortality linked to respiratory infections. The objective of this study was to study the antibiotic resistance profile of bacteria responsible for lower respiratory infections in the pulmonology department of Lomé.
Methods. This was a retrospective cross-sectional study which covered the period from June 1, 2021 to June 30, 2023. Samples from patients with a lower respiratory infection, whose bacteriological analysis made it possible to isolate at least one bacteria with available antibiogram were included.
Results:. In total, 135 bacteria were isolated. Gram-negative bacilli (93/135) predominated, led by Pseudomonas aeruginosa (25.8%), Klebsiella pneumoniae (24.7%) and Escherichia coli. Analysis of antibiogram reports revealed resistance to first-line antibiotics (amoxicillin - clavulanic acid, ceftriaxone, cefotaxime) greater than 70.0%. More than half of Escherichia coli, streptococci and staphylococci were resistant to levofloxacin.
Conclusion. This work confirms the trend towards increasing bacterial resistance to antibiotics. Carbapenems, although they represent a second-line alternative, pose the problem of cost in our context.
KEYWORDS: Respiratory infection; Resistance; Togo.
RÉSUMÉ
Introduction. La résistance aux antibiotiques est un facteur de risque majeur de mortalité liée aux infections respiratoires. L’objectif de cette étude était d’étudier le profil de résistance aux antibiotiques des bactéries responsables d’infections respiratoires basses dans le service de pneumologie de Lomé.
Méthodes. Il s’est agi d’une étude transversale rétrospective qui a porté sur la période du 01 juin 2021 au 30 juin 2023. Les prélèvements provenant de patients présentant une infection respiratoire basse, dont l’analyse bactériologique a permis d’isoler au moins une bactérie avec antibiogramme disponible ont été inclus.
Résultats. Au total, 135 bactéries ont été isolées. Les bacilles Gram négatif (93/135) prédominaient avec en tête Pseudomonas aeruginosa (25,8 %), Klebsiella pneumoniae (24,7 %) et Escherichia coli. L’analyse des comptes rendus des antibiogrammes a révélé une résistance aux antibiotiques de première ligne (amoxicilline - acide clavulanique, ceftriaxone, céfotaxime) supérieure à 70,0 %. Plus de la moitié des Escherichia coli, streptocoques et staphylocoques était résistant à la lévofloxacine.
Conclusion. Ce travail confirme la tendance à l’augmentation des résistances bactériennes aux antibiotiques. Les carbapénèmes, s’ils représentent bien une alternative en seconde intention, posent le problème de coût dans notre contexte.
MOTS CLÉS: infection respiratoire; Résistance; Togo.
INTRODUCTION
La résistance aux antibiotiques représente une menace majeure pour la santé humaine au niveau mondial. Selon les estimations, 1,3 million de décès en 2019 lui sont attribuables et les taux de décès attribuables à la résistance aux anti-microbiens en Afrique sub-saharienne occidentale sont les plus élevés au monde. Les infections respiratoires basses représentent une part considérable de ces décès [1].
Au Togo, les infections respiratoires basses sont responsables de 38 % des décès en milieu hospitalier pneumologique [2]. En l'absence de recommandations nationales ou locales pour guider le choix des antibiotiques dans les affections bactériennes et faute d'études d'antibiorésistance pour orienter le clinicien, ce sont les directives des sociétés savantes étrangères [3–5] qui sont suivies. Or, les écologies bactériennes et les profils de sensibilité des bactéries aux antibiotiques ayant servi à l'élaboration de ces recommandations sont différents de ceux rapportés dans les pays africains. L'automédication par les patients, les prescriptions irrationnelles et le mésusage des antibiotiques contribuent aussi à l’émergence des souches de bactéries résistantes aux antibiotiques et accentuent un problème déjà bien présent dans la région [6].
Les données sur l’écologie bactérienne des infections respiratoires basses au Togo sont très partielles [7]. L’objectif de ce travail était d’étudier le profil de résistance aux antibiotiques des bactéries responsables d’infections respiratoires basses dans le service de pneumologie de Lomé afin de guider le choix des antibiotiques de deuxième ligne.
METHODE
Type et période d’étude
Il s’est agi d’une étude transversale rétrospective qui a porté sur la période du 01 juin 2021 au 30 juin 2023 soit une durée de deux ans.
Cadre de l’étude
Le service de Pneumologie du CHU Sylvanus Olympio a servi de cadre d’étude. C’est le service de référence de prise en charge des maladies respiratoires au Togo, pays de la côte ouest-africaine de 8 millions d’habitants.
Population d’étude
Nous avons inclus tous les prélèvements (expectorations, liquide de lavage bronchoalvéolaire, liquide pleural, sang) dont l’analyse bactériologique a permis d’isoler au moins une bactérie avec un antibiogramme disponible. Étaient considérés comme ayant une infection respiratoire basse d’origine bactérienne, les patients présentant depuis moins de huit semaines (évolution aiguë ou subaiguë) :
Au moins deux symptômes d’infection respiratoire (toux, expectorations purulentes, douleur thoracique, dyspnée, fièvre)
Des opacités parenchymateuses pulmonaires compatibles, associées ou non à une atteinte pleurale
Chez qui la recherche de Mycobacterium du complexe tuberculosis par PCR est revenue négative et ayant été traités comme tel par des antibiotiques.
La recherche de Mycobacterium tuberculosis était systématique. Les prélèvements étaient effectués en routine chez les patients présentant une pneumonie sévère ou en échec thérapeutique après un premier traitement antibiotique empirique.
Les patients chez qui une tuberculose a été diagnostiquée ont été exclus. Les prélèvements analysés dans un laboratoire extérieur ont été exclus.
Collecte des données
Les méthodes standards d’isolement et d’identification des bactéries ont été utilisées. Les tests de sensibilité ont été réalisés selon la méthode de diffusion des disques d’antibiotiques de Kirby Bauer en milieu gélosé et interprétés selon les recommandations du CASFM/EUCAST (European Committee of Antibiotic Susceptibility Testing) [8].
Analyse statistique
Les données ont été épurées et analysées avec le logiciel R 4.3.1 (R Core Team, Vienne). Les variables qualitatives ont été présentées selon leurs effectifs et proportions et les quantitatives selon leurs moyennes avec écarts-types. Le taux de résistance était déterminé par le quotient du nombre des bactéries résistantes à l’antibiotique désigné par le nombre des bactéries testées.
Considérations éthiques
Le recueil des données ne nécessitant pas de contact avec les patients, la demande de leurs consentements n’était pas requis. Des autorisations d’accès aux registres et dossiers ont été obtenues auprès des chefs-service de Pneumologie et du laboratoire de Bactériologie du CHU Sylvanus Olympio.
RESULTATS
Taille de l’échantillon
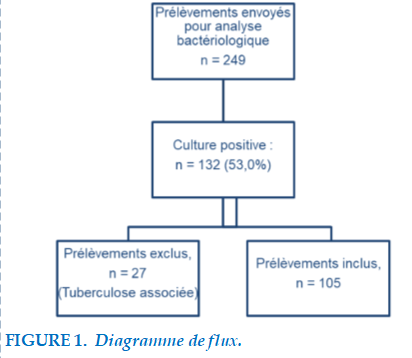
Au cours de la période d’étude, sur un total de 249 échantillons adressés pour analyse bactériologique, la culture était positive pour 132 (53,0 %). Nous avons inclus les antibiogrammes de 105 prélèvements (Figure 1). Deux bactéries avaient été identifiées sur 30 prélèvements.
L’âge moyen des patients était de 50,2 ± 16,56 ans (extrêmes de 14 et 95 ans).
Nature des échantillons et conditions de prélèvements
Les 105 prélèvements étaient constitués de 85 expectorations (81,0 %), dix liquides de lavage broncho-alvéolaire (9,5 %), neuf liquides de ponction pleurale (7,4 %) et une hémoculture (1.1%). Une proportion de 58,9 % des prélèvements avait été effectuée après un traitement antibiotique, et 51,4 % des patients étaient fébriles le jour du prélèvement.
Profil de résistance aux antibiotiques
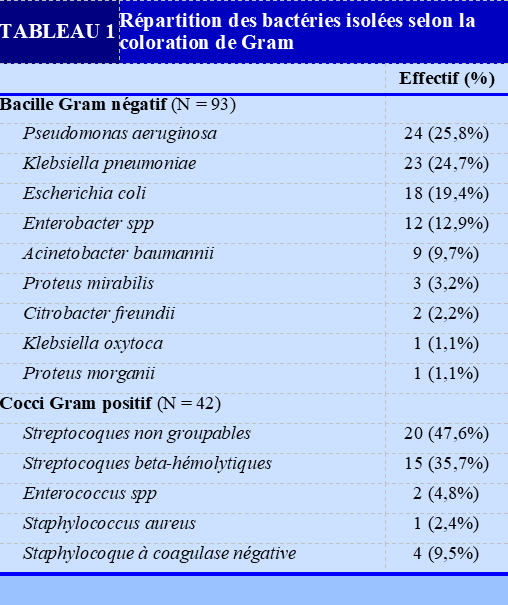
Les bactéries isolées (Tableau 1) étaient principalement des bacilles Gram négatif (93/135). Les principaux bacilles Gram négatif étaient Pseudomonas aeruginosa, Klebsiella pneumoniae et Escherichia coli.
Les taux de résistance des E. coli et des K. pneumoniae aux antibiotiques de première ligne dans les infections respiratoires basses (Amoxicilline associé ou non à l’acide clavulanique, ceftriaxone, céfotaxime) étaient supérieurs à 70,0 % (Tableau 2). Les P. aeruginosa isolés étaient sensibles dans 20 cas sur 21 (soit 95,2 %) à la ceftazidime et à la pipéracilline-tazobactam dans 95,8 % des cas. Plus de la moitié des E. coli était résistante à la lévofloxacine. Les taux de résistance à l’amikacine étaient inférieurs à 10,0 % pour ces trois bactéries.
Les taux de résistance aux bêta-lactamines des cocci Gram positif étaient supérieurs à 50 % (sauf la céfépime pour les streptocoques), voir tableau III. Certains antibiotiques comme la doxycycline et le sulfaméthoxazole-triméthoprime affichent des taux de résistance supérieurs à 90,0 %.
DISCUSSION
Notre étude montre un aperçu général des bactéries responsables des infections respiratoires basses et leur profil de résistance aux antibiotiques couramment utilisés dans notre région. Les limites sont surtout celles liées aux études transversales rétrospectives et la prise d’antibiotiques par une majorité de patients, pouvant entrainer une sélection des bactéries.
Le taux de positivité des prélèvements (53,0 %) dans notre étude est similaire à celui rapporté par El-Sokkary et al. [9] mais inférieur à celui de Siddalingappa et al. en Inde (84,7 %) [10]. Cependant, il est supérieur à ceux rapportés par Gebre et al. en Ethiopie, Amarasinghe et al. au Sri Lanka respectivement (33,5 % ; 29,4 %) [11,12]. Ces différences s’expliquent par la variation des zones géographiques. La propagation des infections respiratoires varie en fonction des régions, des populations, des conditions socio-économiques [13]. Notre prévalence inférieure par rapport à celle retrouvée en Inde s’explique par la proportion élevée (58,9 %) de nos patients qui avaient pris des antibiotiques avant le prélèvement.
Les principales bactéries isolées étaient les bacilles Gram négatif (68,8 %). Notre résultat corrobore ceux d’autres études [14,15]. Les bacilles Gram négatif possèdent une protéine au niveau de la membrane externe responsable de leur virulence [16].
La majorité (81,0 %) des bactéries a été identifiée sur les expectorations. Une prédominance d’identification sur le liquide d’aspiration endotrachéale avait été rapportée par Khan et al. au Népal (41,0 %) [14]. Notre résultat s’explique par la facilité d’obtention des expectorations et le niveau socio-économique bas de nos patients ne leur permettant pas de bénéficier d’un prélèvement invasif.
Le Pseudomonas aeruginosa (25,8 %) était le germe le plus représenté des bacilles Gram négatif. Notre résultat est similaire à celui rapporté au Népal, 35,3 % [14]. En revanche, notre résultat est différent de ceux rapportés dans d’autres études où le Pseudomonas aeruginosa vient en deuxième position [17,18]. Le Pseudomonas aeruginosa est connu comme responsable des infections nosocomiales. Une différence n’a pas été retrouvée entre les pneumopathies communautaires et nosocomiales par Guclu et al. [19]. Parmi les antibiotiques testés, amoxicilline – acide clavulanique, les céphalosporines et le sulfaméthoxazole-triméthoprime avaient la résistance la plus élevée tandis que les aminosides (amikacine, gentamicine), les carbapénèmes et la lincomycine étaient les plus efficaces. Nos résultats sont similaires à ceux rapportés par Arab et al. en Syrie [20]. Kalgo et al. avaient trouvé une forte résistance à presque tous les bêta-lactamines testés au Nigeria [21]. Ces résultats s’expliquent par l’émergence des bactéries résistantes aux antibiotiques en Afrique de l’Ouest notamment les bactéries productrices de bêta-lactamases à spectre élargi [6]. L’utilisation du sulfaméthoxazole-triméthoprime dans la prophylaxie des infections opportunistes chez les sujets infectés par le VIH pourrait expliquer sa résistance dans notre étude.
Klebsiella pneumoniae était résistant à l’amoxicilline – acide clavulanique, aux céphalosporines de troisième génération (ceftriaxone, ceftazidime, céfotaxime et cefepime) mais sensible à la pipéracilline tazobactam, aux carbapénèmes et à la lévofloxacine. Notre résultat est plus ou moins similaire à celui de Gebre et al. en Ethiopie [11].
Escherichia coli était résistant à l’amoxicilline – acide clavulanique, aux céphalosporines de troisième génération (ceftriaxone, ceftazidime, céfotaxime et céfépime), aux quinolones (ciprofloxacine, lévofloxacine et ofloxacine) mais sensible à la pipéracilline-tazobactam, aux carbapénèmes et aux phénicolés. Notre résultat est différent de celui de Usman et al. qui notaient une bonne sensibilité aux quinolones [22]. Les cocci Gram positif étaient résistants à tous les antibiotiques testés en dehors des aminosides (gentamicine, amikacine) et la lincomycine. Une forte sensibilité avait été rapportée par Vaish et al. [23].
CONCLUSION
Ce travail confirme la tendance à l’augmentation des résistances bactériennes aux antibiotiques. Les carbapénèmes, s’ils représentent bien une alternative en seconde intention, posent le problème de coût dans notre contexte.
REFERENCE
| 1. G113:G125Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet 2022;399:629‑55. |
| 2. Efalou P, Adjoh KS, Adambounou TAS, Wateba IM, Aziagbe KA, Boukari M, et al. Profil des patients décédés d’affections respiratoires non tuberculeuses dans le service de pneumo-phtisiologie du CHU Sylvanus Olympio. Rev Pneumol Trop 2017;28:3‑9. |
| 3. National Clinical Guideline Centre (UK). Pneumonia: Diagnosis and Management of Community- and Hospital-Acquired Pneumonia in Adults [Internet]. London: National Institute for Health and Care Excellence (UK); 2014 [cité 2023 oct 7]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK263426/ |
| 4. Metlay JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am. J. Respir. Crit. Care Med. 2019;200:e45‑67. |
| 5. Chidiac C. Antibiothérapie par voie générale dans les infections respiratoires basses de l’adulte. Pneumonie aiguë communautaire. Exacerbations de bronchopneumopathie chronique obstructive. Médecine Mal. Infect. 2011;41:221‑8. |
| 6. Ouedraogo AS, Pierre HJ, Banuls AL, Ouédraogo R, Godreuil S. Émergence et diffusion de la résistance aux antibiotiques en Afrique de l’Ouest: Facteurs favorisants et évaluation de la menace. Médecine Santé Trop. 2017;27:147‑54. |
| 7. Dagnra AY, Awesso B, Prince-David M, Tidjani O. Nature et sensibilité aux antibiotiques des bactéries isolées des pleurésies purulentes à Lomé (Togo). Médecine Mal. Infect. 2003;33:327‑30. |
| 8. Carter MW, Oakton KJ, Warner M, Livermore DM. Detection of Extended-Spectrum β-Lactamases in Klebsiellae with the Oxoid Combination Disk Method. J. Clin. Microbiol. 2000;38:4228‑32. |
| 9. El-Sokkary RH, Ramadan RA, El-Shabrawy M, El-Korashi LA, Elhawary A, Embarak S, et al. Community acquired pneumonia among adult patients at an Egyptian university hospital: bacterial etiology, susceptibility profile and evaluation of the response to initial empiric antibiotic therapy. Infect. Drug Resist. 2018;2141‑50. |
| 10. Siddalingappa CM, Kalpana L, Puli S, Vasudha TK, Acharya A. Sensitivity pattern of bacteria causing respiratory tract infections in a tertiary care centre. Int J Basic Clin Pharmacol 2013;2:590‑5. |
| 11. Gebre AB, Begashaw TA, Ormago MD. Bacterial profile and drug susceptibility among adult patients with community acquired lower respiratory tract infection at tertiary hospital, Southern Ethiopia. BMC Infect. Dis. 2021;21:440. |
| 12. Amarasinghe N, Athavan M, Jayamanne D, Rajapakshe Y, Sadikeen A, Gunasekara K, et al. Bacterial profile and antibiotic susceptibility pattern of adult lower respiratory tract infections in Colombo, Sri Lanka. J Health Soc Sci 2018;3:27‑36. |
| 13. Tchatchouang S, Nzouankeu A, Kenmoe S, Ngando L, Penlap V, Fonkoua MC, et al. Bacterial aetiologies of lower respiratory tract infections among adults in Yaoundé, Cameroon. BioMed Res. Int. 2019;2019. |
| 14. Khan S, Priti S, Ankit S. Bacteria etiological agents causing lower respiratory tract infections and their resistance patterns. Iran. Biomed. J. 2015;19:240. |
| 15. Iregbu KC. Antibiogram of bacterial agents of lower respiratory tract infections in a central Nigerian hospital. Niger. J. Med. 2018;27:29‑34. |
| 16. Cullen L, McClean S. Bacterial adaptation during chronic respiratory infections. Pathogens 2015;4:66‑89. |
| 17. Santella B, Serretiello E, De Filippis A, Folliero V, Iervolino D, Dell’Annunziata F, et al. Lower respiratory tract pathogens and their antimicrobial susceptibility pattern: a 5-year study. Antibiotics 2021;10:851. |
| 18.Regha I, Sulekha B. Bacteriological profile and antibiotic susceptibility patterns of lower respiratory tract infections in a tertiary care hospital, Central Kerala. Int J Med Microbiol Trop Dis 2018;4:186‑90. |
| 19. Guclu AU, Kocak AA, Ok MA, Tutluoglu B, Basustaoglu AC, Group RS. Antibacterial resistance in lower respiratory tract bacterial pathogens: A multicenter analysis from turkey. J. Infect. Dev. Ctries. 2021;15:254‑62. |
| 20. Arab O, Al-Kayali R, Khouri A, Kaddour SH. Zaharaddin. Ann. Med. Surg. 2023;85:2655. |
| 21. Kalgo ZM, Amin BM, Muhammed B. Survey of Multidrug Resistanct Bacteria in Patients with Lower Respiratory Tract Infection Attending Some Hospitals in Kebbi State, Nigeria. Asian J Res Infect Dis 2023;13:21‑9. |
| 22. Usman AD, Amina M. Isolation and identification of Bacteria Associated with Lower respiratory tract infection among patients attending General Hospital Katsina. UMYU J. Microbiol. Res. UJMR 2017;2:97‑101. |
| 23. Vaish R. Antibiotic susceptibility of bacterial strains and bacteriological profile from patients with lower respiratory tract infections in a teaching hospital. |
TABLE - FIGURES
REFERENCE
| 1. G113:G125Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet 2022;399:629‑55. |
| 2. Efalou P, Adjoh KS, Adambounou TAS, Wateba IM, Aziagbe KA, Boukari M, et al. Profil des patients décédés d’affections respiratoires non tuberculeuses dans le service de pneumo-phtisiologie du CHU Sylvanus Olympio. Rev Pneumol Trop 2017;28:3‑9. |
| 3. National Clinical Guideline Centre (UK). Pneumonia: Diagnosis and Management of Community- and Hospital-Acquired Pneumonia in Adults [Internet]. London: National Institute for Health and Care Excellence (UK); 2014 [cité 2023 oct 7]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK263426/ |
| 4. Metlay JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am. J. Respir. Crit. Care Med. 2019;200:e45‑67. |
| 5. Chidiac C. Antibiothérapie par voie générale dans les infections respiratoires basses de l’adulte. Pneumonie aiguë communautaire. Exacerbations de bronchopneumopathie chronique obstructive. Médecine Mal. Infect. 2011;41:221‑8. |
| 6. Ouedraogo AS, Pierre HJ, Banuls AL, Ouédraogo R, Godreuil S. Émergence et diffusion de la résistance aux antibiotiques en Afrique de l’Ouest: Facteurs favorisants et évaluation de la menace. Médecine Santé Trop. 2017;27:147‑54. |
| 7. Dagnra AY, Awesso B, Prince-David M, Tidjani O. Nature et sensibilité aux antibiotiques des bactéries isolées des pleurésies purulentes à Lomé (Togo). Médecine Mal. Infect. 2003;33:327‑30. |
| 8. Carter MW, Oakton KJ, Warner M, Livermore DM. Detection of Extended-Spectrum β-Lactamases in Klebsiellae with the Oxoid Combination Disk Method. J. Clin. Microbiol. 2000;38:4228‑32. |
| 9. El-Sokkary RH, Ramadan RA, El-Shabrawy M, El-Korashi LA, Elhawary A, Embarak S, et al. Community acquired pneumonia among adult patients at an Egyptian university hospital: bacterial etiology, susceptibility profile and evaluation of the response to initial empiric antibiotic therapy. Infect. Drug Resist. 2018;2141‑50. |
| 10. Siddalingappa CM, Kalpana L, Puli S, Vasudha TK, Acharya A. Sensitivity pattern of bacteria causing respiratory tract infections in a tertiary care centre. Int J Basic Clin Pharmacol 2013;2:590‑5. |
| 11. Gebre AB, Begashaw TA, Ormago MD. Bacterial profile and drug susceptibility among adult patients with community acquired lower respiratory tract infection at tertiary hospital, Southern Ethiopia. BMC Infect. Dis. 2021;21:440. |
| 12. Amarasinghe N, Athavan M, Jayamanne D, Rajapakshe Y, Sadikeen A, Gunasekara K, et al. Bacterial profile and antibiotic susceptibility pattern of adult lower respiratory tract infections in Colombo, Sri Lanka. J Health Soc Sci 2018;3:27‑36. |
| 13. Tchatchouang S, Nzouankeu A, Kenmoe S, Ngando L, Penlap V, Fonkoua MC, et al. Bacterial aetiologies of lower respiratory tract infections among adults in Yaoundé, Cameroon. BioMed Res. Int. 2019;2019. |
| 14. Khan S, Priti S, Ankit S. Bacteria etiological agents causing lower respiratory tract infections and their resistance patterns. Iran. Biomed. J. 2015;19:240. |
| 15. Iregbu KC. Antibiogram of bacterial agents of lower respiratory tract infections in a central Nigerian hospital. Niger. J. Med. 2018;27:29‑34. |
| 16. Cullen L, McClean S. Bacterial adaptation during chronic respiratory infections. Pathogens 2015;4:66‑89. |
| 17. Santella B, Serretiello E, De Filippis A, Folliero V, Iervolino D, Dell’Annunziata F, et al. Lower respiratory tract pathogens and their antimicrobial susceptibility pattern: a 5-year study. Antibiotics 2021;10:851. |
| 18.Regha I, Sulekha B. Bacteriological profile and antibiotic susceptibility patterns of lower respiratory tract infections in a tertiary care hospital, Central Kerala. Int J Med Microbiol Trop Dis 2018;4:186‑90. |
| 19. Guclu AU, Kocak AA, Ok MA, Tutluoglu B, Basustaoglu AC, Group RS. Antibacterial resistance in lower respiratory tract bacterial pathogens: A multicenter analysis from turkey. J. Infect. Dev. Ctries. 2021;15:254‑62. |
| 20. Arab O, Al-Kayali R, Khouri A, Kaddour SH. Zaharaddin. Ann. Med. Surg. 2023;85:2655. |
| 21. Kalgo ZM, Amin BM, Muhammed B. Survey of Multidrug Resistanct Bacteria in Patients with Lower Respiratory Tract Infection Attending Some Hospitals in Kebbi State, Nigeria. Asian J Res Infect Dis 2023;13:21‑9. |
| 22. Usman AD, Amina M. Isolation and identification of Bacteria Associated with Lower respiratory tract infection among patients attending General Hospital Katsina. UMYU J. Microbiol. Res. UJMR 2017;2:97‑101. |
| 23. Vaish R. Antibiotic susceptibility of bacterial strains and bacteriological profile from patients with lower respiratory tract infections in a teaching hospital. |
ARTICLE INFO DOI: 10.12699/jfvpulm.15.46.2024.38
Conflict of Interest
Non
Date of manuscript receiving
19/03/2024
Date of publication after correction
26/06/2024
Article citation
Zoutené, D.M. Biaou, A.M. Godonou, T.N.V. Gateu, A.M.E. Ako, K.A. Aziagbe, Y.A. Dagnra, K.S. Adjoh. Antibiotic resistance profile of bacteria isolated during lower respiratory infections in Lomé. J Func Vent Pulm 2024;46(15):38-42