
 English
English
 French
French
Post-infectious fibrothorax revealed by vascular complications
Fibrothorax post-infectieux révélé par des complications vasculaires
Ouattara K 1,2, Soumaré D 1,2, Kanouté T 1,2, Diallo B 3, Dicko A 1,3, Traore M 4, Kone S 2, Sanogo FB 2, Baya B 2, Coulibaly Y 1,3, Toloba Y 1,2
1 Université des Sciences, des Techniques et des Technologies de Bamako
2 Service de pneumologie, Centre Hospitalier Universitaire Point G
3 Service de réanimation, Centre Hospitalier Universitaire Point G
4 Service de radiologie, Centre Hospitalier Universitaire Point G
Corresponding author:
Khadidia OUATTARA . Bamako, Mali.
Mail: zankhadi@gmail.com
ABSTRACT
Post-infectious fibrothorax occurs after a strong inflammatory response of the pleura to germs. It often happens when the patient doesn't receive timely and effective treatment. Extensive pleural thickening with calcifications suggests a tuberculous cause in our epidemiological context, especially when there is no evidence of chronic asbestos exposure.
We present the case of a 50-year-old woman who has been experiencing exertional fatigue and recurrent cough since childhood. She recently had two weeks of worsened shortness of breath, lower limb swelling, and fever. Initially, she was treated for infectious bronchitis, but further investigations revealed bilateral pleural calcification causing thoracic deformities, as well as pulmonary volume restriction and vascular complications. Despite treatment, a thromboembolic event led to a fatal outcome. This case underscores the importance of early management of infectious pleural damage, screening for thoracic deformities, and thromboembolic events to prevent fatal outcomes.
KEYWORDS: Fibrothorax, infection, tuberculosis, thromboembolic event
RÉSUMÉ
Le fibrothorax post infectieux survient à la suite d’une réponse inflammatoire intense de la plèvre aux germes, survenant volontiers en absence de prise en charge précoce et adaptée. La présence de pachypleurite étendue associée à des calcifications en l’absence d’exposition à l’amiante sont en faveur d’une étiologie tuberculeuse dans notre contexte.
Nous rapportons le cas d’une patiente de 50 ans ayant une notion de fatigabilité à l’effort et de toux récurrente depuis l’enfance. Elle présentait depuis deux semaines une exacerbation de la dyspnée avec œdème des membres inférieurs évoluant dans un contexte fébrile traitée comme surinfection bronchique. Les explorations objectivaient une calcification pleurale bilatérale avec déformation thoracique, restriction de volume pulmonaire et des complications vasculaires. Malgré l’initiation de thérapeutiques, l’issue a été fatale suite à un évènement thromboembolique (ETE). Ce cas met en évidence l’importance de la prise en charge précoce des atteintes pleurales infectieuses, du dépistage des déformations thoraciques et de celui des ETE pour une moindre morbi-mortalité.
MOTS CLÉS: fibrothorax, infection, tuberculose, ETE
INTRODUCTION
Le fibrothorax est une complication rare et sévère d’une inflammation pleurale intense le plus souvent d’origine infectieuse, immunologique ou néoplasique. Les causes les plus fréquentes sont l’hémothorax, l’empyème, la tuberculose, et le mésothéliome entres autres [1]. Le fibrothorax se caractérise par un processus fibrosant dense et étendue des feuillets pleuraux responsable de leur fusion. Il en résulte une rétraction de l’hémithorax atteint, avec perte de volume pulmonaire et trouble ventilatoire dont l’importance est corrélée à celle de la fibrose [2]. Une pleurésie passée inaperçue peut évoluer vers une pachypleurite avec calcification pleurale dont la découverte peut être fortuite devant la survenue de complications et ou la réalisation d’un examen d’imagerie chez un sujet asymptomatique [1, 2]. Aucun aspect à l’imagerie n’est pathognomonique d’une étiologie particulière, le diagnostic de certitude repose sur un faisceau d’argument et la biopsie pleurale par thoracoscopie. Les patients atteints peuvent avoir des troubles respiratoires avec une altération de leur qualité de vie. D’où l’importance d’une prévention par prise en charge précoce et adéquate des pleurésies infectieuses associant anti-infectieux, drainage et kinésithérapie. Le traitement curatif repose sur la décortication dont les indications sont sélectives et les résultats mitigés [2, 3].
Observation clinique
Il s’agit d’une patiente de 50 ans ménagère avec une histoire de maladie pulmonaire dans l’enfance non documentée au décours de laquelle survint de façon récurrente des épisodes de toux sèche et une fatigabilité à l’effort d’aggravation progressive. Elle a reçu une antibiothérapie à base d’amoxicilline pour toux sèche, et dyspnée au moindre d’effort avec orthopnée évoluant depuis 2 semaines dans un contexte d’anorexie et fièvre vespéro-nocturne sans frissons.
La patiente a été vue en consultation à J5 de cette antibiothérapie, l’examen physique objectivait une température à 37,5°C une fréquence respiratoire (FR) à 38 cycles/min, une saturation pulsée en oxygène (SpO2) à 70% à l’air ambiant, un pouls à 109 pulsations /min, une pression artérielle à 137/93 mm Hg, un indice de masse corporelle (IMC) à 17,5 kg/m2, une pâleur des conjonctives, et une absence de cyanose.
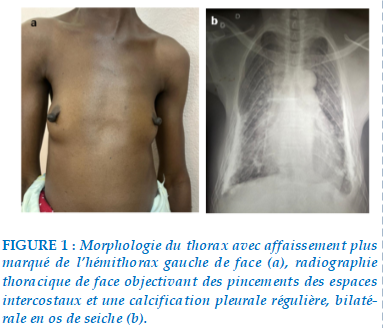
A l’examen pleuropulmonaire le thorax était déformé avec une lordose et un affaissement antérosupérieur de l’hémithorax gauche (Figure 1a ). Il n’y avait pas de tirages intercostaux mais une diminution de l’ampliation thoracique associée à un syndrome d’épanchement pleural liquidien bilatérale dont la ponction était blanche.
L’examen cardiovasculaire avait objectivé une turgescence spontanée des jugulaires et un reflux hépato-jugulaire, des œdèmes des membres inférieurs gardant le godet et remontant aux cuisses, des bruits du cœur réguliers. L’abdomen est légèrement étalé avec une infiltration cutanée marquée par un sillon dépressif cutané correspondant à la marque de son pagne, et un discret déplissement de l’ombilic. L’abdomen était souple avec une hépatomégalie à bord mousse avec la flèche hépatique mesurant 14cm. L’examen des autres appareils et systèmes était sans particularité.
A l’examen biologique, le taux d’hémoglobine était à 8,7 g/dl avec les polynucléaire neutrophiles à 1,9 103 /mm3, les plaquettes à 410 103/mm3, la créatininémie à 0,5mg/dl, le Na à 135meq/ml, le K+ à 4meq/l et la VS à 09 et 37 mm respectivement à la 1er et 2ème heure.
L’échographie pleuropulmonaire avait objectivé une absence du glissement pleurale dans les quadrants latéro-basals, et postéro-basals, une ligne pleurale irrégulière aux quadrants antérieurs, associée à des lignes B dans les quadrants antérosupérieurs.
Les valeurs spirométriques étaient VEMS/CVF 0,60 ; une CVF 2,04 (73%), un VEMS 1,23 (55%), un DEP 115L/s (19%) et un DEMM-25/75 0,79 (29%) correspondant à un Déficit Ventilatoire Mixte modérée avec test de réversibilité rapide non significatif.
La radiographie thoracique de face avait objectivé un pincement des espaces intercostaux avec des plaques pleurales sous forme d’opacités denses verticales, bilatérales plus marquées à gauche associées à des opacités parenchymateuses nodulaires denses et une cardiomégalie (ICT= 0,64) (Figure 1b).
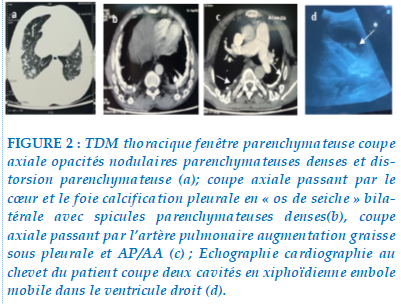
La tomodensitométrie (TDM) thoracique avait objectivé un épaississement réticulaire des septas, un aspect d’œil vasculaire des vaisseaux parenchymateux, un épaississement avec calcification bilatérale des feuillets pleuraux sans épanchement. Il s’y associait une cardiomégalie, une dilatation des cavités cardiaques gauches et des signes d’HTAP sans embolie pulmonaire (Figure 2a-2c).
Elle a bénéficié en ambulatoire d’un traitement per os à base de furosémide à la dose de 20mgx2/jr et d’acénocoumarol à la dose de 4mg/j. Elle est revenue à l’hôpital 48h plus tard dans un tableau d’altération de la conscience motivant son transfert en réanimation. Les explorations objectivaient une hyponatrémie 109mmol/l, et la présence d’un embole mobile dans le ventricule droit à l’échocardiographie au lit du malade (Figure 2d). Elle a bénéficié d’une anticoagulation curative, une oxygénothérapie et la correction des troubles ioniques. L’évolution initiale était marquée par une reprise de la conscience en 24-48h. Le décès par arrêt cardiorespiratoire est survenu à 72h d’hospitalisation au décours d’une bradycardie ne répondant pas aux mesures de réanimation usuelles.
DISCUSSION
La survenue de fibrothorax est généralement secondaire à une inflammation sévère de la plèvre. Sa découverte chez un sujet de la 5ème décade doit motiver
une enquête étiologique minutieuse. Les étiologies pouvant être évoquées devant une calcification pleurale diffuse et bilatérale sont entre autres l’hémothorax, le mésothéliome malin, la fibro-hyalinose pleurale, le lymphome pleural, les métastases pleurales, et la tuberculose pleurale primaire ou post primaire [1,2,4]
Chez la patient l’hypothèse d’hémothorax était peu probable car aucune notion de traumatise récent ou ancien n’a été retrouvé. De plus l’imagerie n’a pas objectivé de cal osseux au niveau des côtes. Concernant le mésothéliome, il est secondaire à l’exposition à l’amiante dans plus de la moitié des cas et survient volontiers chez les sujets masculins de plus de 50 ans [1]. Notre patiente en dépit de l’âge favorable n’a pas de notion d’exposition professionnelle à l’amiante. Elle a vécu essentiellement en milieu rural et présente une atteinte bilatérale. Sachant que durant le mésothéliome l’atteinte est volontiers unilatérale et douloureuse peu dyspnéique associant épanchement et plèvre irrégulière multi-lobulée [5]. La fibro-hyalinose, autre pathologie liée a l’inhalation de fibre d’amiante, dont l’aspect est similaire de la classique os de seiche des séquelles tuberculeuses. Elle se caractérise par une fibrose hyaline de la plèvre qui se calcifie secondairement et l’atteinte peut être uni ou bilatérale [4]. Les différents arguments épidémio-cliniques recueillis nous permettent d’écarter toute origine liée a une exposition a l’amiante.
Les métastases ont été écartées devant l’absence de foyer primitif expressif, d‘épanchement pleural liquidien actif, et surtout la déformation thoracique associée à la restriction qui témoigne de séquelle d’un processus bénin chronique [1,5,6]. La patiente à rapporter une notion d’infection sévère dans l’enfance prise en charge traditionnellement au décours de laquelle elle aurait développé une fatigabilité à l’effort et dont l’évolution est émaillée d’épisode récurent de toux. Ces antécédents et la présence d’hypertension artérielle pulmonaire témoignent d’un processus infectieux ancien avec répercussion chronique survenant dans zone à ressources limitées et endémique pour la tuberculose. Il est reconnu que plèvre est le site le plus concerné par la tuberculose (TB) après l’atteinte parenchymateuse tant à l’échelle globale qu’au niveau national [7,8]. Il peut s’agir d’un exsudat lymphocytaire volontiers unilatéral, ou d’un véritable empyème chronique évoluant vers l’épaississement et la calcification des feuillets pleuraux [2, 7]. Dans les cas extrêmes il y a fusion des feuillets pleuraux avec déformation thoracique et restriction sévère comme dans notre présent cas clinique [1,2,6,7]. Plusieurs cas de fibrothorax secondaire à une tuberculose ont été décrits dans la littérature. Ils peuvent être unilatéraux ou bilatéraux, atteignant les sujets sans distinction de sexe ou d’âge et résidants dans des zones d’endémie tuberculeuse [9,10]. De plus le fibrothorax post-tuberculeux est caractérisé à la TDM par une pachypleurite verticale régulière et étendue épargnant la plèvre médiastinale avec adhésion des feuillets pleuraux. Il s’y associe une calcification, et une augmentation de la graisse sous pleurale comme retrouvée chez la patiente [1,2,6]. Quelques cas de TB active initiée par une calcification pleurale avec pleurésie sans déformation thoracique notable ont été décrit dans la littérature [9,10]. L’atteinte bilatérale bien que rarement décrite n’est pas une exception pouvant expliquer les séquelles restrictives importante en absence de prise en charge adéquate [6,10]. Des pachypleurites majoritairement post infectieuses, associant trouble ventilatoire restrictif plus fréquemment léger sans signe de calcification notable ont été décrite au Togo. Cet épaississement pleural survenait au décours d’épanchement pleuraux dans plus de 60% et les symptômes évoluaient en moyenne depuis 9,19± 8,9 semaines [11]. L’absence de calcification peu s’explique par le délai d’évolution plus court et la part importante d’atteinte non tuberculeuse. Devant les arguments épidémiologiques, cliniques et tomodensitométriques nous retenons par élimination le diagnostic de fibrothorax post post infectieux probablement tuberculeux. Quel que soit l’étiologie du fibrothorax, l’hémithorax concerné peut être le siège d’une perte de volume avec trouble ventilatoire [6]. Selon l’im portance de ce dernier, s’installe une dyspnée d’effort d’aggravation progressive, avec à long terme la survenue de complications vasculaire comme l’hypertension pulmonaire (HTP) et le cœur pulmonaire chronique (CPC) [12]. Notre patiente présentait des signes cliniques d’hyperpression cardiaque droite, des signes d’HTAp à l’angioTDM thoracique qui avait écarté une embolie pulmonaire. De plus la spirométrie avait objectivé un profil restrictif modéré sachant qu’une CVF inférieure à 80% serait significativement plus associée à une PAPS élevée et à un risque d’hospitalisation pour décompensation cardiaque [12]. La visualisation de caillot mobile dans le ventricule droit quelques jours plus tard est fortement évocateur de migration d’un thrombus provenant des membres inférieurs [13, 14]. D’où l’importante de coupler à la TDM un doppler cardiaque et ou des membres inférieurs afin de traquer un évènement thromboembolique devant tout déficit ventilatoire restrictif associé à une HTP. La survenue du décès au décours d’une bradycardie pourrait s’expliquer par la migration du caillot du ventricule droit vers les artères pulmonaires réalisant ainsi un tableau d’embolie pulmonaire aigu malgré un traitement curatif en cours [13, 14]. La prise en charge du fibrothorax est chirurgicale avec un impact positif notable sur les troubles ventilatoires et la morphologie thoracique
quand elle est précoce et possible [3]. La présence de calcifications parenchymateuses et l’ancienneté de l’évènement initiateur qui présage des dommages irréversibles, chez notre patiente ne semblait pas en faire une bonne candidate pour cette procédure [2, 3]. Pour éviter une morbi mortalité par fibrothorax post-infectieux la meilleure des stratégies demeure la prévention.
Conclusion
Le fibrothorax post-infectieux est une pathologie rare mais grave, qui reflète l’évolution naturelle de nombreuses maladies pleurales mal contrôlées. Au-delà des implications médicales, les répercussions sur la qualité de vie des patients sont significatives. Un diagnostic précoce et une prise en charge adaptée des infections pleurales sont impératifs pour prévenir les séquelles chroniques et les complications fatales. Ce cas met en lumière l’importance du dépistage des anomalies thoraciques et des événements thromboemboliques, ainsi que la nécessité d’une prise en charge multidisciplinaire précoce.
REFERENCES
1. Hussein Jelen T, Bankier AA, Eisenberg RL. Solid Pleural Lesions. AJR 2012 ;198 (6) :512-20.
2. Huggins JT and Sahn SA.Causes and management of pleural fibrosis. Respirology 2004 ; 9 : 441–447.
3. Chen B, Zhang J, Ye Z, Ye M, Ma D, Wang C, et al. Outcomes of video-assisted thoracic surgical decortications in 274 patients with tuberculous empyema. Ann Thorac Cardiovasc Surg 2015;21:223–8.
4. .P. Grignet. Les pathologies respiratoires liées à l’inhalation de fibre d’amiante. J Func Vent Pulm 2011; 02(3): 1-78.
5. Wang ZJ, Reddy GP, Gotway MB, Higgins CB, Jablons DM, Ramaswamy M, et al. Malignant pleural mesothelioma: evaluation with CT, MR imaging, and PET. Radio Graphics 2004;24(1):105-19.
6. Choi JA, Hong KT, Oh YW, Chung MH, Seol HY, Kang EY. CT Manifestations of Late Sequelae in Patients with Tuberculous Pleuritis. AJR 2001;176:441–445 .
7. Vorster MJ, Allwood BW, Diacon AH, Koegelenberg CFN. Tuberculous pleural effusions: advances and controversies. J Thorac Dis 2015;7(6):981-991.
8. Ministère de la sante république du Mali et du développement social. Rapport annuel 2021 de la cellule sectorielle de lutte contre le VIH/sida, la tuberculose et les Hépatites virales. MSDS 2021; 7-62. https://files.aho.afro.who.int/afahobckpcontainer/production/files/RAPPORT_ANNUEL_2021_CSLS-TBH_VF.pdf.
9. Sahana G, Acharya V, Rai S, Bala N. A Rare Case of Primary Calcific Pleural Tuberculosis – A Case Report. Journal of Clinical and Diagnostic Research. 2017;11(7): OD01-OD02.
10. Tie H.T, Zhang M. Bilateral diffuse pleural plaque with calcifications in pleural Tuberculosis. Mediastinum 2018;2 :38.
11. MO. Abasse, AK. Aziagbe, P. Efalou, AG. Gbadamassi, TAS. Adambounou, KS. Adjoh. Aspects épidémiologique et clinique des pachypleurites: A propos de 102 cas colligés au Service de Pneumo-Phtisiologie du CHU Sylvanus Olympio. J Func Vent Pulm 2018; 27(9): 1-50.
12. Jankowich M, Elston B, Liu Q, Abbasi S, Wu WC, Blackshear C, Godfrey M, and Choudhary G. Restrictive Spirometry Pattern, Cardiac Structure and Function, and Incident Heart Failure in African Americans. Ann Am Thorac Soc 2018; 15(10):1186–1196.
13. Lai E, Alishetti S, Wong JM, Delic L, Egrie G, Rosenblatt A. Right Ventricular Thrombus in Transit: Raising the Stakes in the Management of Pulmonary Embolism. CASE: Cardiovascular Imaging Case Reports 2019; 3(6); 272-276.
14. Ruiz-Bailen M, Lopez-Caler C, Castillo-Rivera A, et al. Giant right atrial thrombi treated with thrombolysis. Can J Cardiol 2008;24(4):312-4.
FIGURES - TABLES
REFERENCES
1. Hussein Jelen T, Bankier AA, Eisenberg RL. Solid Pleural Lesions. AJR 2012 ;198 (6) :512-20.
2. Huggins JT and Sahn SA.Causes and management of pleural fibrosis. Respirology 2004 ; 9 : 441–447.
3. Chen B, Zhang J, Ye Z, Ye M, Ma D, Wang C, et al. Outcomes of video-assisted thoracic surgical decortications in 274 patients with tuberculous empyema. Ann Thorac Cardiovasc Surg 2015;21:223–8.
4. .P. Grignet. Les pathologies respiratoires liées à l’inhalation de fibre d’amiante. J Func Vent Pulm 2011; 02(3): 1-78.
5. Wang ZJ, Reddy GP, Gotway MB, Higgins CB, Jablons DM, Ramaswamy M, et al. Malignant pleural mesothelioma: evaluation with CT, MR imaging, and PET. Radio Graphics 2004;24(1):105-19.
6. Choi JA, Hong KT, Oh YW, Chung MH, Seol HY, Kang EY. CT Manifestations of Late Sequelae in Patients with Tuberculous Pleuritis. AJR 2001;176:441–445 .
7. Vorster MJ, Allwood BW, Diacon AH, Koegelenberg CFN. Tuberculous pleural effusions: advances and controversies. J Thorac Dis 2015;7(6):981-991.
8. Ministère de la sante république du Mali et du développement social. Rapport annuel 2021 de la cellule sectorielle de lutte contre le VIH/sida, la tuberculose et les Hépatites virales. MSDS 2021; 7-62. https://files.aho.afro.who.int/afahobckpcontainer/production/files/RAPPORT_ANNUEL_2021_CSLS-TBH_VF.pdf.
9. Sahana G, Acharya V, Rai S, Bala N. A Rare Case of Primary Calcific Pleural Tuberculosis – A Case Report. Journal of Clinical and Diagnostic Research. 2017;11(7): OD01-OD02.
10. Tie H.T, Zhang M. Bilateral diffuse pleural plaque with calcifications in pleural Tuberculosis. Mediastinum 2018;2 :38.
11. MO. Abasse, AK. Aziagbe, P. Efalou, AG. Gbadamassi, TAS. Adambounou, KS. Adjoh. Aspects épidémiologique et clinique des pachypleurites: A propos de 102 cas colligés au Service de Pneumo-Phtisiologie du CHU Sylvanus Olympio. J Func Vent Pulm 2018; 27(9): 1-50.
12. Jankowich M, Elston B, Liu Q, Abbasi S, Wu WC, Blackshear C, Godfrey M, and Choudhary G. Restrictive Spirometry Pattern, Cardiac Structure and Function, and Incident Heart Failure in African Americans. Ann Am Thorac Soc 2018; 15(10):1186–1196.
13. Lai E, Alishetti S, Wong JM, Delic L, Egrie G, Rosenblatt A. Right Ventricular Thrombus in Transit: Raising the Stakes in the Management of Pulmonary Embolism. CASE: Cardiovascular Imaging Case Reports 2019; 3(6); 272-276.
14. Ruiz-Bailen M, Lopez-Caler C, Castillo-Rivera A, et al. Giant right atrial thrombi treated with thrombolysis. Can J Cardiol 2008;24(4):312-4.
ARTICLE INFO DOI: 10.12699/jfvpulm.16.49.2025.48
Conflict of Interest
Non
Date of manuscript receiving
10/03/2025
Date of publication after correction
20/06/2025
Article citation
Ouattara K , Soumaré D , Kanouté T, Diallo B, Dicko A, Traore M, Kone S, Sanogo FB, Baya B, Coulibaly Y, Toloba Y. Post-infectious fibrothorax revealed by vascular complications. J Func Vent Pulm 2025;49(16):19-22