
 English
English
 French
French
Concomitant discovery of pulmonary tuberculosis and bronchopulmonary cancer in two patients with no carcinogenic risk factors
Découverte concomitante d’une tuberculose pulmonaire et d’un cancer broncho-pulmonaire chez deux patients sans facteur de risque cancérigène
Halidou Moussa S1, Gagara Issoufou MA1, 5, Cheikh Aboubacar AL2, Hamidou I3, Assoumana Issaka A1, Maizoumbou D1, Ouédraogo M4
1: Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey(NIGER)
2: Programme National de lutte contre la tuberculose (NIGER)
3 : Université André Salifou de Zinder (NIGER)
4: Service de Pneumologie, Centre Hospitalier Universitaire Yalgado OUEDRAOGO. Ouagadougou (BURKINA-FASO)
5. Université Abdou Moumouni de Niamey (NIGER)
Corresponding author: HALIDOU MOUSSA Souleymane . Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey(NIGER), BP 10146 .
Mail: hmsouley14@gmail.com
ABSTRACT
Introduction: The relationship between bronchopulmonary cancer and tuberculosis is complex. The simultaneous association of these two pathologies in the same patient with no carcinogenic factor is rare and complicates management and prognosis.
Observation 1: A 44-year-old chauffeur, nonalcoholic and nonsmoker, with no known history of contagious diseases or pathologies, was admitted to hospital with haemoptysis and general deterioration. GeneXpert analysis of bronchoalveolar lavage fluid and histology of bronchial biopsies led to a diagnosis of active pulmonary tuberculosis sensitive to rifampin and associated bronchopulmonary cancer. The patient was started on a fixed-dose regimen of RHZE. He died on the 37th day of anti-tuberculosis treatment, without a course of chemotherapy.
Observation 2. A 46-year-old military patient, nonalcoholic and nonsmoker, with no known history of infection or pathology, was admitted to hospital with haemoptysis, chest pain and general ill-health. GeneXpert analysis of bronchoalveolar lavage fluid and histology of bronchial biopsies led to a diagnosis of active pulmonary tuberculosis sensitive to rifampin and associated bronchopulmonary cancer. The patient was put on fixed-dose RHZE-based anti-tuberculosis treatment and declared cured of his tuberculosis. He began chemotherapy in the 2nd month of anti-tuberculosis treatment, which he abandoned due to side effects (vomiting) and lack of financial resources. He turned to traditional healers and died at home, 11 months after being diagnosed with cancer.
Conclusion: The concomitant association of pulmonary tuberculosis and bronchopulmonary cancer is relatively rare, but has a poor prognosis.
KEYWORDS: Bronchopulmonary cancer, bacteriologically confirmed pulmonary tuberculosis, bronchial fibroscopy, concomitant, Niger.
RÉSUMÉ
Introduction : Les relations entre cancer broncho-pulmonaire et la tuberculose sont complexes. L’association simultanée de ces deux pathologies chez un même patient sans facteur cancérigène est rare et complique la prise en charge et le pronostic.
Observation 1 : Patient de 44 ans, chauffeur, non alcoolo-tabagique, sans notion de contage, ni d’antécédents pathologiques connus, hospitalisé pour une hémoptysie et une altération de l’état général. Le GeneXpert du liquide de lavage broncho-alvéolaire et l’histologie des biopsies bronchiques ont permis de poser le diagnostic d’une tuberculose pulmonaire active sensible à la rifampicine associée à un cancer broncho-pulmonaire. Le patient fut mis sous traitement antituberculeux à base de dose fixe de RHZE. Il était décédé au 37ème jour du traitement antituberculeux, sans cure de chimiothérapie.
Observation 2. Patient de 46 ans, militaire, non alcoolo-tabagique, sans notion de contage, ni d’antécédents pathologiques connus, hospitalisé pour une hémoptysie, des douleurs thoraciques et une altération de l’état général. Le GeneXpert du liquide de lavage broncho-alvéolaire et l’histologie des biopsies bronchiques ont permis de poser le diagnostic d’une tuberculose pulmonaire active sensible à la rifampicine associée à un cancer broncho-pulmonaire. Le patient fut mis sous traitement antituberculeux à base de dose fixe de RHZE et déclaré guéri de la tuberculose .Il débuta une chimiothérapie au 2ème mois du traitement antituberculeux qu’il abandonna à cause des effets indésirables (vomissements) et du manque de moyens financiers. Il se tourna vers les tradipraticiens et mourra à domicile, soit 11 mois après le diagnostic du cancer.
Conclusion : L’association concomitante tuberculose pulmonaire et cancer broncho-pulmonaire est relativement rare, mais de mauvais pronostic.
MOTS CLÉS: Cancer broncho-pulmonaire, tuberculose pulmonaire confirmée bactériologiquement, fibroscopie bronchique, concomitante,Niger.
INTRODUCTION
Le cancer broncho-pulmonaire(CBP) représente un problème majeur de santé publique. Selon GLOBOCAN 2020 ,avec environ 2,2 millions de nouveaux cas et 1,8 million de décès, le cancer du poumon est le deuxième cancer le plus fréquemment diagnostiqué et la principale cause de décès par cancer .Les taux d'incidence et de mortalité sont environ 2 fois plus élevés chez les hommes que chez les femmes, bien que le rapport hommes-femmes varie considérablement d'une région à l'autre, allant de 1,2 en Amérique du Nord à 5,6 en Afrique du Nord. Au Niger, la prévalence sur 5 ans des CBP représentait 0,43% (105 cas) de tous les cancers. Le CBP avec 95 nouveaux cas enregistrés (0,97 %), occupait le 19ème rang de tous les nouveaux cas de cancers et le 16ème rang des décès avec 92 cas [1].
L’Organisation mondiale de la santé (OMS) en 2023 estimait à 10.8 millions le nombre de personnes qui avaient contracté la tuberculose(TB) et à 1.25 millions le nombre de décès dus à la maladie. Elle est l’une des pathologies infectieuses causant le plus de décès dans le monde. En Afrique, l’incidence totale de la TB était estimée à 2.5 millions et la mortalité à 379 000 personnes. Au Niger, en 2023 14223 cas de TB étaient notifiés et la mortalité était estimée à 3400 Personnes [2].
Le CBP et la TB pulmonaire ont une relation complexe. La TB a longtemps été suspectée d’augmenter le risque de CBP tandis que le cancer et ses traitements sont des facteurs susceptibles de favoriser la réactivation d’une tuberculose. L’augmentation des carcinomes pulmonaires chez les patients atteints de tuberculose est liée à l'immunosuppression induite par l'infection. Il a été suggéré que l'inflammation et la fibrose pulmonaire causées par la tuberculose peuvent induire des dommages génétiques, qui augmentent le risque de cancer pulmonaire [3]. Plusieurs auteurs ont rapporté la coexistence simultanée ou séquentielle de la TB pulmonaire et du CBP chez un même patient [4,5].
Nous décrivons 2 cas de découverte simultanée sans facteurs d’exposition cancérigène, colligés au service de pneumologie de l’Hôpital National Amirou Boubacar Diallo(HNABD) de Niamey-Niger.
Observation 1
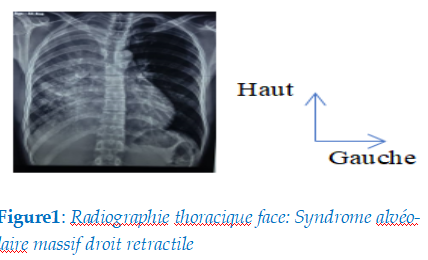
Il s’agissait d’un patient âgé de 44ans, non alcoolo-tabagique, sans notion de contage tuberculeux, chauffeur, hospitalisé pour une toux chronique, une fièvre vespérale, une hémoptysie minime survenant de façon intermittente et une dyspnée d’effort évoluant depuis 3 mois. Il n’avait aucun antécédent pathologique connu et aucun facteur d’exposition. On ne notait pas d’antécédent familial de cancer. Le patient était conscient (Glasgow 15/15) avec un état général altéré (stade 4 PS OMS), dénutri avec un indice de masse corporelle(IMC) à 17Kg/m2, une hyperthermie (T° à 38.7 C), une polypnée (fréquence respiratoire (FR) à 32 cycles/min), une tachycardie à 104 battements par minute, une tension artérielle (TA) à 120/70 mmHg (normale) et une SpO2 à 92% à l’air ambiant. On notait un syndrome de condensation pulmonaire droit. La radiographie thoracique de face mettait en évidence un syndrome alvéolaire massif droit retractile (figure1).
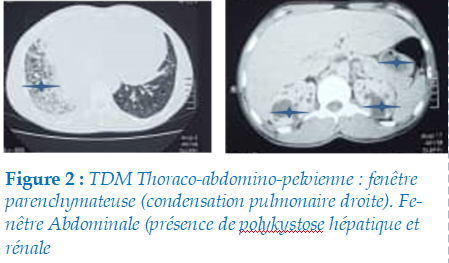
Le GeneXpert des expectorations était négatif. La fibroscopie bronchique réalisée avait objectivée un remaniement chronique des muqueuses avec présence de caséum. Le GeneXpert du liquide de lavage broncho-alvéolaire (LBA) avait identifié le complexe Mycobacterium tuberculosis middle sensible à la rifampicine. La cytologie du LBA avait mis en évidence la présence des cellules tumorales. Des biopsies bronchiques ont été réalisées et envoyées pour l’histologie. Une tomodensitométrie(TDM) thoraco-abdomino-pelvien réalisée pour le bilan d’extension avait objectivé une condensation pulmonaire droite associée à une polykystose hépatique et rénale (figure 2).
Le scanner cérébral était normal ainsi que l’IRM osseuse des membres inférieures. L’urée, la créatininémie, l’uricémie, les transaminases, la glycémie étaient normales. La sérologie VIH était négative. La numération formule sanguine avait objectivé une hyperleucocytose (14 000 blancs) à prédominance granulocytaire (77%).On notait une anémie (10,2g/dl) normocytaire normochrome. La protéine C réactive(CRP) était élevée à 75 mg/l’antigène pour l’hépatite B(AgHbs) et l’anticorps (Ac anti HBC) étaient positifs. L’antigène pour la réplication virale (AgHbe) était négatif.
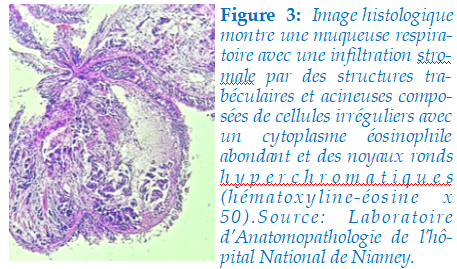
Un traitement antituberculeux a été débuté conformément aux directives nationales par l’association à dose fixe 2RHZE/4RH (2 mois RHZE/4 mois RH) : (Rifampicine (R) 150 mg -Isoniazide(H) 75 mg -Pyrazinamide(Z) 400 mg -Ethambutol(E) 275 mg) en raison de 3cp par jour (poids du patient = 52Kg). Le rendu des résultats de l’histologie des biopsies bronchiques, un mois après le début du traitement antituberculeux, avait mis en évidence un adénocarcinome broncho-pulmonaire d’architecture acinaire (figure 3).
Le diagnostic d’un adénocarcinome broncho-pulmonaire stade 4 associant une tuberculose pulmonaire confirmée bactériologiquement pharmaco-sensible nouveau cas et une hépatite B chronique non réplicatif a été posé. Le patient était décédé une semaine après le rendu des résultats de l’histologie (soit 37 jours après le début du traitement de la tuberculose) dans un tableau de détresse respiratoire. Le patient n’avait pas fait de chimiothérapie.
Observation 2
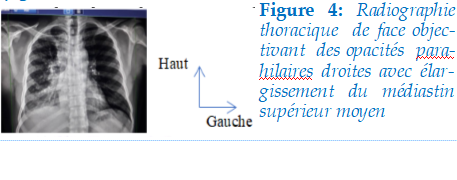
Il s’agissait d’un patient âgé de 46ans, non alcoolo-tabagique, sans notion de contage, militaire (fantassin), reçu pour une hémoptysie minime survenant de façon intermittente, une douleur thoracique droite exacerbée par la toux, sans facteur calmant et irradiant vers le dos. A cela s’associe une dyspnée d’effort, une anorexie, une asthénie, une fièvre vespérale et un amaigrissement non chiffré, le tout évoluant depuis 2 mois. Il n’avait aucun antécédent pathologique connu et aucun facteur d’exposition cancérigène. On ne notait pas d’antécédent familial de cancer. Le patient était conscient (Glasgow 15/15) avec un état général altéré (stade 3 PS OMS), un IMC normal à 23,30Kg/m2, une hyperthermie (T° à 38.5 C), une polypnée (FR à 30), une tachycardie à 105 bpm, une TA à 110/70 mmHg (normale) et une SpO2 à 96% à l’air ambiant. On notait à l’examen physique un syndrome de condensation pulmonaire droit. La radiographie thoracique de face avait objectivé des opacités parahilaires droites avec élargissement du médiastin supérieur moyen (figure4).
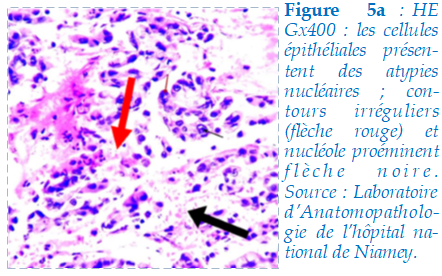
Le GeneXpert des expectorations était négatif. La fibroscopie bronchique réalisée avait objectivée un remaniement bronchique chronique avec muqueuse tapissée de sécrétion purulente. . Le GeneXpert du LBA avait identifié le complexe Mycobacterium tuberculosis very low sensible à la rifampicine. La cytologie du LBA a mis en évidence des cellules tumorales (figure 5a). Des biopsies bronchiques ont été réalisées et envoyées pour histologie.
La numération formule sanguine a objectivé une hyperleucocytose (13 000 blancs) à prédominance neutrophile (74,7%). On notait une anémie légère (11,1g/dl) microcytaire (68,6 fL) hypochrome (30,7g/dl). La CRP était élevée à 72 mg/L’urée, la créatininémie, l’uricémie, les transaminases, la glycémie étaient normales. La sérologie VIH et le l’AgHbs étaient négatives. Un traitement antituberculeux a été débuté conformément aux directives nationales 2RHZE/4RH en raison de 4cp par jour (poids du patient = 64Kg).
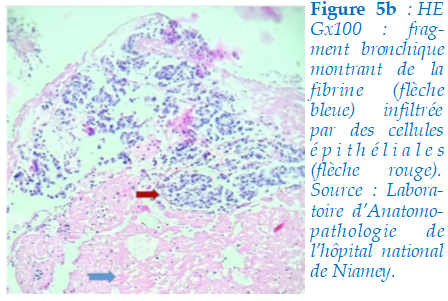
Après quatre semaines de traitement antituberculeux, le rendu de l’histologie était en faveur d’un adénocarcinome moyennement différencié infiltrant le stroma (figure 5b).
Une TDM thoraco-abdomino-pelvien avait été réalisée dans le cadre du bilan d’extension et avait objectivé : syndrome cavitaire du Fowler droit à paroi épaisse de 41X42X28mm associé à de multiples nodules confluents par endroit, à des adénopathies médiatisnales et hilaires droites, un épanchement pleural liquidien droit de faible abondance, des lésions ostéocondensantes punctiformes spondyliennesT7, 78 et T12 (Figure 6). Le patient a été classé T2N3M1
(stade 4).A la fin du 2ème mois du traitement antituberculeux après un contrôle des expectorations négatifs, le patient a débuté une chimiothérapie à base de Cisplatine 86mg et de Doxorubicine 86 mg, une séance chaque quatre semaines. Des effets indésirables (EI) mineurs (vomissements) furent observés. Après quatre cures de chimiothérapie qui correspondaient à la fin du traitement antituberculeux où le patient avait été déclaré guéri pour son traitement de sa tuberculose pulmonaire (contrôle 6ème mois de l’expectoration négatif), le patient nota une amélioration avec amendement des symptômes. Il abandonna le traitement et réapparait trois (3) mois après, avec une toux sèche, une dyspnée avec une SpO2 à 92%.Après une réunion de concertation pluridisciplinaire, une radiothérapie avait été débutée en raison d’une séance chaque jour. Après la 14ème cure de radiothérapie, un nouveau protocole de chimiothérapie avait été instauré : Placlitaxel 250 mg-Carboplatine 450mg.Il a bénéficié de 2 cures. L’évolution fut marquée par l’aggravation de l’état général (Stade 4 PS OMS), de la dyspnée (SpO2 à 90%), la persistance de la toux, et l’aggravation des EI grade 3(Sévères selon l’échelle ANRS) à type de vomissement. Au vue des EI et devant l’incapacité d’onérer l’achat des médicaments pour la chimiothérapie, il abandonna le traitement et se tourna vers les tradipraticiens. Il décéda à domicile, soit 11 mois après le diagnostic de son cancer.
Discussion
Ces cas rapportent l’association concomitante d’une tuberculose active avec un cancer broncho-pulmonaire sans facteur d’exposition. On estime que 1 à 2 % des cancers bronchiques sont associés à la tuberculose tandis que la tuberculose est quant à elle associée au cancer broncho-pulmonaire dans 1 à 5 % des cas [6]. La découverte simultanée d’une tuberculose active et d’un cancer bronchique comme c’est le cas dans ces 2 observations est très rare surtout chez des patients sans facteurs d’exposition. Dans la majorité des cas, ces deux maladies sont découvertes de manière séquentielle [7]. La survenue de cancers bronchiques chez les non-fumeurs, pour la plupart des auteurs, sont des entités à part [8,9]. En effet, leurs mécanismes oncogéniques ne reposent pas sur l’exposition directe aux carcinogènes du tabac, d’autres agents cancérogènes s’associant à des mécanismes de susceptibilité individuelle sont responsables de la tumorogenèse. Le Cancer bronchique chez les non-fumeurs devient alors une maladie multifactorielle révélant d’autres voies oncogéniques et d’autres facteurs de risque de développer un cancer bronchique qui sont : les toxiques inhalés, les polluants professionnels, les polluants domestiques, les polluants atmosphériques et les antécédents et style de vie du patient [8].
Les patients de ces observations avaient un âge moyen de 45 ans, et étaient des hommes.
L’association cancer et TB a été décrite dans la littérature surtout chez des patients âgés entre 50 et 80 ans, avec une prédominance masculine [10].À l’inverse, des données asiatiques suggèrent que les Cancers Bronchiques chez les non-fumeurs pourraient survenir à un âge plus précoce [11,12].Cependant une étude a montré que la tuberculose est un facteur essentiel dans l’apparition du cancer du poumon qui peut survenir à tout âge [13].
La difficulté diagnostique repose sur le fait que la tuberculose peut simuler tant sur les symptômes que sur l’imagerie, le cancer bronchique qui alors peut passer inaperçu [14].
La fibroscopie bronchique a été l’examen clé du diagnostic du cancer broncho-pulmonaire et de la tuberculose pulmonaire. Elle a permis d’effectuer des prélèvements histologiques et de faire le GeneXpert sur le LBA. Les muqueuses étaient inflammatoires et du caséum était présent chez un des patients. Pour expliquer ces lésions dans ces observations, on peut évoquer l’hypothèse que, dans les tumeurs périphériques loin des bronches supposées avoir un aspect endoscopique normal, la coexistence d’une tuberculose peut provoquer l’inflammation de la muqueuse bronchique.
Sur le plan histologique, l’adénocarcinome était retrouvé chez les deux patients. Ces tumeurs auraient pu bénéficier de techniques spéciales (comme l’immunohistochimie) si elles étaient disponibles au Niger. Ces cas mettent aussi en exergue le long délai des rendus des résultats de l’histologie (1 mois en moyenne) et l’insuffisance du plateau technique.
Sur le plan radiologique, des lésions de condensation et de pleurésie avaient été retrouvées. La pleurésie témoigne probablement du stade métastatique de la tumeur. La fréquence relativement élevée des pleurésies chez le non-fumeur pourrait trouver son explication du le fait que l’adénocarcinome, qui est le type histologique le plus souvent rencontré chez le non-fumeur, est le plus associé à la survenue de pleurésie. Ces cancers, le plus souvent distaux, envahissent plus précocement la plèvre [15]. Le
diagnostic radiologique du cancer broncho pulmonaire associé à la tuberculose est difficile car les lésions se chevauchent, d’où l’intérêt de la tomodensitométrie thoracique qui permet de bien décrire les lésions et de dresser le bilan d’extension.
Sur le plan thérapeutique, un seul patient a pu bénéficier d’une chimiothérapie et d’une radiothérapie. La chimiothérapie était utilisée à but palliatif, puisque tous les patients étaient diagnostiqués à des stades avancés avec des métastases pleurales et osseuses.
Pour la TB pulmonaire, tous les patients avaient bénéficié d’un traitement antituberculeux. Lors de l’association concomitante de la TB pulmonaire et du CBP, le diagnostic de la tuberculose impose le démarrage du traitement antibacillaire en premier. Du fait de l’impossibilité de démarrer la chimiothérapie qu’après 1 à 2 mois du début du traitement antituberculeux, un retard d’instauration des thérapeutiques antimitotiques est souvent provoqué [16].Un des patients était décédé à un mois du traitement antituberculeux. Il n’a pas pu bénéficier de chimiothérapie. La difficulté de la prise en charge de ces patients résident dans la prise de décision pour le traitement antituberculeux et le traitement anticancéreux. Les médicaments utilisés peuvent déséquilibrer un tableau clinique déjà précaire et précipité le décès du patient. L’association du traitement antituberculeux aux chimiothérapies anticancéreuses peut engendrer une majoration du risque d’EI par toxicité additive ou par modification de l’efficacité du traitement anticancéreux. Des EI sévères à type de vomissement avaient été observés chez un des patients et étaient une des causes d’abandon du traitement associé au manque de moyens. En effet les cures de chimiothérapie et la prise en charge des EI sont à la
charge du patient C’est ce qui peut expliquer son revirement vers les tradipraticiens. Ces cas mettent en relief les difficultés de prise en charge des cancers en Afrique subsaharienne et les réalités socioculturelles. De nos jours dans les pays à plateau technique relevé, on assiste à une révolution dans la prise en charge des CBP avec le ciblage d’anomalies moléculaires développées par les cellules tumorales. La recherche de ces anomalies est devenue un standard pour les cancers non à petites cellules non opérables. Il existe là aussi certaines particularités chez le non-fumeur. Les mutations de l’EGFR sont l’apanage du non-fumeur et du « petit » fumeur [17]. Leur détection a une importante répercussion thérapeutique avec l’indication de l’utilisation d’inhibiteurs de tyrosines kinases qui améliorent considérablement le pronostic de ces cancers [18].
Les patients ayant une association entre un cancer bronchique et une tuberculose sont souvent découverts à un stade avancé de la maladie cancéreuse .Dans l’ensemble, le pronostic est plus péjoratif que lorsque le cancer pulmonaire est isolé [19]. Le décès de ces patients survient souvent par progression de la maladie cancéreuse.
Conclusion
La coexistence simultanée de la tuberculose pulmonaire et du cancer broncho-pulmonaire chez des patients non-fumeurs est rare. La similitude de la présentation clinique pouvant être responsable d’un retard diagnostic et de prise en charge appropriée. . L’adénocarcinome était le principal type histologique retrouvé. L’association de ces 2 pathologies est responsable d’une morbidité et une mortalité importante.
REFERENCES
1. Sung H, Ferlay J, Rebecca L, Loversanne M, Soerjonata I, Jemal A et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians Issue 2021. 71: 191-280
2. World Health Organization. Global Tuberculosis Report 2023. Geneva: World Health Organization; 2023. 75 p.
3. Ballaz S, Mulshine JL. The Potential Contributions of Chronic Inflammation to Lung Carcinogenesis .Clin Lung Cancer. 2003; 5(1): 46‑62,
4. Ounteini AM, Didier LJ, Rabiou S, Issoufou I, Effared B, Kammoun L, et al. Second primary bronchial cancer and concomitant active pulmonary tuberculosis: coexistence of two frequent and serious respiratory diseases. J Func Vent Pulm 2020;33(11):1-66
5. Yu YH, Liao CC, Hsu WH, Liao Wc, Sung Fc, Chen Cy, et al. Increased lung cancer risk among patients with pulmonary tuberculosis: a population cohort study. J Thorac Oncol. 2011; 6(1):32‑7.
6. Brenner DR, McLauglin JC, Hung RJ. Previous lung disease andlung cancer risk: a systematic review and meta-analysis. PLoSOne 2011;6:e17479.
7. Silva DR, Valentini Jr DF, Müller AM, de Almeida CP, Dalcin PdeT. Pulmonary tuberculosis and lung cancer: simultaneous andsequential occurrence. J Bras Pneumol 2013;39:484-9.
8. Couraud S, Zalcman G, Milleron B, Morin F, Souquet P- J. Lung cancer in never smokers- - a review. Eur J Cancer 2012;48:1299-311.
9. Sun S, Schiller JH, Gazdar AF. Lung cancer in never smokers a different disease. Nat Rev Cancer 2007;7:778-90.
10. Kuo S-C, Hu Y-W, Liu C-J, Lee Y-T, Chen Y-T, Chen T-L, et al. Association between tuberculosis infections and non-pulmonary malignancies: a nationwide population-based study. Br J Cancer 2013;109:229–34.
11. Toh C- K, Gao F, Lim W- T, Leong S- S, Fong K- W, Yap S- P, et al. Never- smokers with lung cancer: epidemiologic evidence of a distinct disease entity. J Clin Oncol 2006;24:2245-51.
12. Kawaguchi T, Takada M, Kubo A, Matsumura A, Fukai S,Tamura A, et al. Gender, histology, and time of diagnosis are important factors for prognosis: analysis of 1499 never- smokers with advanced non- small cell lung cancer in Japan. J Thorac Oncol 2010;5:1011-7.
13. Yu YH, Liao CC, Hsu WH, Chen HJ, Liao WC, Muo CH, et al. Increased lung cancer risk among patients with pulmonary tuberculosis: a population cohort study. J Thorac Oncol Off Publ Int Assoc Study Lung Cancer 2011;6:32-7.
14. Vento S, Lanzafame S. Tuberculosis and cancer: a complex anddangerous liaison. Lancet Oncol 2011;12:520-2.
15. Morgensztern D, Waqar S, Subramanian J,Trinkaus K,Govindan R. Prognostic impact of malignant pleural effusion at presentation in patients with metastatic non–small-cell lung cancer. J Thorac Oncol. 2012;7(10):1485‑9.
16. Fikri O, Saidi I, Aitbatahar S, Amro L , « Association tuberculose et carcinome bronchique », 24e Congrès CPLF, janv. 2020, 12(1):117.
17. Guibert N, Milia JD, Mazieres J. Épidémiologie moléculaire du cancer bronchique. Rev Mal Respir. 2016;33(8):675‑81.
18. Cadranel J, Ruppert AM, Lavole A, Gounant V, Beau-Faller M, Wislez M. Prise en charge thérapeutique des cancers bronchiques non à petites cellules métastatiques mutés pour l’EGFR. Rev Mal Respir Actual. 2012; 4(6):583‑98.
19. Ferlay J, Soerjomataram I, Dikshit R, Sultan E, Colin M, Marise R et al. Cancer incidence and mortality worldwide: Sources,methods and major patterns in GLOBOCAN 2012.International Journal of Cancer 2015:136,359-386.
FIGURES - TABLES
REFERENCES
1. Sung H, Ferlay J, Rebecca L, Loversanne M, Soerjonata I, Jemal A et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians Issue 2021. 71: 191-280
2. World Health Organization. Global Tuberculosis Report 2023. Geneva: World Health Organization; 2023. 75 p.
3. Ballaz S, Mulshine JL. The Potential Contributions of Chronic Inflammation to Lung Carcinogenesis .Clin Lung Cancer. 2003; 5(1): 46‑62,
4. Ounteini AM, Didier LJ, Rabiou S, Issoufou I, Effared B, Kammoun L, et al. Second primary bronchial cancer and concomitant active pulmonary tuberculosis: coexistence of two frequent and serious respiratory diseases. J Func Vent Pulm 2020;33(11):1-66
5. Yu YH, Liao CC, Hsu WH, Liao Wc, Sung Fc, Chen Cy, et al. Increased lung cancer risk among patients with pulmonary tuberculosis: a population cohort study. J Thorac Oncol. 2011; 6(1):32‑7.
6. Brenner DR, McLauglin JC, Hung RJ. Previous lung disease andlung cancer risk: a systematic review and meta-analysis. PLoSOne 2011;6:e17479.
7. Silva DR, Valentini Jr DF, Müller AM, de Almeida CP, Dalcin PdeT. Pulmonary tuberculosis and lung cancer: simultaneous andsequential occurrence. J Bras Pneumol 2013;39:484-9.
8. Couraud S, Zalcman G, Milleron B, Morin F, Souquet P- J. Lung cancer in never smokers- - a review. Eur J Cancer 2012;48:1299-311.
9. Sun S, Schiller JH, Gazdar AF. Lung cancer in never smokers a different disease. Nat Rev Cancer 2007;7:778-90.
10. Kuo S-C, Hu Y-W, Liu C-J, Lee Y-T, Chen Y-T, Chen T-L, et al. Association between tuberculosis infections and non-pulmonary malignancies: a nationwide population-based study. Br J Cancer 2013;109:229–34.
11. Toh C- K, Gao F, Lim W- T, Leong S- S, Fong K- W, Yap S- P, et al. Never- smokers with lung cancer: epidemiologic evidence of a distinct disease entity. J Clin Oncol 2006;24:2245-51.
12. Kawaguchi T, Takada M, Kubo A, Matsumura A, Fukai S,Tamura A, et al. Gender, histology, and time of diagnosis are important factors for prognosis: analysis of 1499 never- smokers with advanced non- small cell lung cancer in Japan. J Thorac Oncol 2010;5:1011-7.
13. Yu YH, Liao CC, Hsu WH, Chen HJ, Liao WC, Muo CH, et al. Increased lung cancer risk among patients with pulmonary tuberculosis: a population cohort study. J Thorac Oncol Off Publ Int Assoc Study Lung Cancer 2011;6:32-7.
14. Vento S, Lanzafame S. Tuberculosis and cancer: a complex anddangerous liaison. Lancet Oncol 2011;12:520-2.
15. Morgensztern D, Waqar S, Subramanian J,Trinkaus K,Govindan R. Prognostic impact of malignant pleural effusion at presentation in patients with metastatic non–small-cell lung cancer. J Thorac Oncol. 2012;7(10):1485‑9.
16. Fikri O, Saidi I, Aitbatahar S, Amro L , « Association tuberculose et carcinome bronchique », 24e Congrès CPLF, janv. 2020, 12(1):117.
17. Guibert N, Milia JD, Mazieres J. Épidémiologie moléculaire du cancer bronchique. Rev Mal Respir. 2016;33(8):675‑81.
18. Cadranel J, Ruppert AM, Lavole A, Gounant V, Beau-Faller M, Wislez M. Prise en charge thérapeutique des cancers bronchiques non à petites cellules métastatiques mutés pour l’EGFR. Rev Mal Respir Actual. 2012; 4(6):583‑98.
19. Ferlay J, Soerjomataram I, Dikshit R, Sultan E, Colin M, Marise R et al. Cancer incidence and mortality worldwide: Sources,methods and major patterns in GLOBOCAN 2012.International Journal of Cancer 2015:136,359-386.
ARTICLE INFO DOI: 10.12699/jfvpulm.16.49.2025.56
Conflict of Interest
Non
Date of manuscript receiving
10/03/2025
Date of publication after correction
29/06/2025
Article citation
Halidou Moussa S, Gagara Issoufou MA, Cheikh Aboubacar AL, Hamidou I, Assoumana Issaka A, Maizoumbou D, Ouédraogo M. Concomitant discovery of pulmonary tuberculosis and bronchopulmonary cancer in two patients with no carcinogenic risk factors. J Func Vent Pulm 2025;49(16):39-44