
 English
English
 French
French
Tuberculosis and thromboembolic and venous diseases: epidemiological, clinical, therapeutic and evolutionary aspects at the Pneumophtisiology Department of Point-G University Hospital
Tuberculose et maladies thrombo emboliques et veineuses : Aspects épidémio cliniques, thérapeutiques et évolutifs au service de pneumophtisiologie CHU Point-G
Soumaré 1 2, T. Kanouté1 3, K. Ouattara 1 2, B. Baya1, S. Koné1, FB. Sanogo1, I. Guindo1, S. Satao1, G. Djigandé1, O. Toto1, Y. Toloba1 2.
1-Service de pneumo-phtisiologie, Centre Hospitalier Universitaire du Point G, Bamako, Mali
2- Université des Sciences, des Techniques et des Technologies de Bamako (USTTB), Mali
3-Centre National de la Recherche Scientifique et Technologique (CNRST), Bamako, Mali
Corresponding author: Dr Soumaré Dianguina, pneumologue au Centre Hospitalier Universitaire du Point G, Bamako Mali ; BP : 333 .
Mail: soumaredianguina@@gmail.com
ABSTRACT
Introduction: Pulmonary TB is considered a risk factor for venous thromboembolic disease (VTE). The association of these two pathologies is rare, but no less negligible in countries with a high incidence of TB. The prevalence varies between 0.6% and 10% depending on the authors. The aim of our study was to determine the epidemiological, clinical and evolutionary aspects of this association in the HPC Point-G department.
Methods: This is a retrospective study of 30 cases of patients with pulmonary TB complicated by VTE.
Results: During the study period, 811 patients with TB were hospitalized, including 30 cases of VTE. The hospital prevalence was 3.7%. The average age was 39.4. HIV serology was positive in 13.3%. Dyspnea, cough, chest pain, and fever were the constant signs. Hemoptysis was present in 83.3% of cases. VTE was indicative of TB in 10 patients, appearing during hospitalization in 20 patients. There were 18 cases of PE, 06 cases of DVT +PE and 06 cases of DVT. VTE was suspected in the presence of Wells' clinical probability and/or Homans' sign. TB was confirmed by the presence of BK in the Xpert MTB Rif test. Confirmation of VTE was provided by chest CT angiography and Doppler ultrasound. All patients received anti-TB therapy combined with anticoagulants. The evolution was favorable in 19 patients, 06 cases of complications, 02 discharged against medical advice and fatal in 03 patients.
Conclusion: VTE should be routinely diagnosed in severe pulmonary tuberculosis patients because of the risk of complication.
KEYWORDS: Tuberculosis - VTE - Point-G University Hospital
RÉSUMÉ
Introduction : La TB pulmonaire est considérée comme un facteur de risque de maladie thromboembolique et veineuse (MTEV). L’association de ces deux pathologies est rare, mais non moins négligeable dans les pays à forte incidence de TB. La prévalence varie entre 0,6 % et 10 % selon les auteurs. Le but de notre étude était de déterminer les aspects épidémiologiques, cliniques et évolutifs de cette association au service de PPH CHU Point-G.
Méthodes : Il s’agit d’une étude rétro prospective portant sur 30 cas de patients atteints de TB pulmonaire compliquée de MTEV.
Résultats : Durant la période d’étude 811 patients atteints de TB ont été hospitalisés, parmi lesquels 30 cas de MTEV. La prévalence hospitalière était de 3,7%. L’âge moyen était de 39,4. La sérologie VIH était positive chez 13,3%. La dyspnée, toux, douleur thoracique et la fièvre étaient les signes constants. L’hémoptysie était présente chez 83,3% des cas. La MTEV était révélatrice de la TB chez 10 patients, apparaissant au cours de l’hospitalisation chez 20 patients. On a enregistré 18 cas d’EP, 06 cas de TVP + EP et 06 cas de TVP. La MTEV était suspectée devant la probabilité clinique de Wells et ou le signe de Homans. La TB a été confirmée par la présence de BK dans le test Xpert MTB Rif. La confirmation de la MTEV était apportée par l’angioscanner thoracique et l'échographie doppler. Tous les patients ont reçu le traitement anti TB ass cié aux anticoagulants. L’évolution était favorable chez 19 patients, 06 cas des complications, 02 sortis contre avis médical et fatale chez 03 patients.
Conclusion : La MTEV doit être diagnostiquée systématiquement chez les patients tuberculeux pulmonaires sévères en raison du risque de complication.
MOTS CLÉS: Tuberculose - MTEV - CHU Point-G
INTRODUCTION
la tuberculose reste un problème majeur de santé publique malgré les différents moyens de lutte au niveau mondial avec des progrès scientifiques et thérapeutiques sans cesse croissants depuis plus d’un siècle. En 2023, environ 10,6 millions de nouveaux cas de tuberculose ont été recensés par l’Organisation Mondiale de la Santé (OMS) dans le monde et responsable de 1,3 million de décès par an [1]. Le Mali est un pays à forte endémicité tuberculeuse avec une incidence de 49 cas pour cent mille habitants dont le taux estimé était de 11254 cas [2]. La TB est considérée comme un facteur de risque de maladies thromboemboliques et veineuses. La prévalence de cette association varie entre 0,6 % et 10 % selon les auteurs [3]. La survenue de ces accidents et notamment dans les formes graves de TB soulève de nombreux problèmes d’ordre étiopathogénique, tel des états d’hypercoagulabilité en rapport avec un déficit connu en protéines de la coagulation dont les mécanismes impliqués dans la MTEV associée à la TB ne sont pas clairs, et les anomalies biochimiques des plaquettes ou de l’interaction plaquettes-paroi vasculaire ne sont pas établies de façon formelle; d’ordre diagnostique caractérisé par la grande diversité de sa présentation clinique, source de retard thérapeutique, surtout en milieu médical où l’évaluation du risque thromboembolique est moins bien codifiée; d’ordre thérapeutique dû à l’interaction des antituberculeux et des anti-vitamines K (AVK) et enfin d’ordre évolutif et pronostic lié au cumul de la morbi mortalité de ces deux affections [5, 6, 7]. Le but de notre étude était de décrire les aspects épidémio cliniques, thérapeutiques et évolutifs de la survenue d’un évènement thromboembolique veineuse au cours de la TB chez les patients hospitalisés.
Méthodes
Il s'agissait d'une étude rétro prospective et descriptive portant sur les patients hospitalisés pour TB dans le service de pneumophtisiologie du CHU Point-G de Janvier 2021 à Janvier 2023 chez qui la MTEV a été diagnostiquée. Ont été inclus les patients de deux sexes âgés de 20 ans ou plus. Une fiche d’enquête a été utilisée pour chaque patient pour le recueil des données sociodémographiques, cliniques, para cliniques, thérapeutiques et évolutives. L’étude a été réalisée avec l’accord de l’administration de l’hôpital. La confidentialité sur l’identité des patients a été préservée. Le diagnostic de la TB a été retenu sur des éléments cliniques et radiologiques avec confirmation bactériologique devant la mise en évidence du Bacille acido alcoolo résistant à l’examen direct ou au test Xpert MTB Rif avec la présence de Mycobacterium du complexe tuberculosis, à la culture ou par l’examen anatomopathologique par la mise en évidence de follicule de Koester avec nécrose caséeuse. Celui de la MTEV devant un tableau clinique, confirmé par l’angioscanner thoracique et ou l’échographie (cardiaque, Doppler des membres inférieurs).
Résultats :
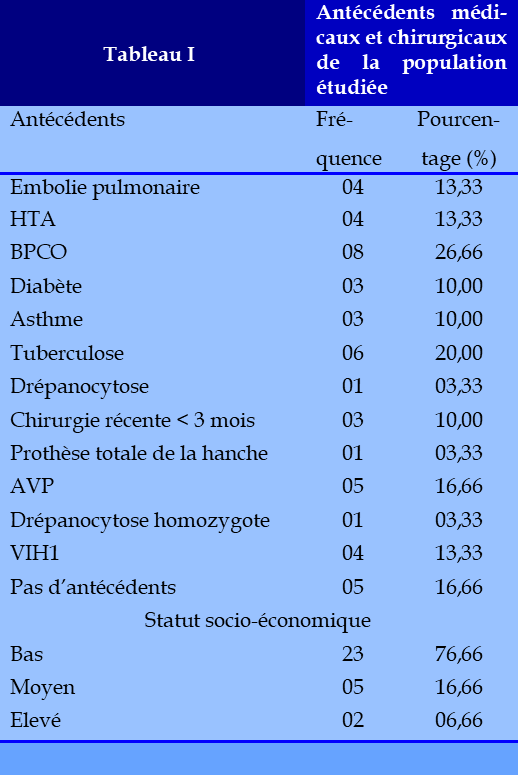
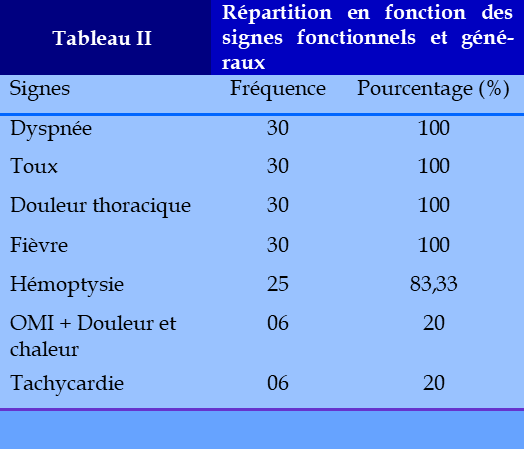
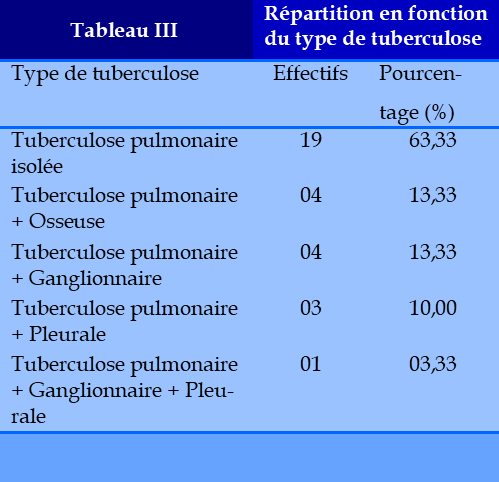
La prévalence hospitalière était de 3,7%. (811/30). L’âge moyen était de 39,4 ans. Le sex ratio était de 2,8 avec une moyenne d’âge de 42,58. Environ 62 % des patients étaient âgés de moins de 40 ans. Nous avons noté une fréquence plus élevée dans la tranche d’âge 20-40 ans. Dix cas de TBC ont été découverts au cours d’un contrôle radiologique systématique, lors du bilan de la MVTE, apparaissant au cours de l’hospitalisation chez 20 patients dont 10 parmi eux étaient sous traitement antituberculeux. Parmi les antécédents 06 cas avaient un antécédent de TB, 04 cas d’EP, 04 cas d’HTA, 08 cas de BPCO, 03 cas de diabète, et 04 cas de VIH (Tableau I). La majorité de nos patients (20 cas) étaient hospitalisés pour prise en charge de TBC. Pour 10 patients, la TBC était découverte fortuitement lors du bilan de la MVTE (4 cas de TVP et 6 cas d’EP). La durée moyenne d’évolution de la symptomatologie évoquant une TB était plus longue dans ces cas, (28 jours avec des extrêmes 11 à 45 jours). A l’examen initial, nous nous sommes intéressés surtout à relever la température et le poids des patients. La température moyenne était de 38,5 ◦C avec des extrêmes de 37,5° C à 39° C. La majorité de nos patients avaient un faible poids à l’admission, avec un indice de masse corporelle inférieur à 16,5 retrouvé chez 19 patients. La majorité de nos malades avait à un niveau socio-économique bas, expliqué par une forte incidence de la TB dans les milieux défavorisés. (Tableau I). La toux, la dyspnée, la douleur thoracique et la fièvre étaient les motifs constants d’hospitalisation. L’hémoptysie était retrouvée dans 83,33 % des cas. L’œdème des membres inférieurs associé à la chaleur et douleur locale (20%) des cas et la tachycardie (20%) des cas étaient retrouvés. (Tableau II). L’atteinte tuberculeuse était pulmonaire isolée dans 19 cas et pulmonaire associée à une localisation extra pulmonaire dans 11 cas (Tableau III). La MVTE était découverte au cours de l’hospitalisation pour tuberculose chez 20 patients alors qu’elle était révélatrice de la TB chez 10 patients. Il s’agit de 18 cas d’EP isolée, 6 cas d’EP + TVP et 6 cas de thromboses veineuses profondes isolées (tableau IV). Parmi les 20 patients hospitalisés pour forte suspicion de forme grave de TB pulmonaire ayant révélée la MTEV, 12 avaient reçu une anticoagulation prophylactique par une HBPM. Le diagnostic de la thrombophlébite a été suspecté chez 12 patients au cours de l’hospitalisation, essentiellement suite à l’apparition d’œdèmes associés ou non à une douleur spontanée du mollet chez 20 patients. Le diagnostic d’EP a été suspecté au cours de l’hospitalisation chez 20 patients et chez 10 patients, le motif d’hospitalisation était la prise en charge d’une EP avec un bilan radiologique évocateur de TB.
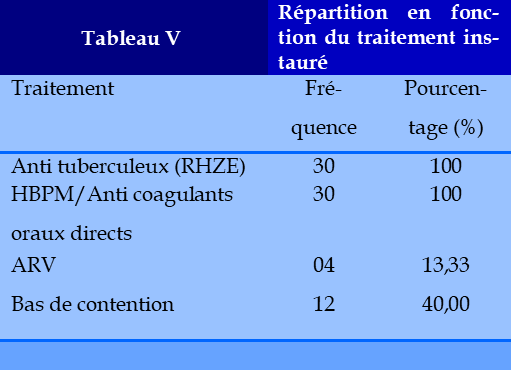
Plus de la moitié de nos patients avaient des lésions étendues et bilatérales, soulignant la gravité de l’extension de la maladie dans notre série. L’échographie doppler veineux a été pratiquée chez 20 de nos patients objectivant des signes de TVP dans 12 cas. Cette TVP était localisée au niveau des membres inférieurs chez 12 patients ; elle était distale dans 4 cas, proximale dans 6 cas et étendue à tout le membre inférieur sans atteinte de la veine cave inférieure dans 2 cas dont un thrombus flottant siégeant au niveau de la veine fémorale profonde gauche a été trouvé chez un patient. L’angioscanner thoracique a montré la présence de signes directs et indirects d’EP : Signes directs (lacunes endovasculaires ou visualisation directe de thrombus) dans 24 cas dont 18 cas d’EP et 6 cas d’EP + TVP. L’embolie pulmonaire était bilatérale chez 9 patients et unilatérale droite chez 8 patients, unilatérale gauche chez 7 patients. Les signes d’hypertension artérielle pulmonaire (HTAP) ont été retrouvés chez 6 patients. Une fois le diagnostic de la TB établi et après un bilan pré-thérapeutique à la recherche d’une éventuelle contre-indication à l’un des antituberculeux, le traitement a été débuté associant chez tous nos patients une quadrithérapie à type de RHZE (Rifampicine, Isoniazide, Pyrazinamide et Ethambutol) pendant deux mois relayée par une bithérapie RH pendant 4 mois selon le protocole recommandé au Mali par la Cellule Sectorielle de Lutte contre le VIH SIDA, la TB et l’Hépatite (CSLS TB-H). Pour certains patients notamment chez 4 patients le protocole a été prolongé à 12 mois dont 2 mois de RHZE suivi de 10 mois de RH à raison de l’atteinte osseuse associée à celle pulmonaire. Les anti retro viraux (ARV) à base d’association de Tenofovir - Lamivudine-Dolutegravir (TLD) ont été instaurés chez 4 malades TB/VIH atteints de MTEV et l’utilisation des bas de contention chez 12 patients en raison d’une TVP des membres inférieurs (tableau V). Parmi nos malades, nous avons mentionné 3 cas liés aux effets secondaires à type de cytolyse hépatique importante entrainant une modification du traitement antituberculeux avec l’arrêt de l’isoniazide. Une fois la MVTE fortement suspectée devant un tableau clinique évocateur et confirmée par les examens radiologiques complémentaires, un traitement anticoagulant a été débuté. Le traitement curatif initial a fait appel dans tous les cas à une héparinothérapie. Il s’agissait le plus souvent d’une héparine de bas poids moléculaire (HBPM), à raison de deux injections quotidiennes par voie sous cutanée, administrée. L’efficacité de ce traitement était jugée par la mesure du TCK qui devait être entre 2 et 3 fois le témoin. Le relai a été fait par les anticoagulants oraux directs à base de Rvaroxaban chez 21 patients dans un délai moyen de 5,5 jours avec des extrêmes de 2 à 7 jours. La dose était de 15 mg toutes les 12 heures pendant 21 jours, puis 20 mg en dose journalière pendant 3 à 6 mois. Ce relai a été fait chez 9 de nos malades par l’Acénocoumarol avec le contrôle régulier de l’INR jusqu’à l’obtention de la marge thérapeutique entre 2 et 3. Le délai d’obtention de cette marge thérapeutique a été long à cause de l’interaction Rifampicine-AVK. L’association TB-MVTE a posé un problème thérapeutique dû à cette interaction. Tous nos patients ont reçu la rifampicine. La dose efficace des patients qui étaient sous AVK était de 3mg (3/4 comprimé d’acénocoumarol), atteinte dans un délai de 7 jours dans 2/9 cas. Chez 4/9 sous Acénocoumarol le délai d’atteinte d’une dose efficace a été supérieur à 25 jours et chez 3/9 patients l’obtention d’un INR dans la marge thérapeutique étant impossible au bout de 45 jours et les AVK ont été arrêtés chez ces 3 patients avec poursuite d’une héparinothérapie par héparine de bas poids moléculaire pendant 3 mois. La durée moyenne d’hospitalisation était de 22,5 jours avec des extrêmes de 8 à 55 jours. Concernant l’évolution, dix-neuf pa tients suivis régulièrement étaient jugés guéris devant la régression de la symptomatologie clinique, l’amélioration nette de l’état général, la négativation bacilloscopique et l’amélioration ou la stabilité des lésions radiologiques. Six cas des séquelles radiologiques ont persisté à type de lésions fibreuses compliquées d’insuffisance respiratoire. Deux patients étaient perdus de vue après un suivi régulier de plus de deux mois. Trois cas de décès dans un intervalle de 30-55 jours dans un tableau d’hémoptysie cataclysmique et d’insuffisance respiratoire (Tableau VI).
Discussion
La majorité des études rapportent, chez les patients tuberculeux, une prévalence de la MVTE qui se situe entre 0,6 % et 4,8% (Tableau VII). Cependant, certains auteurs ont estimé que la prévalence réelle de la MVTE pourrait être supérieure à 10 % mais elle était méconnue dans les deux tiers des cas [4]. Depuis 1856, Virchow a décrit dans sa triade les mécanismes pouvant concourir à la formation d’un thrombus qui sont : l’altération de la coagulation, la lésion de la paroi vasculaire et la stase veineuse, ces 3 mécanismes étant souvent intriqués [5, 6, 7]. La TB agit à ces 3 niveaux [8]. En effet, au cours de la TBC plusieurs mécanismes peuvent induire un état d’hypercoagulabilité sanguine à l’origine des complications thromboemboliques. La TB peut induire au niveau du sang une activation des cellules mononuclées dont l’interaction avec le Mycobactérium tuberculosis induit une synthèse accrue de l’interleukine 6 (IL6), l’interleukine 1(IL1) et du TNF alfa [9, 10, 11]. L’IL6 stimule la synthèse des protéines de la phase aiguë de l’inflammation parmi lesquelles le fibrinogène et la C4bBP complexant la protéine S et le facteur VIII, ce qui favorise un état pro-coagulant [12]. Ceci a été rapporté par une étude Nigérienne ayant dosé la concentration sanguine en fibrinogène chez 100 patients atteints de tuberculose et une population témoin. Selon cette étude, la concentration de fibrinogène était significativement plus élevée chez les patients tuberculeux par rapport au groupe contrôle (6,3 ± 2,5 g/L versus 3,17 ± 0,55 g/L) [13]. Koster et al. ont montré que le risque de TVP augmente lorsque le taux de fibrinogène dépasse 5 g/L [14]. Le rôle joué par l’IL6 dans l’augmentation de la mégacaryocytopoièse a été décrit, cependant l’action des cytokines sur les fonctions plaquettaires reste peu connue [12]. D’autre part, certaines études ont démontré qu’au cours de la TB le nombre de plaquettes était augmenté avec non seulement une diminution de leur taille, mais en plus une augmentation de leur agrégabilité [8, 13,15]. Les signes fonctionnels respiratoires à savoir la toux, la dyspnée, la douleur thoracique, l’hémoptysie, associés à la fièvre comme signe général ont été retrouvés par la plupart des auteurs [8, 13,15]. L’immobilité et l’alitement prolongé en raison de la morbidité causée par la maladie tuberculeuse constituent l’un des facteurs de risque de la thrombose. En effet, ils sont à l’origine d’un ralentissement circulatoire et d’une stase veineuse qui majore le risque d’hypercoagulabilité [11]. La compression locale vasculaire notamment par les adénopathies, à l’origine d’un ralentissement circulatoire local, a également été décrite comme une cause de genèse de la thrombose. Dans les séries d’étude de Gogna et al et de J. Ben Amar et al, des cas d’adénopathies rétro péritonéales, para aortiques et iliaques d’origine tuberculeuse ayant présenté une thrombophlébite ilio-fémorale et de la veine cave inférieure, ont été rapporté [16, 17]. Dans notre étude, un thrombus flottant siégeant au niveau de la veine fémorale profonde gauche a été trouvé chez un patient avec atteinte ganglionnaire associée à une atteinte pulmonaire. Au cours de la TBC, il y a une synthèse d’IL1, d’IL6 et du TNF alfa soit directement ou suite à une interaction entre système monocyte-macrophage et le bacille de Koch induisant ainsi une perturbation au niveau de l’endothélium vasculaire [9, 11]. En effet, ces cytokines par leur caractère pro inflammatoire, vont activer l’intima vasculaire et rendre l’endothélium thrombogène. Elles vont induire aussi une stimulation de la synthèse hépatique des protéines de la coagulation [18, 19]. La stase veineuse peut précipiter la survenue d’une thrombose en causant un dommage endothélial vasculaire secondaire à une hypoxie locale d’une part et à une diminution de la clairance des facteurs activés de la coagulation d’autre part, intéressant la surface vasculaire lésée. Les données de la littérature restent controversées concernant le rôle de la rifampicine dans la genèse de la MVTE [20]. L’administration de la rifampicine s’accompagne d’une prolifération du réticulium endoplasmique de l’hépatocyte avec une induction enzymatique du cytochrome P450, cette induction peut altérer la balance des protéines coagulantes et anticoagulantes synthétisées par le foie favorisant ainsi un état d’hypercoagulabilité [21]. Selon White, la rifampicine était associée à un risque accru de survenue de TVP avec une fréquence de 4,74 % chez les patients recevant la rifampicine [6]. Raschilas a réalisé une étude de l’hémostase chez dix patients hospitalisés pour TBC, avant et un mois après la mise sous un traitement antituberculeux comprenant la rifampicine. Il a conclu qu’aucune anomalie n’était découverte expliquant l’augmentation de la fréquence des TVP rapportées à l’utilisation de la rifampicine, et notamment pas de résistance acquise à la protéine C comme ce qui a été décrit avec les contraceptifs oraux [22]. Toutefois, malgré cette incrimination probable de la rifampicine dans la genèse des MVTE, son utilisation reste indiquée mais des mesures préventives contre la survenue des complications thromboemboliques doivent être prises telles que la mobilisation active des membres, avec éventuellement un traitement préventif par les anticoagulants. L’atteinte pulmonaire était de loin la localisation de la TBC la plus fréquente rapportée par la littérature [23, 24]. Cependant les complications thromboemboliques ont été rapportées avec les différentes localisations, pulmonaires ou extra pulmonaires [16, 25, 26, 27]. Pour plusieurs auteurs la sévérité de la TBC était liée à la fragilité du terrain (comorbidités associées) et pour d’autres, à l’étendue des lésions radiologiques de la tuberculose, l’atteinte étant le plus souvent étendue et bilatérale [8,28]. Plusieurs études ont trouvé une corrélation entre le risque de développer une MVTE et la sévérité de la maladie tuberculeuse [3, 29, 26, 18]. Dans notre série, plus de la moitié de nos patients avaient des lésions étendues et bilatérales, soulignant la sévérité de la maladie. Le délai d’apparition de la MVTE était variable. En effet, celle-ci peut précéder les manifestations de la TBC, apparaître de façon concomitante ou dans certains cas, survenir au cours du traitement antituberculeux [4, 9, 29,17], mais dans la majorité des cas, de façon précoce, à un stade où le patient est encore alité et le taux sanguin des cytokines pro-inflammatoires encore élevé [18,19]. En cas d’association avec la TBC, le tableau clinique aussi bien de la TVP que de l’EP, n’a présenté aucune particularité. La plupart des études s’accordent sur le fait que la localisation la plus fréquente de la TVP était au niveau du membre inférieur, avec surtout une atteinte des veines fémorales et poplitées [5, 16, 3,28, 18]. Toutefois, d’autres localisations ont été rapportées, notamment hémorroïdaire [10], cérébrale [18], veine cave supérieure [25], intestinale [26], rénale [27], rétinienne [30] et cutanée [31]. Du point de vue thérapeutique, si l’interaction rifampicine-AVK est bien démontrée, aucun consensus n’était établi, malgré les difficultés rencontrées dans la prise en charge des deux pathologies associées. La rifampicine, agent anti-antituberculeux, possède un puissant potentiel inducteur enzymatique du cytochrome P450. Des interactions entre rifampicine et AVK sont décrites, la rifampicine induisant une accélération du catabolisme des VK et donc une diminution de l’efficacité de l’anticoagulant oral [32]. Cet effet inducteur s’observe dès la posologie de 600 mg/jour, il se développe en quelques jours, atteint son maximum en 3 semaines environ et se maintient 1 à 4 semaines après l’arrêt de la rifampicine. L’interaction pharma cocinétique semble majeure, la rifampicine induisant plusieurs iso enzymes du cytochrome P450. L’iso enzyme CYP2C9 est impliqué de manière importante dans la métabolisation de l’acénocoumarol. L’induction de ces enzymes conduit donc à une dégradation accrue des anticoagulants oraux administrés et à une diminution importante de leur activité [32,33]. L’autre mécanisme qui peut être impliqué est l’induction de la glycoprotéine P par la rifampicine conduisant à une diminution des concentrations des médicaments associés [34]. Les héparines de bas poids moléculaire peuvent être une bonne alternative ; mais leur coût élevé est une cause de mauvaise observance des malades. Dans notre série Les anti retro viraux (ARV) à base d’association de Tenofovir - Lamivudine-Dolutegravir (TLD) ont été instaurés chez 4 malades atteints de VIH. Parmi ceux-ci, nous avons mentionné 3 cas d’effets secondaires à type de cytolyse hépatique importante entrainant une modification du traitement antituberculeux avec l’arrêt de l’isoniazide. Ceci nous incite à faire un dépistage du VIH chez ces patients présentant une Co morbidité TB/MTEV et également conseiller une activité physique avec mobilisation des membres chez les patients présentant une TB associée à des pathologies à risque de thrombose veineuse. L’héparinothérapie à dose préventive doit être prescrite chez les patients tuberculeux alités et ayant une forme étendue et grave de leur maladie ou présentant des pathologies à risque de TVP. Un effet bénéfique a été rapporté malgré la possibilité de survenue de la complication thromboembolique [5, 28,29].
Conclusion
Compte tenu de ces données, chez les patients tuberculeux ayant des facteurs et des pathologies à risque de thrombose, une activité doit être maintenue avec mobilisation des membres, l’hospitalisation prolongée doit être évitée et l’indication d’une héparinothérapie à dose préventive peut s’avérer utile et doit être discutée au cas par cas particulièrement chez les patients ayant des pathologies à risque de complications thromboemboliques et présentant une tuberculose avec des lésions pulmonaires étendues et bilatérales.
REFERENCES
| 1. Global tuberculosis report 2023. Geneva: World Health Organization; 2023 http://www.who.int/iris/bitstream/10665/ 75938/1/9789241564502 eng.pdf |
| 2. Ministère de la santé et du développement social. Cellule Sectorielle de Lutte contre le Sida, la Tuberculose et l’Hépatite virale (Rapport annuel 2023) |
| 3. Malzi I, Ardouz E, Alami SM, Marc K. Tuberculose et maladie thromboembolique. Rev Mal Respir 2021; 29:A115 |
| 4. Anderson FA, Wheeler HB, Goldberg RJ, Hosmer DW, Forcier A.Physician practices in the prevention of venous thromboembolism. Ann Intern Med 1991; 115:591 - 5. |
| 5. Sharif-Kashani B, Bikdeli B, Moradi A, Tabarsi P, Chitsaz E, Shemirani S, et al. Coexisting venous thromboembolism in patients with tuberculosis. Thromb Res 2016; 125:478 - 80. |
| 6. White NW. Venous thrombosis and rifampicin. Lancet 1999; 2: 434 - 35. |
| 7. Ambrosetti M, Ferrarese M, Codecasa LR, Besozzi G, Sarassi A, Viggiani P, et al. Incidence of venous thromboembolism in tuberculosis patients. Respiration 2016; 73:396. |
| 8. Robson SC, White NW, Aronson I, Woollgar R, Goodman H, Jacobs P. Acute-phase response and the hypercoagulable state in pulmonary tuberculosis. Br J Haematol 1996; 93:943- 49. |
| 9. Turken O, Kunter E, Sezer M, Solmazgul E, Cerrahoglu K, Bozkanat E, et al. Hemostatic changes in active pulmonary tuberculosis. Int J Tuberc Lung Dis 2002; 6: 927 - 32. |
| 10. Bokri K, Saissy JM, Benomar S, Okheira H, Dimou M, Ducourau JP. Tuberculose anorectale révélée par une thrombose hémorroïdaire. Med Trop 1986;46: 75 - 7. |
| 11. Abdelkarim S. Spondylodiscite tuberculeuse compliquée d’une ischémie aiguë des membres inférieurs à propos d’un cas. Pan Afr Med J 2011;8:45. |
| 12. Boué F. Cytokines et syndrome inflammatoire. In: Galanaud P, Emilie D, editors. Cytokines et médecine interne. Paris: Masson; 1997. |
| 13. Akpan PA, Akpotuzor JO, Akwiwu EC. Some haematological parameters of tuberculosis (TB) infected Africans: the Nigerian perspective. J Natural Sci Res 2012; 2:50 - 7. |
| 14. Koster T, Vandenbroucke JP, Rosendaal FR. Venous thrombosis due to poor anticoagulant response to activated protein C: Leiden thrombophilia study. Lancet 1993; 342:1503 - 6. |
| 15. Nwankwo EO, Kwaru A, Ofulu A, Babashani M. Haematological changes in tuberculosis in Kano, Nigeria. J Med Lab Sci 2005; 14:35-9. |
| 16. Gogna A, Pradhan GR, Sinha RS, Gupta B. Tuberculosis presenting as deep vein thrombosis. Postgrad Med J 1999; 75:104-5. |
| 17. Ben Amar J, B. Dahri, H. Aouina, H. Bouacha. Maladie veineuse thromboembolique au cours de la tuberculose. Rev Pneumol Clin (2015), 515: 1-8 |
| 18. Mark PL, Ashok PP, Deshpande RB, Mahashur AA. A patient with hypercoagulable state due to tuberculosis. Indian J Chest Dis Allied Sci 2009; 51:49-51. |
| 19. Andus T, Bauer J, Gerok W. Effects of cytokines on liver. Hepatology 1991; 13:364 -75. |
| 20. Raschilas F, Mortier E, Combe A, Grasland A, Pouchot J, Vinceneux P. Rifampicine et thrombose veineuse. Rev Med 2001; 22:485 - 6. |
| 21. Goncalves IM, Alves DC, Carlvalho A, Ceu Brito M, Calvario F, Duarte R. Tuberculosis and venous thromboembolisme: a case series. Cases J 2009;16:9333. |
| 22. Gaudelus J. Dans quels cas penser à la tuberculose chez l’enfant? Med Mal Inf 2003; 33:135s - 40s. |
| 23. Antoun F, Momas I, Vieu V, Poinsard R, Crespy M. Suivi épidémiologique des cas de tuberculose dans les centres médico-sociaux de Paris. Rev Mal Respir 1998; 15:171-76. |
| 24. Bishav M, Anil K, Jagdeep W, Vineet M. Pulmonary embolism in cases of pulmonary tuberculosis: a unique entity. Indian J Tuberc 2011;58:84-7 |
| 25 Ousehal A, Essadki O, Abdelouafi A, Kadiri R. Tuberculose de la veine cave supérieur. Aspects radiologiques. À propos de 28 cas. Ann Radiol 1993;36:303-09. |
| 26. Kuwajerwala NK, Bapt RD, Joshi AS. Mesenteric vasculopathy in intestinal tuberculosis. Indian J Gastroenterol 1997; 16:134-36. |
| 27. Russo D, Minutolo R, accarino I, Andreucci M. Gross hematuria of uncommon origin: the nutcracker syndrome. Am J Kidney Dis 1998; 32: E3. |
| 28. El Fekih L, Oueslati I, Hassene H, Fenniche S. Association deep veinous thrombosis with pulmonary tuberculosis. Tunis Med 2009; 87:328—9. |
| 29. H, Habibech S, Zendah I, Elmjendel I, Ghedira H. Pulmonary embolism and tuberculosis. Asian Cardiovasc Thorac Ann 2013;0:1-4. |
| 30. Zhioua R, Sbeai L, Kriaa L, El Euch M, Mabrouk S, Ouartani A. Facteurs de risque et étiologies des occlusions veineuses rétiniennes. Tunis Med 1995; 73:133 -36. |
| 31. Hara K, Tsuzuki T, Takagi N. Nodular granulomatous phlebitis of the skin: a fourth type of tuberculide. Histopathology 1997;30:129 -34. |
| 32. Bourguignon L, Golfier L, Chatillon F, Bontemps H, Brantus JF. Interaction entre l’acénocoumarol et la rifampicine : présentation d’un cas et des mécanismes pharmacocinétiques mis en jeu. J Pharmacie Clin 2006; 25:105 -09. |
| 33. Schuetz EG, Schinkel AH, Relling MV, Schuetz JD. P glycoprotein: a major determinant of rifampicin-inducible expression of cytochrome P4503A in mice and humans. Proc Natl Acad Sci USA 1996;93:4001-05. |
| 34. Levêque D, Jehl F. Rifampicine et P-glycoprotéine : un nouveau mécanisme d’interaction pharmacocinétique. J Pharm Clin 2001;20: 219 – 23 |
FIGURES - TABLES


REFERENCES
| 1. Global tuberculosis report 2023. Geneva: World Health Organization; 2023 http://www.who.int/iris/bitstream/10665/ 75938/1/9789241564502 eng.pdf |
| 2. Ministère de la santé et du développement social. Cellule Sectorielle de Lutte contre le Sida, la Tuberculose et l’Hépatite virale (Rapport annuel 2023) |
| 3. Malzi I, Ardouz E, Alami SM, Marc K. Tuberculose et maladie thromboembolique. Rev Mal Respir 2021; 29:A115 |
| 4. Anderson FA, Wheeler HB, Goldberg RJ, Hosmer DW, Forcier A.Physician practices in the prevention of venous thromboembolism. Ann Intern Med 1991; 115:591 - 5. |
| 5. Sharif-Kashani B, Bikdeli B, Moradi A, Tabarsi P, Chitsaz E, Shemirani S, et al. Coexisting venous thromboembolism in patients with tuberculosis. Thromb Res 2016; 125:478 - 80. |
| 6. White NW. Venous thrombosis and rifampicin. Lancet 1999; 2: 434 - 35. |
| 7. Ambrosetti M, Ferrarese M, Codecasa LR, Besozzi G, Sarassi A, Viggiani P, et al. Incidence of venous thromboembolism in tuberculosis patients. Respiration 2016; 73:396. |
| 8. Robson SC, White NW, Aronson I, Woollgar R, Goodman H, Jacobs P. Acute-phase response and the hypercoagulable state in pulmonary tuberculosis. Br J Haematol 1996; 93:943- 49. |
| 9. Turken O, Kunter E, Sezer M, Solmazgul E, Cerrahoglu K, Bozkanat E, et al. Hemostatic changes in active pulmonary tuberculosis. Int J Tuberc Lung Dis 2002; 6: 927 - 32. |
| 10. Bokri K, Saissy JM, Benomar S, Okheira H, Dimou M, Ducourau JP. Tuberculose anorectale révélée par une thrombose hémorroïdaire. Med Trop 1986;46: 75 - 7. |
| 11. Abdelkarim S. Spondylodiscite tuberculeuse compliquée d’une ischémie aiguë des membres inférieurs à propos d’un cas. Pan Afr Med J 2011;8:45. |
| 12. Boué F. Cytokines et syndrome inflammatoire. In: Galanaud P, Emilie D, editors. Cytokines et médecine interne. Paris: Masson; 1997. |
| 13. Akpan PA, Akpotuzor JO, Akwiwu EC. Some haematological parameters of tuberculosis (TB) infected Africans: the Nigerian perspective. J Natural Sci Res 2012; 2:50 - 7. |
| 14. Koster T, Vandenbroucke JP, Rosendaal FR. Venous thrombosis due to poor anticoagulant response to activated protein C: Leiden thrombophilia study. Lancet 1993; 342:1503 - 6. |
| 15. Nwankwo EO, Kwaru A, Ofulu A, Babashani M. Haematological changes in tuberculosis in Kano, Nigeria. J Med Lab Sci 2005; 14:35-9. |
| 16. Gogna A, Pradhan GR, Sinha RS, Gupta B. Tuberculosis presenting as deep vein thrombosis. Postgrad Med J 1999; 75:104-5. |
| 17. Ben Amar J, B. Dahri, H. Aouina, H. Bouacha. Maladie veineuse thromboembolique au cours de la tuberculose. Rev Pneumol Clin (2015), 515: 1-8 |
| 18. Mark PL, Ashok PP, Deshpande RB, Mahashur AA. A patient with hypercoagulable state due to tuberculosis. Indian J Chest Dis Allied Sci 2009; 51:49-51. |
| 19. Andus T, Bauer J, Gerok W. Effects of cytokines on liver. Hepatology 1991; 13:364 -75. |
| 20. Raschilas F, Mortier E, Combe A, Grasland A, Pouchot J, Vinceneux P. Rifampicine et thrombose veineuse. Rev Med 2001; 22:485 - 6. |
| 21. Goncalves IM, Alves DC, Carlvalho A, Ceu Brito M, Calvario F, Duarte R. Tuberculosis and venous thromboembolisme: a case series. Cases J 2009;16:9333. |
| 22. Gaudelus J. Dans quels cas penser à la tuberculose chez l’enfant? Med Mal Inf 2003; 33:135s - 40s. |
| 23. Antoun F, Momas I, Vieu V, Poinsard R, Crespy M. Suivi épidémiologique des cas de tuberculose dans les centres médico-sociaux de Paris. Rev Mal Respir 1998; 15:171-76. |
| 24. Bishav M, Anil K, Jagdeep W, Vineet M. Pulmonary embolism in cases of pulmonary tuberculosis: a unique entity. Indian J Tuberc 2011;58:84-7 |
| 25 Ousehal A, Essadki O, Abdelouafi A, Kadiri R. Tuberculose de la veine cave supérieur. Aspects radiologiques. À propos de 28 cas. Ann Radiol 1993;36:303-09. |
| 26. Kuwajerwala NK, Bapt RD, Joshi AS. Mesenteric vasculopathy in intestinal tuberculosis. Indian J Gastroenterol 1997; 16:134-36. |
| 27. Russo D, Minutolo R, accarino I, Andreucci M. Gross hematuria of uncommon origin: the nutcracker syndrome. Am J Kidney Dis 1998; 32: E3. |
| 28. El Fekih L, Oueslati I, Hassene H, Fenniche S. Association deep veinous thrombosis with pulmonary tuberculosis. Tunis Med 2009; 87:328—9. |
| 29. H, Habibech S, Zendah I, Elmjendel I, Ghedira H. Pulmonary embolism and tuberculosis. Asian Cardiovasc Thorac Ann 2013;0:1-4. |
| 30. Zhioua R, Sbeai L, Kriaa L, El Euch M, Mabrouk S, Ouartani A. Facteurs de risque et étiologies des occlusions veineuses rétiniennes. Tunis Med 1995; 73:133 -36. |
| 31. Hara K, Tsuzuki T, Takagi N. Nodular granulomatous phlebitis of the skin: a fourth type of tuberculide. Histopathology 1997;30:129 -34. |
| 32. Bourguignon L, Golfier L, Chatillon F, Bontemps H, Brantus JF. Interaction entre l’acénocoumarol et la rifampicine : présentation d’un cas et des mécanismes pharmacocinétiques mis en jeu. J Pharmacie Clin 2006; 25:105 -09. |
| 33. Schuetz EG, Schinkel AH, Relling MV, Schuetz JD. P glycoprotein: a major determinant of rifampicin-inducible expression of cytochrome P4503A in mice and humans. Proc Natl Acad Sci USA 1996;93:4001-05. |
| 34. Levêque D, Jehl F. Rifampicine et P-glycoprotéine : un nouveau mécanisme d’interaction pharmacocinétique. J Pharm Clin 2001;20: 219 – 23 |
ARTICLE INFO DOI: 10.12699/jfvpulm.16.49.2025.41
Conflict of Interest
Non
Date of manuscript receiving
10/03/2025
Date of publication after correction
06/07/2025
Article citation
Soumaré, T. Kanouté, K. Ouattara, B. Baya, S. Koné, FB. Sanogo, I. Guindo, S. Satao, G. Djigandé, O. Toto, Y. Toloba. Tuberculosis and thromboembolic and venous diseases: epidemiological, clinical, therapeutic and evolutionary aspects at the Pneumophtisiology Department of Point-G University Hospital. J Func Vent Pulm 2025;49(16):41-47