
 English
English
 French
French
Diagnosis and Management of Malignant Pleural Mesothelioma at Bar-le-Duc Hospital, Meuse Department, French Republic (About 4 Cases)
Diagnostic et prise en charge du mésothéliome pleural malin au centre hospitalier de Bar le Duc département de la Meuse République Française (À propos de 4 cas)
TH Diallo1,2, D Touré1,2, A Camara1,2, BD Diallo1.2 ,,OH Diallo1,2,AO Barry1,2, MH Camara1,2 M Tall1,A B Diallo2 ,LM Camara1,2.
1-Université Gamal Abdel Nasser de Conakry, Faculté des sciences et techniques de la santé
2- Hôpital national Ignace Deen, Service de Pneumologie
Corresponding author:
Thierno Hassane DIALLO
Mail: hassane2.gnaly@gmail
DOI: 10.12699/jfvpulm.16.50.2025.60
ABSTRACT
Malignant pleural mesothelioma presents a real challenge in terms of both diagnosis and management. We present the case of four patients with malignant pleural mesothelioma in the pneumology department of the bar le duc hospital in the Meuse department of France. The diagnosis of malignant pleural mesothelioma was made during thoracoscopy and the histological type was epithelioid in all our patients. Two of our patients received chemotherapy combining Cisplatin/pemetrexed as standard first-line treatment, at the cost of haematological toxicity in the form of grade II anaemia and non-febrile neutropenia. The other two patients received exclusive supportive care with analgesics and anxiolytics, given their advanced age and chronic renal failure. The median overall survival of our patients was 17 months.
RÉSUMÉ
Le mésothéliome pleural malin constitue un réel défi tant au niveau du diagnostic qu’au niveau de la prise en charge. Nous présentons le cas de quatre patients ayant un mésothéliome pleural malin au service de pneumologie du centre hospitalier de bar le duc département de la Meuse république de la France. Le diagnostic du mésothéliome pleural malin est posé lors d’une thoracoscopie et le type histologique épithélioide chez tous nos patients. Deux de nos patients ont bénéficiés une chimiothérapie associant Cisplatine/pemetrexed traitement standard en première ligne au prix d’une toxicité hématologique par une anémie de grade II et une neutropénie non fébrile. Les deux autres patients ont bénéficié un soin de support exclusif par des antalgiques et anxiolytiques compte tenu de l’âge avancé et de l’insuffisance rénale chronique. La survie globale médiane de nos patients était de 17 mois.
INTRODUCTION
Le mésothéliome pleural malin constitue un réel défi tant au niveau du diagnostic qu’au niveau de la prise en charge [1]. C’est un cancer primitif développé à partir d'une séreuse, le plus souvent la plèvre, de façon moins fréquente le péritoine et exceptionnellement le péricarde, la tunique vaginale et testiculaire [2,3]. Son facteur étiologique principal est l’exposition à l’amiante, avec une latence d’apparition de quinze à quarante ans [4]. L'Organisation mondiale de la santé estime que 125 millions de personnes sont exposées à l'amiante chaque année dans le monde, à la fois sur leur lieu de travail et à la maison. Malgré les preuves scientifiques fournissant une association claire et forte entre l'amiante et les mésothéliome pleural malin, de nombreux pays occidentaux et des économies nouvellement industrialisées utilisent encore l'amiante [5]. D'autres facteurs étiologiques ont été mis en cause : exposition aux radiations ionisantes ; rôle possible mais très discuté du virus simien SV40 accidentellement inoculé entre 1959 et 1961 par le biais de la contamination des vaccinations anti-poliomyélite essentiellement aux USA et en Grande-Bretagne, des facteurs génétiques sont en train d’émerger notamment avec la perte d'expression de BAP1, ou protéine associée à BRCA1 [2].
Les signes d’appel cliniques et radiologiques d’un mésothéliome pleural malin sont peu spécifiques et apparaissent souvent à un stade avancé de la maladie, même si leur association à une exposition à l’amiante (à toujours rechercher) peut-être évocatrice. Ces signes peuvent comprendre une dyspnée, des douleurs thoraciques, une rétraction hémi thoracique et/ou une pleurésie le plus souvent unilatérale [6]. Son diagnostic peut s’avérer complexe et repose sur une analyse histologique de prélèvements pleuraux qui doit être validée par un panel d’experts selon les recommandations. La qualité des prélèvements pleuraux représente la pierre angulaire pour cette analyse anatomopathologique et la thoracoscopie médicale ou chirurgicale est l’examen de référence pour le recueil de ces fragments pleuraux, en permettant des biopsies profondes et de taille suffisante en toute sécurité et une analyse histologique complète [7,8].
De nouvelles pistes thérapeutiques et l’amélioration globale de la survie des patients atteints d’un mésothéliome pleural malin expliquent le regain d’intérêt pour cette maladie, naguère considérée comme orpheline de tout traitement efficace [9]. Des recommandations européennes de l’European Respiratory Society (ERS)/European Society of Thoracic Surgeons (ESTS) en 2010 et australiennes (coordonnées par l’Asbestos Diseases Research Institute) en 2013 ont mieux précisé la prise en charge du mésothéliome. La chimiothérapie par cisplatine et pémétrexed (Cis/ Pem, six cycles), quoique peu efficace, reste le traitement standard de première ligne pour toutes les recommandations internationales [10]. Sa prise en charge thérapeutique et son pronostic modifiés ces dernières années par le développement de traitements efficaces agressifs associant une chirurgie de cytoréduction maximaliste et une chimiothérapie hyperthermique intrapéritonéale. C’est la raison pour laquelle son diagnostic précis est important afin d’identifier au mieux les patients susceptibles de bénéficier de cette approche thérapeutique [11]. Nous rapportons quatres (4) observations cliniques de mésothéliome pleural malin diagnostiquées au service de pneumologie du centre hospitalier de bar le duc département de la Meuse république de la France afin de clarifier les difficultés des moyens diagnostiques, de prise en charge de cette pathologie.
OBSERVATIONS
Cas clinique n° 1
Il s’agissait d’un patient de 63 ans qui a travaillé dans une fonderie, adressé au service de Pneumologie du centre hospitalier du bar le duc pour suite de prise en charge d’une pleurésie séro-hématique. Il était reçu dans un tableau clinique de dyspnée d’aggravation progressive, associée à une douleur basithoracique droite intense, une toux sèche sans fièvre sans frissons ni sueurs profuses. Comme principaux antécédents tabagisme à 15 PA actif, pas d’éthylisme, une diverticulose colique, hémi colectomie, splénectomie post accident de voie publique (AVP), fracture du fémur gauche, méniscectomie. A l’examen clinique le patient présentait un état général peu satisfaisant avec PS à 1. La tension artérielle était à 120/70 mm Hg, le pouls à 90 battements/ mn, la température à 36,2°C, la fréquence respiratoire à 24 cycles/mn et l’IMC à 28,38 Kg/m2. L’examen physique objectivait un syndrome d’épanchement liquidien pleural droit de moyenne abondance, les aires ganglionnaires étaient libres
Biologie : les globules blancs à 11 Giga/L, hémoglobine à 11 g/L, les poly nucléaires neutrophiles à 6,5 Giga/l, les plaquettes à 625/mm3 et la CRP à 116 mg /l
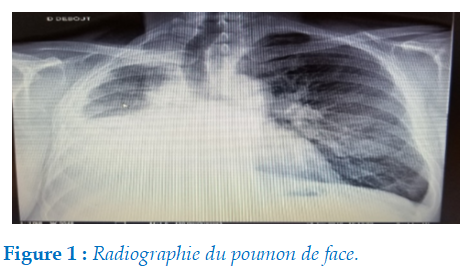
Radiographie thoracique : Montre une opacité dense homogène de type pleural intéressant les 2/3 inférieurs du champ pulmonaire droit à limite supérieure concave avec rétraction de la trachée (flèche) sans déplacement du médiastin (figure 1).
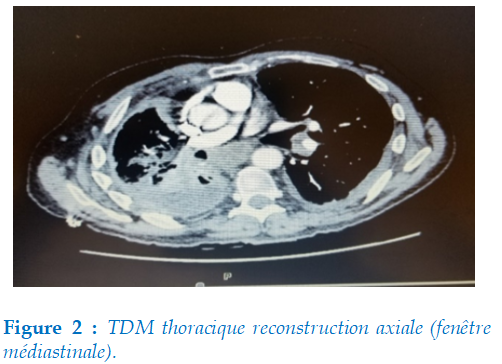
Scanner thoraco-abdomino-pelvien : avait objectivé un épanchement pleural droit (flèche), un épaississement pleural irrégulier diffus à 4 mm (flèche) sans déplacement du médiastin sans adénopathies avec une plaque pleurale (figure 2).
La ponction pleurale : avait ramené un liquide sérohématique avec des leucocytes à 1140 éléments /mm3, constitué de 55% de neutrophiles, 18% de lymphocytes et 4% de monocytes. La recherche directe de bacille acido-alcoolo-résistant (BAAR) dans le liquide pleural était négative. Le liquide pleural était exsudatif avec 48 g/L de protéine, une glycopleurie à 0,03 g/L, un taux de LDH à 2122 UI/L et une amylo-pleurie à 122.
L’endoscopie bronchique : était normale
Thoracoscopie : Du poumon droite avait révélé une masse envahissant les plèvres pariétale et viscérale, l’examen anatomopathologie des biopsies pleurales montrait une plèvre pariétale épaissie inflammatoire. Analyse immunohistochimie avait mis en évidence un mésotheliome pleural malin epithelioide
TDM cérébrale : était normal.
Selon la Classification de l’IMGI (International Mesothelioma Interest Group), le patient était stade IB au moment du diagnostic.
Traitement : Repose sur l'association cisplatine 75 mg/m2 – pemetrexed 500 mg/m2 administrée toutes les 3 semaines avec une supplémentation vitaminique B12 (1000 μg par voie IM toutes les 9 semaines) et B9 (350 μg/jour) débuter 7 jours avant le début de la chimiothérapie au prix d’une toxicité hématologique. Suivie une maintenance par bevacizamab la réévaluation après la 6eme cure montre une progression, une deuxième ligne administrée par pemetrexed 500 mg/m2 progression à nouveau.
L’évolution : était marquée par l’accentuation de la douleur thoracique droite, devenue rebelle aux traitements antalgiques et la survenue de métastases au point de drainage malgré la radiothérapie par irradiation thoracique sur le trajet des ponctions et de la thoracoscopie la dose totale était de 21 Gy répartie en 3 séances. Cette radiothérapie a été bien toléré. Après 6 cycles de traitement, le patient avait présenté une neutropénie non fébrile et une anémie chimio induite de
grade II une avec altération de l’état général qui avait nécessité l’arrêt de la chimiothérapie pour des transfusions sanguines. Il était décédé après 17 mois dans un état de cachexie et de détresse respiratoire.
Cas clinique n° 2
Il s’agissait d’un patient de 58 ans, qui a travaillé comme ouvrier dans la réparation navale, adressé au service pneumologie du centre hospitalier du bar le duc pour suite de prise en charge d’une pleurésie jaune citrin, reçu dans un tableau clinique fait de dyspnée, de douleur thoracique droite, d’une toux sèche, pas de fièvre, un amaigrissement progressif, une asthénie physique. Comme principaux antécédents il est non-fumeur et ne boit pas d’alcool, une rupture de la coiffe des rotateurs, un érysipèle et une appendicectomie. A l’examen clinique le patient présentait un état général peu satisfaisant avec PS à 1, avec les paramètre suivants La tension artérielle était à 11/60 mm Hg, le pouls à 88 battements/ mn, la température à 37,4°C, la fréquence respiratoire à 28 cycles/mn et l’IMC à 23,66 Kg/m2. L’examen physique objectivait un syndrome d’épanchement liquidien pleural droit de grande abondance. Les aires ganglionnaires étaient libres
Biologie : les globules blancs à 15 Giga/L hémoglobine à 11,5 g/L les poly nucléaires neutrophiles à 9,5 Giga/l, les plaquettes à 698/mm3 la CRP à 54 mg /l
Radiographie thoracique : Avait montré une opacité homogène de type pleural intéressant le champ pulmonaire droit à limite supérieure concave sans déplacement du médiastin (figure 11).
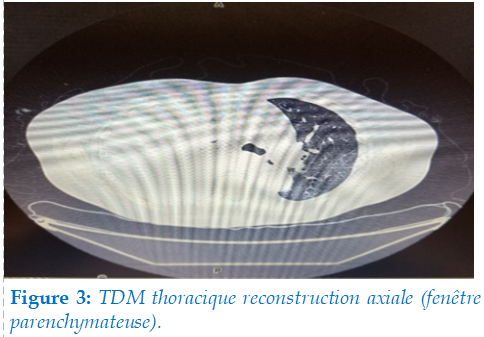
Scanner thoraco-abdomino-pelvien : objectivait un épanchement pleural droit important (flèche) un avec un léger déplacement du médiastin des adénopathies hilaire droit sans plaque pleural (figure 3).
Ponction pleurale : Ramène un liquide jaune citrin avec des leucocytes à 1002 éléments /mm3, constitué de 46% de neutrophiles, 20% de lymphocytes et 3% de monocytes. La recherche directe de bacille acido-alcoolo-résistant (BAAR) dans le liquide pleural était négative. Le liquide pleural était exsudatif avec 39 g/L de protéine, une glycopleurie à 0,04 g/L, un taux de LDH à 1800 UI/L (> à 10 N) et une amylo-pleurie à 300.
Thoracoscopie : Des biopsies larges, profondes (jusqu’à la graisse sous-pleurale) est nombreuses sont réalisées sur la plèvre pariétale avec un type histologique après immunohistochimie mésotheliome pleural malin epithelioide.
Selon la Classification de l’IMGI (International Mesothelioma Interest Group), le patient était stade IB au moment du diagnostic.
Traitement : Association cisplatine 75 mg/m2 – pemetrexed 500 mg/m2 administrée toutes les 3 semaines avec une supplémentation vitaminique B12 (1000 μg par voie IM toutes les 9 semaines) et B9 (350 μg/jour) débuter 7 jours avant le début de la chimiothérapie au prix d’une toxicité hématologique. Suivie une maintenance par bevacizamab la réévaluation après la 3eme cure montre une progression controlatérale, une deuxième ligne administrée par pemetrexed 500 mg/m2 progression à nouveau une troisième ligne par gemcitabine avec une progression abdominale.
L’évolution : Etait marquée par l’accentuation de la douleur thoracique bilatérale et abdominale, devenue rebelle aux traitements antalgiques de palier I, II et III et Après 6 cycles de traitement, le patient avait présenté une anémie chimio induite de grade II une anémie avec altération de l’état général qui avait nécessité l’arrêt de la chimiothérapie pour des transfusions sanguines. Patient décédé après 16 mois de soins palliatif par l’équipe mobile se soins palliatif à domicile dans un tableau de détresse respiratoire.
Cas clinique n° 3
Il s’agissait d’une patiente de 88 ans ménagère, référé au service de pneumologie de bar le duc pour suite de prise en charge d’une pleurésie gauche dans un contexte clinique fait de dyspnée, de douleur thoracique, d’une toux sèche et une asthénie. Comme antécédents la patiente et ni tabagique ni éthylique avec un abcès cutané, un pneumothorax gauche, un accident de voie publique avec facture costale, un carcinome basocellulaire de la cheville droite opéré en 2018 et prothèse de genou gauche. L’examen clinique met en évidence une PS à 2, avec les paramètres suivants : Une tension artérielle était à 13/7 mm Hg, le pouls à 70 battements/ mn, la température à 37,6°C, la fréquence respiratoire à 25 cycles/mn l’IMC à 26,37 Kg/m2 et un syndrome pleural droit, l’examen cardio-vasculaire est normal, il n’y a pas d’adénopathies
Biologie : les globules blancs à 8,1 Giga/L hémoglobine à 14 g/L les poly nucléaires neutrophiles à 5,8 Giga/l, les plaquettes à 216/mm3 la CRP à 15 mg /l
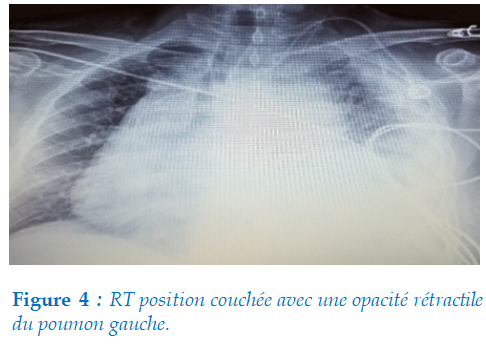
Radiographie thoracique : Une opacité rétractile intéressant le champ pulmonaire gauche en position couchée (figure 4).
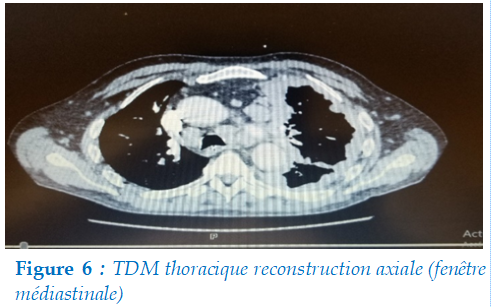
Scanner thoraco-abdomino-pelvien : objectivait un épanchement pleural droit minime, un épaississement pleural diffus à 10 mm (flèche) avec un léger déplacement du médiastin des adénopathies hilaires controlatérales sans plaque pleural (figure 6).
Ponction pleurale : Ramène un liquide jaune citrin avec des leucocytes à 1022 éléments /mm3, constitué de 44% de neutrophiles, 17% de lymphocytes et 5% de monocytes. La recherche directe de bacille acido-alcoolo-résistant (BAAR) dans le liquide pleural était négative. Le liquide pleural était exsudatif avec 36 g/L de protéine, une glycopleurie à 0,07 g/L, un taux de LDH à 2002 UI/L et une amylo-pleurie à 250.
Thoracoscopie : Des biopsies larges, profondes est nombreuses sont réalisées sur la plèvre pariétale avec un type histologique après immunohistochimie mésothéliome pleural malin epithelioide.
Selon la Classification de l’IMGI (International Mesothelioma Interest Group), le patient était stade IIIB au moment du diagnostic.
Traitement : prise en charge exclusivement palliative en tenant compte de l’âge et l’état général de la patiente contre indiquant à toute chimiothérapie
L’évolution : Patient vivant suivi par l’équipe mobile de soin palliatif au dernière nouvelle.
Cas clinique N 4
Il s’agissait d’un patient de 79 ans cariste de fonderie adressé au service de Pneumologie du centre hospitalier de bar le duc pour suite de prise en charge d’une pleurésie séro-hématique. Il était reçu dans un tableau clinique de dyspnée permanente associée à une douleur basithoracique droite intense sans fièvre sans frissons ni sueurs profuses. Dans ces antécédents il était tabagique actif ni éthylique avec hypertrophie bénigne de la prostate, ACFA, insuffisance cardiaque néphropathie diabétique (insuffisance rénale chronique). A l’examen clinique le patient présentait un état général peu satisfaisant avec PS à 2. La tension artérielle était à 100/70 mm Hg, le pouls à 90 battements/ mn, la température à 37,2°C, la fréquence respiratoire à 22 cycles/mn et l’IMC à 22,89 Kg/m2. L’examen de l’appareil pleuropulmonaire met en évidence un épanchement liquidien droit de grande abondance, aires ganglionnaires étaient libres
Biologie : les globules blancs à 6,7 Giga/L hémoglobine à 8,7 g/L les poly nucléaires neutrophiles à 4,5 Giga/l, les plaquettes à 389/mm3 la CRP à 73 mg /l
Radiographie thoracique : Une opacité type pleural intéressant tout le champ pulmonaire droit avec déplacement du médiastin.
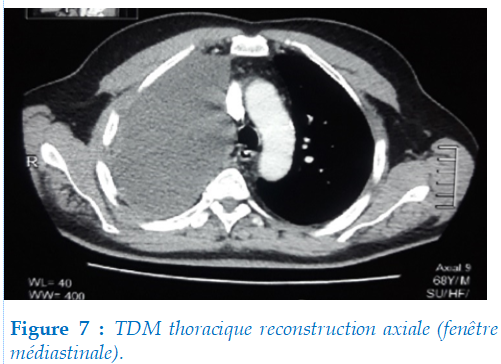
Scanner thoraco-abdomino-pelvien non injecté : objectivait un épanchement pleural droit de grande abondance (flèche) sans épaississement pleural avec un léger déplacement du médiastin sans plaque pleural (figure 7).
Ponction pleurale : Ramène un liquide jaune citrin avec des leucocytes à 1101 éléments /mm3, constitué de 45% de neutrophiles, 22% de lymphocytes et 5% de monocytes. La recherche directe de bacille acido-alcoolo-résistant (BAAR) dans le liquide pleural était négative. Le liquide pleural était exsudatif avec 37 g/L de protéine, une glycopleurie à 0,06 g/L, un taux de LDH à 1766 UI/L et une amylo-pleurie à 299 (normale=138-404).
Thoracoscopie : Des biopsies larges, profondes est nombreuses sont réalisées sur la plèvre pariétale avec un type histologique après immunohistochimie mésotheliome pleural malin epithelioide.
Selon la Classification de l’IMGI (International Mesothelioma Interest Group), le patient était stade IIIB au moment du diagnostic.
Traitement : Prise en charge exclusivement palliative en tenant compte de l’âge et l’état général et de l’insuffisance rénale chronique contre indiquant à toute chimiothérapie
L’évolution : Patient vivant suivi par l’équipe mobile de soin palliatif au dernière nouvelle.
DISCUSSION
Dans notre travail le mésotheliome pleural malin représente 2 cas par an sur une période deux années au service de pneumologie centre hospitalier de bar le duc taux supérieur à celui d’un cas par an sur une période 8 ans trouvé dans l’étude Haita Abdelkrim au service d’oncologie du centre hospitalier universitaire Hassan II entre 2011 et 2018 [40]. Le fait que nous avons colligé 2 cas de mésothéliome pleural malin sur une période de 2 ans prouve la rareté de cette maladie et cela est également rapportée dans plusieurs autres travaux [32,41,42]. Les patients de sexe masculin étaient les plus nombreux dans notre travail soit 3(75%) de nos patients. Cette tendance se retrouve aussi dans d’autres travaux, ainsi dans une étude marocaine en 2017 sur 31 cas mésothéliome pleural malin 72 % des patients étaient de sexe masculin [43]. En France, dans une étude réalisée en 2016, parmi les 1890 patients inclus 76 % des patients était de sexe masculin [44]. Cela s’explique pour des raisons d'exposition professionnelle. Le ratio sexe homme femme était de 3 hommes pour 1 femme. Ce taux est superposable à celui de l’étude de Hilou J et coll [45] soit 2,2 et plus bas par rapport à l’étude Mlika M et coll [1] soit 6,5.
La survenue d'un mésothéliome pleural malin est en effet étroitement liée à une exposition à l'amiante, retrouvée dans 70% des cas [2]. L’exposition de l’amiante est trouvée dans 3 (75%) de cas dans notre travail, taux superposable à ceux de Maiouak S et coll [46] et de Mlika M et coll [1] soit respectivement 70% et 69% de cas, inférieur à celui de Mahboub FZ [47] soit 100% de cas. L’un de facteur de comorbidité est le tabagisme qui représente 50 % des cas de nos patients proche de celui de Mlika M soit 57% de cas [1] supérieur à celui Haita Abdelkrim au Maroc soit 37,5 % de cas [40]. Peu de nos patients avaient des pathologies respiratoires sous-jacentes comme dans l’étude Camille en France [26]. Les symptômes cliniques révélateurs du mésothéliome pleural malin rapportés dans notre travail sont ceux observées dans plusieurs autres travaux [2,43,48,49], à savoir principalement la dyspnée, la douleur thoracique et la toux. 50% de nos patients avaient un statut OMS à 1 diffèrent de celui de Camille Munck en France [26] avec une performance statut OMS à 1 à 95 % de cas mais identique de celui Haita Abdelkrim au Maroc avec une performance statut OMS à 2 à 50 % des cas [40]. L’examen clinique a retrouvé un syndrome d’épanchement pleural liquidien chez tous nos patients, comme il est classiquement décrit dans la littérature [48]. Diffèrent de celui de Mlika M et coll [1] soit 30 % de cas.
Le téléthorax objectivait une opacité de type pleural dans 100 % de cas ce qui est identique à ceux trouvé par Mahboub FZ et coll [47] et de Najah L et coll [50], la radiographie pulmonaire garde une place importante dans le diagnostic du mésothéliome pleural. Le scanner thoracique dans notre travail retrouvait un épaississement pleural dans 50 % de cas, des adénopathies médiastinales dans 25% de cas, d’épanchement pleural liquidien dans 100 % de cas et de plaque pleural dans 25% de cas contrairement dans le travail M. Haita Abdelkrim au Maroc [40], les scanners thoraciques étudiés, avait montré un épanchement pleural et un épaississement pleural chez 75% des cas, des adénopathies médiastinales chez 50 % de cas. Le scanner thoracique est l’examen de référence d’imagerie du mésothéliome pleural maligne de sa stadification et de son suivi. Les biopsies pleurales ayant conduit au diagnostic de mésotheliome pleural malin dans notre travail ont été réalisées à 100 % lors d’une thoracoscopie ce qui n’est pas le cas pour plusieurs autres travaux. Seulement 56% de cas dans l’étude Elatiqi K et coll [48] et 19% de cas de celui de Mahboub FZ [47]. La thoracoscopie médicale ou chirurgicale reste le meilleur examen pour un diagnostic histologique de certitude de mésothéliome pleural malin.
L’examen microscopique de notre travail a conclu à un mésothéliome pleural malin epithelioide dans 100% de cas superposable de ceux de Helou J et coll [45] et de Mlika M et coll [1] soit respectivement 83% et 57% de cas. Toujours majoritaire sur l’ensemble de type histologique, ce qui n’est pas surprenant parce que le sous type histologique épithélioïde est plus fréquents et constitue un critère de bon pronostic [22].
Dans notre travail un seul patient a bénéficié d’un bilan d’extension cérébral par une imagerie par résonnance magnétique sans particularité, ce taux faible est identique dans l’étude de Mlika M et coll [1] soit 4 malades sur l’ensemble des patients par un scanner cérébral et sans particularité. Au fait, l’imagerie cérébrale n’est justifiée que devant une symptomatologie clinique évocatrice d’une atteinte encéphalique. La fibroscopie bronchique n’était pas contributive dans notre travail. Seulement dans des cas exceptionnels que le diagnostic est possible par biopsie bronchique ou transbronchique à la pince à biopsie standard, en cas d’extension du mésothéliome pleural malin au parenchyme pulmonaire et/ou aux structures trachéo-bronchiques [51]. Le stade clinique TNM dans nos patients représente 50% de cas de stade IIIB, 25% de cas de stade IA et 25% de cas de stade IB superposable dans les études de Helou j [45] et de Mlika [1] soit respectivement 49 % de cas de stade IIIB et 47% de cas de stade IIIB. En effet, selon un large essai randomisé de phase 3, l’association cisplatine + pemetrexed était
significativement plus efficace qu’une mono-chimiothérapie par cisplatine seul chez des patients PS 0‑1 [1]. 50 % de nos patients soit deux patients sur quatre ont reçu l’association Cisplatine/pemetrexed en première ligne de chimiothérapie avec une performance statut OMS à 1. Cette association Cisplatine/pemetrexed a démontré qu’elle pouvait améliorer la qualité de vie et le symptôme de dyspnée chez ces patients, et est donc recommandée en première ligne jusqu’à progression, ou toxicité de grade 3-4.
Par contre l’étude ouverte, randomisée, de phase 3 (CheckMate 743) menée dans 103 hôpitaux de 21 pays par nivolumab plus ipilimumab a apporté des améliorations significatives et cliniquement significatives de la survie globale par rapport à la chimiothérapie standard, soutenant l'utilisation de ce schéma thérapeutique de premier plan qui a été approuvé aux États-Unis en octobre 2020, pour le mésotheliome pleural malin non résécable non traité auparavant ; ce qui n’est toujours pas le cas en France [52]. Aucun médicament innovant n'a été validé dans le MPM depuis 2009. Le groupe de travail conjoint ERS / ESTS / EACTS / ESTRO recommande une association chimiothérapie de première intention composée de platine et de pémétrexed (avec supplémentation en acide folique et vitamine B12) chez les patients aptes à une chimiothérapie [53] appliquée dans ce travail. La radiothérapie est principalement utilisée à visée palliative antalgique [1], dans notre étude un seul patient a bénéficié d’une radiothérapie à visée antalgique par irradiation thoracique sur le trajet des ponctions et de la thoracoscopie. La dose totale était de 21 Gy répartie en 3 séances. Cette radiothérapie est bien tolérée Les deux autres patients sur les quatre sont vivants avec une prise en charge exclusivement palliative en tenant compte de l’âge et l’état général de l’une de patiente et de l’insuffisance rénale chronique chez l’autre contre indiquant toute chimiothérapie. Les soins de support doivent être systématiquement entrepris dès la prise en charge, avec une réévaluation périodique, notamment pour le traitement antalgique. Les formes inflammatoires avec atteinte de l'état général (PS > 2) ne relèvent que des soins de support [2]. Dans notre étude nous avons eu recourt aux antalgiques du palier I et II pour 2 patients avec soins palliatif exclusifs représentés par le paracétamol, le tramadol à libération prolongé (LP) et le palier III pour les deux autres patients sous chimiothérapie représentés par la morphine et dérivée (oxycodone LP, oxynormoro en interdose). Tous les patients ont bénéficié à 100% d’un traitement anxiolytique.
Nous avons enregistré un décès qui était suivi en HAD (hospitalisation à domicile) suite à une progression en deux ligne du traitement par gemcitabine plus une toxicité médicamenteuse hématologique (anémie de grade II et une neutropénie chimio induite). Les 3 autres sont vivant suivi par l’équipe mobile de soin palliatif au dernière nouvelle.
DISCUSSION
Dans notre travail le mésothéliome pleural malin représente 2 cas par an sur une période deux années au service de pneumologie centre hospitalier de bar le duc taux supérieur à celui d’un cas par an sur une période 8 ans trouvé dans l’étude Haita Abdelkrim au service d’oncologie du centre hospitalier universitaire Hassan II entre 2011 et 2018 [12]. Le fait que nous avons colligé 2 cas de mésothéliome pleural malin sur une période de 2 ans prouve la rareté de cette maladie et cela est également rapportée dans plusieurs autres travaux [13,14,15]. Les patients de sexe masculin étaient les plus nombreux dans notre travail soit 3(75%) de nos patients. Cette tendance se retrouve aussi dans d’autres travaux, ainsi dans une étude marocaine en 2017 sur 31 cas mésothéliome pleural malin 72 % des patients étaient de sexe masculin [16]. En France, dans une étude réalisée en 2016, parmi les 1890 patients inclus 76 % des patients était de sexe masculin [17]. Cela s’explique pour des raisons d'exposition professionnelle. Le ratio sexe homme femme était de 3 hommes pour 1 femme. Ce taux est superposable à celui de l’étude de Hilou J et coll [18] soit 2,2 et plus bas par rapport à l’étude Mlika M et coll [1] soit 6,5.
La survenue d'un mésothéliome pleural malin est en effet étroitement liée à une exposition à l'amiante, retrouvée dans 70% des cas [2]. L’exposition de l’amiante est trouvée dans 3 (75%) de cas dans notre travail, taux superposable à ceux de Maiouak S et coll [19] et de Mlika M et coll [1] soit respectivement 70% et 69% de cas, inférieur à celui de Mahboub FZ [20] soit 100% de cas. L’un de facteur de comorbidité est le tabagisme qui représente 50 % des cas de nos patients proche de celui de Mlika M soit 57% de cas [1] supérieur à celui Haita Abdelkrim au Maroc soit 37,5 % de cas [12]. Peu de nos patients avaient des pathologies respiratoires sous-jacentes comme dans l’étude Camille en France [21]. Les symptômes cliniques révélateurs du mésothéliome pleural malin rapportés dans notre travail sont ceux observées dans plusieurs autres travaux [2,16,22,23], à savoir principalement la dyspnée, la douleur thoracique et la toux. 50% de nos patients avaient un statut OMS à 1 diffèrent de celui de Camille Munck en France [21] avec une performance statut OMS à 1 à 95 % de cas mais identique de celui Haita Abdelkrim au Maroc avec une performance statut OMS à 2 à 50 % des cas [12]. L’examen clinique a retrouvé un syndrome d’épanchement pleural liquidien chez tous nos patients, comme il est classiquement décrit dans la littérature [22]. Diffèrent de celui de Mlika M et coll [1] soit 30 % de cas.
Le téléthorax objectivait une opacité de type pleural dans 100 % de cas ce qui est identique à ceux trouvé par Mahboub FZ et coll [20] et de Najah L et coll [24], la radiographie pulmonaire garde une place importante dans le diagnostic du mésothéliome pleural. Le scanner thoracique dans notre travail retrouvait un épaississement pleural dans 50 % de cas, des adénopathies médiastinales dans 25% de cas, d’épanchement pleural liquidien dans 100 % de cas et de plaque pleural dans 25% de cas contrairement dans le travail M. Haita Abdelkrim au Maroc [12], les scanners thoraciques étudiés, avait montré un épanchement pleural et un épaississement pleural chez 75% des cas, des adénopathies médiastinales chez 50 % de cas. Le scanner thoracique est l’examen de référence d’imagerie du mésothéliome pleural maligne de sa stadification et de son suivi. Les biopsies pleurales ayant conduit au diagnostic de mésotheliome pleural malin dans notre travail ont été réalisées à 100 % lors d’une thoracoscopie ce qui n’est pas le cas pour plusieurs autres travaux. Seulement 56% de cas dans l’étude Elatiqi K et coll [22] et 19% de cas de celui de Mahboub FZ [20]. La thoracoscopie médicale ou chirurgicale reste le meilleur examen pour un diagnostic histologique de certitude de mésothéliome pleural malin.
L’examen microscopique de notre travail a conclu à un mésothéliome pleural malin epithelioide dans 100% de cas superposable de ceux de Helou J et coll [18] et de Mlika M et coll [1] soit respectivement 83% et 57% de cas. Toujours majoritaire sur l’ensemble de type histologique, ce qui n’est pas surprenant parce que le sous type histologique épithélioïde est plus fréquents et constitue un critère de bon pronostic [22].
Dans notre travail un seul patient a bénéficié d’un bilan d’extension cérébral par une imagerie par résonnance magnétique sans particularité, ce taux faible est identique dans l’étude de Mlika M et coll [1] soit 4 malades sur l’ensemble des patients par un scanner cérébral et sans particularité. Au fait, l’imagerie cérébrale n’est justifiée que devant une symptomatologie clinique évocatrice d’une atteinte encéphalique. La fibroscopie bronchique n’était pas contributive dans notre travail. Seulement dans des cas exceptionnels que le diagnostic est possible par biopsie bronchique ou transbronchique à la pince à biopsie standard, en cas d’extension du mésothéliome pleural malin au parenchyme pulmonaire et/ou aux structures trachéo-bronchiques [26]. Le stade clinique TNM dans nos patients représente 50% de cas de stade IIIB, 25% de cas de stade IA et 25% de cas de stade IB superposable dans les études de Helou j [18] et de Mlika [1] soit respectivement 49 % de cas de stade IIIB et 47% de cas de stade IIIB. En effet, selon un large essai randomisé de phase 3, l’association cisplatine + pemetrexed était significativement plus efficace qu’une mono-chimiothérapie par cisplatine seul chez des patients PS 0‑1 [1]. 50 % de nos patients soit deux patients sur quatre ont reçu l’association Cisplatine/pemetrexed en première ligne de chimiothérapie avec une performance statut OMS à 1. Cette association Cisplatine/pemetrexed a démontré qu’elle pouvait améliorer la qualité de vie et le symptôme de dyspnée chez ces patients, et est donc recommandée en première ligne jusqu’à progression, ou toxicité de grade 3-4.
Par contre l’étude ouverte, randomisée, de phase 3 (CheckMate 743) menée dans 103 hôpitaux de 21 pays par nivolumab plus ipilimumab a apporté des améliorations significatives et cliniquement significatives de la survie globale par rapport à la chimiothérapie standard, soutenant l'utilisation de ce schéma thérapeutique de premier plan qui a été approuvé aux États-Unis en octobre 2020, pour le mésotheliome pleural malin non résécable non traité auparavant ; ce qui n’est toujours pas le cas en France [27]. Aucun médicament innovant n'a été validé dans le MPM depuis 2009. Le groupe de travail conjoint ERS / ESTS / EACTS / ESTRO recommande une association chimiothérapie de première intention composée de platine et de pémétrexed (avec supplémentation en acide folique et vitamine B12) chez les patients aptes à une chimiothérapie [28] appliquée dans ce travail. La radiothérapie est principalement utilisée à visée palliative antalgique [1], dans notre étude un seul patient a bénéficié d’une radiothérapie à visée antalgique par irradiation thoracique sur le trajet des ponctions et de la thoracoscopie. La dose totale était de 21 Gy répartie en 3 séances. Cette radiothérapie est bien tolérée
Les deux autres patients sur les quatre sont vivants avec une prise en charge exclusivement palliative en tenant compte de l’âge et l’état général de l’une de patiente et de l’insuffisance rénale chronique chez l’autre contre indiquant toute chimiothérapie. Les soins de support doivent être systématiquement entrepris dès la prise en charge, avec une réévaluation périodique, notamment pour le traitement antalgique. Les formes inflammatoires avec atteinte de l'état général (PS > 2) ne relèvent que des soins de support [2]. Dans notre étude nous avons eu recourt aux antalgiques du palier I et II pour 2 patients avec soins palliatif exclusifs représentés par le paracétamol, le tramadol à libération prolongé (LP) et le palier III pour les deux autres patients sous chimiothérapie représentés par la morphine et dérivée (oxycodone LP, oxynormoro en interdose). Tous les patients ont bénéficié à 100% d’un traitement anxiolytique. Nous avons enregistré un décès qui était suivi en HAD (hospitalisation à domicile) suite à une progression en deux ligne du traitement par gemcitabine plus une toxicité médicamenteuse hématologique (anémie de grade II et une neutropénie chimio induite). Les 3 autres sont vivant suivi par l’équipe mobile de soin palliatif au dernière nouvelle.
CONCLUSION
Il ressort de ce travail que la majorité de nos patients étaient exposée à l’amiante et présentaient des symptômes fonctionnels respiratoire de type de dyspnée, de toux et de douleur thoracique. Une réalisation d’une thoracoscopie médicale ou chirurgicale devant toute pleurésie persistante et récidivante permet un diagnostic et une prise en charge précoce du mésothéliome pleural malin modifiant ainsi son pronostic avec une amélioration globale de la survie des patients.
REFERENCES
| 1. Mlika M, Lamzirbi O, Limam M, Mejri N, Ben Saad S, Chaouch N, et al. Le profil anatomoclinique du mésothéliome pleural malin : une étude rétrospective à propos de 30 cas. Rev Pneumol Clin. déc 2018;74(6):427‑35. |
| 2. Dr. Myriam Locatelli-Sanchez, Dr. Virginie Avrillon, Pr. Arnaud Scherpereel, Pr. Gérard Zalcman. Mésothéliome pleural malin 17 éme édition. Référentiels Auvergne Rhône-Alpes en oncologie thoracique 2022. |
| 3. Scherpereel A, Willemin M-C, Wasielewski E, Dhalluin X. Immunothérapie anti-tumorale dans le mésothéliome pleural malin. Rev Mal Respir. avr 2018;35(4):465‑76. |
| 4. Fournel L, Janet-Vendroux A, Canny-Hamelin E, Mansuet-Lupo A, Guinet C, Bobbio A, et al. Mésothéliome pleural malin : place de la chirurgie. Rev Pneumol Clin. oct 2018;74(5):351‑8. |
| 5. Rossini M, Rizzo P, Bononi I, Clementz A, Ferrari R, Martini F, et al. New perspectives on diagnosis and therapy of malignant pleural mesothelioma. Front Oncol. 2018;8:91. |
| 6. Dhalluin X, Chahine B, Copin M-C, Lafitte J-J, Scherpereel A. Diagnostic et bilan du mésothéliome pleural malin. Rev Mal Respir Actual. oct 2009;1(4):444‑51. |
| 7. Guinde J, Laroumagne S, Kaspi E, Martinez S, Tazi-Mezalek R, Astoul P, et al. Échoendoscopie bronchique pour le diagnostic de mésothéliome pleural malin. Rev Mal Respir. sept 2015;32(7):750‑4. |
| 8. Jaouen A, Thivolet-Bejui F, Chalabreysse L, Piaton E, Traverse-Glehen A, Isaac S, et al. Apport de l’expression protéique de BRCA1 associated protein 1 (BAP1) dans le diagnostic des mésothéliomes malins diffus pleuraux : une analyse cytologique et histologique comparative sur une série de 50 patients. Ann Pathol. avr 2016;36(2):111‑9. |
| 9. Greillier L, Scherpereel A, Zalcman G. Prise en charge diagnostique et thérapeutique du mésothéliome pleural malin en 2020. Rev Mal Respir Actual. oct 2020;12(2):2S141‑9. |
| 10. Scherpereel A. Traitement du mésothéliome pleural malin en 2016. Rev Mal Respir Actual. sept 2016;8(5):445‑56. |
| 11. Mery É, Hommell-Fontaine J, Capovilla M, Chevallier A, Bibeau F, Croce S, et al. Mésothéliome malin péritonéal : mise au point et données actuelles. Ann Pathol. févr 2014;34(1):26‑33. |
| 12. Abdelkrim MH. Prise en charge du mésothéliome pleural malin Expérience du service d’oncologie du CHU Hassan II de Fès (A propos de 8 cas) Thèse de Médecine. Maroc-2019. |
| 13. Brosseau S, Gounant V, Mordant P, Khalil A, Cazes A, Zalcman G. Prise en charge diagnostique et thérapeutique du mésothéliome pleural malin en 2018. Rev Mal Respir Actual. 2018;10(3):340‑8. |
| 14. Chouaid C, Tournier C, Luciani L, Le Lay K, De Léotoing L. Estimation de la prévalence et de l’incidence du mésothéliome pleural malin en France (PMSI-MCO 2016). Rev DÉpidémiologie Santé Publique. 2018;66: S223. |
| 15. Ziouziou I, Karmouni T, El Khader K, Koutani A, Andaloussi AIA. Mésothéliome paratesticulaire malin: cas clinique et revue de la littérature. Can Urol Assoc J. 2015;9(7‑8):E565. |
| 16. Benkirane B, Jabri H, Elkhattabi W, Afif H. Particularités épidémiologiques et radioclinique du mésothéliome pleural malin (à propos de 43 cas). Rev Mal Respir. 2018;35: A208. |
| 17. Assie JB, Chouaid C, Andujar P, Blein C, Tournier C, Vainchtock A, et al. Prise en charge et coûts du mésothéliome pleural en France: analyse d’une cohorte nationale. Rev Mal Respir. 2017;34: A194. |
| 18. Helou J, Clément-Colmou K, Sylvestre A, Campion L, Amessis M, Zefkili S, et al. Tomothérapie hélicoïdale dans le traitement du mésothéliome pleural malin: impact des faibles doses sur la toxicité pulmonaire et øesophagienne. Cancer/Radiothérapie. 2013;17(8):755‑62. |
| 19. Maiouak S, Benjelloun H, Zaghba N, Yassine N. Mésothéliome pleural malin et exposition à l’amiante. Rev Mal Respir. 2016;33: A101‑2. |
| 20. Mahboub FZ, Elkhattabi W, Lhafiane I, Aichane A, Afif H. Particularités épidémiologique et radioclinique du mésothéliome pleural malin (à propos de 43 cas). Rev Mal Respir. 2015;32: A132‑3. |
| 21. Camille Munck, Etude rétrospective monocentrique d’une cohorte de patients porteurs d’un mésothéliome pleural malin traités de manière multimodale. Thèse pour le diplôme d'état de docteur en médecine université Lille 2 droit et sante faculté de médecine Henri warembourg 2015. |
| 22. Elatiqi K, Benjelloun H, Zaghba N, Bakhatar A, Yassine N, Bahlaoui A. Apport de la ponction biopsie pleurale dans le mésothéliome pleural malin. Rev Mal Respir. 2015;32: A112‑3. |
| 23. Delourme J, Dhalluin X, Cortot AB, Lafitte J-J, Scherpereel A. Prise en charge diagnostique et thérapeutique du mésothéliome pleural malin. Rev Pneumol Clin. 2013;69(1):26‑35. |
| 24. Najah L, Aidou S, Jabri H, El Khattabi W, Afif H. Mésothéliome pleural malin. Rev Mal Respir Actual. 2020;12(1):254. |
| 25. Scherpereel A, Astoul P, Baas P, Berghmans T, Clayson H, De Vuyst P, et al. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J. 2010;35(3):479‑95. |
| 26. Scherpereel A. La conférence d’experts de la Société de Pneumologie de Langue Française (SPLF) sur le mésothéliome pleural malin (MPM): des recommandations utiles et nécessaires. Elsevier Masson; 2006; 23(4): 5-6 |
| 27. Baas P, Scherpereel A, Nowak AK, Fujimoto N, Peters S, Tsao AS, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. The Lancet. 2021; 397(10272):375‑86. |
| 28. Opitz I, Scherpereel A, Berghmans T, Psallidas I, Glatzer M, Rigau D, et al. ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma. Eur J Cardiothorac Surg. 2020;58(1):1‑24. |
FIGURES - TABLES
REFERENCES
| 1. Mlika M, Lamzirbi O, Limam M, Mejri N, Ben Saad S, Chaouch N, et al. Le profil anatomoclinique du mésothéliome pleural malin : une étude rétrospective à propos de 30 cas. Rev Pneumol Clin. déc 2018;74(6):427‑35. |
| 2. Dr. Myriam Locatelli-Sanchez, Dr. Virginie Avrillon, Pr. Arnaud Scherpereel, Pr. Gérard Zalcman. Mésothéliome pleural malin 17 éme édition. Référentiels Auvergne Rhône-Alpes en oncologie thoracique 2022. |
| 3. Scherpereel A, Willemin M-C, Wasielewski E, Dhalluin X. Immunothérapie anti-tumorale dans le mésothéliome pleural malin. Rev Mal Respir. avr 2018;35(4):465‑76. |
| 4. Fournel L, Janet-Vendroux A, Canny-Hamelin E, Mansuet-Lupo A, Guinet C, Bobbio A, et al. Mésothéliome pleural malin : place de la chirurgie. Rev Pneumol Clin. oct 2018;74(5):351‑8. |
| 5. Rossini M, Rizzo P, Bononi I, Clementz A, Ferrari R, Martini F, et al. New perspectives on diagnosis and therapy of malignant pleural mesothelioma. Front Oncol. 2018;8:91. |
| 6. Dhalluin X, Chahine B, Copin M-C, Lafitte J-J, Scherpereel A. Diagnostic et bilan du mésothéliome pleural malin. Rev Mal Respir Actual. oct 2009;1(4):444‑51. |
| 7. Guinde J, Laroumagne S, Kaspi E, Martinez S, Tazi-Mezalek R, Astoul P, et al. Échoendoscopie bronchique pour le diagnostic de mésothéliome pleural malin. Rev Mal Respir. sept 2015;32(7):750‑4. |
| 8. Jaouen A, Thivolet-Bejui F, Chalabreysse L, Piaton E, Traverse-Glehen A, Isaac S, et al. Apport de l’expression protéique de BRCA1 associated protein 1 (BAP1) dans le diagnostic des mésothéliomes malins diffus pleuraux : une analyse cytologique et histologique comparative sur une série de 50 patients. Ann Pathol. avr 2016;36(2):111‑9. |
| 9. Greillier L, Scherpereel A, Zalcman G. Prise en charge diagnostique et thérapeutique du mésothéliome pleural malin en 2020. Rev Mal Respir Actual. oct 2020;12(2):2S141‑9. |
| 10. Scherpereel A. Traitement du mésothéliome pleural malin en 2016. Rev Mal Respir Actual. sept 2016;8(5):445‑56. |
| 11. Mery É, Hommell-Fontaine J, Capovilla M, Chevallier A, Bibeau F, Croce S, et al. Mésothéliome malin péritonéal : mise au point et données actuelles. Ann Pathol. févr 2014;34(1):26‑33. |
| 12. Abdelkrim MH. Prise en charge du mésothéliome pleural malin Expérience du service d’oncologie du CHU Hassan II de Fès (A propos de 8 cas) Thèse de Médecine. Maroc-2019. |
| 13. Brosseau S, Gounant V, Mordant P, Khalil A, Cazes A, Zalcman G. Prise en charge diagnostique et thérapeutique du mésothéliome pleural malin en 2018. Rev Mal Respir Actual. 2018;10(3):340‑8. |
| 14. Chouaid C, Tournier C, Luciani L, Le Lay K, De Léotoing L. Estimation de la prévalence et de l’incidence du mésothéliome pleural malin en France (PMSI-MCO 2016). Rev DÉpidémiologie Santé Publique. 2018;66: S223. |
| 15. Ziouziou I, Karmouni T, El Khader K, Koutani A, Andaloussi AIA. Mésothéliome paratesticulaire malin: cas clinique et revue de la littérature. Can Urol Assoc J. 2015;9(7‑8):E565. |
| 16. Benkirane B, Jabri H, Elkhattabi W, Afif H. Particularités épidémiologiques et radioclinique du mésothéliome pleural malin (à propos de 43 cas). Rev Mal Respir. 2018;35: A208. |
| 17. Assie JB, Chouaid C, Andujar P, Blein C, Tournier C, Vainchtock A, et al. Prise en charge et coûts du mésothéliome pleural en France: analyse d’une cohorte nationale. Rev Mal Respir. 2017;34: A194. |
| 18. Helou J, Clément-Colmou K, Sylvestre A, Campion L, Amessis M, Zefkili S, et al. Tomothérapie hélicoïdale dans le traitement du mésothéliome pleural malin: impact des faibles doses sur la toxicité pulmonaire et øesophagienne. Cancer/Radiothérapie. 2013;17(8):755‑62. |
| 19. Maiouak S, Benjelloun H, Zaghba N, Yassine N. Mésothéliome pleural malin et exposition à l’amiante. Rev Mal Respir. 2016;33: A101‑2. |
| 20. Mahboub FZ, Elkhattabi W, Lhafiane I, Aichane A, Afif H. Particularités épidémiologique et radioclinique du mésothéliome pleural malin (à propos de 43 cas). Rev Mal Respir. 2015;32: A132‑3. |
| 21. Camille Munck, Etude rétrospective monocentrique d’une cohorte de patients porteurs d’un mésothéliome pleural malin traités de manière multimodale. Thèse pour le diplôme d'état de docteur en médecine université Lille 2 droit et sante faculté de médecine Henri warembourg 2015. |
| 22. Elatiqi K, Benjelloun H, Zaghba N, Bakhatar A, Yassine N, Bahlaoui A. Apport de la ponction biopsie pleurale dans le mésothéliome pleural malin. Rev Mal Respir. 2015;32: A112‑3. |
| 23. Delourme J, Dhalluin X, Cortot AB, Lafitte J-J, Scherpereel A. Prise en charge diagnostique et thérapeutique du mésothéliome pleural malin. Rev Pneumol Clin. 2013;69(1):26‑35. |
| 24. Najah L, Aidou S, Jabri H, El Khattabi W, Afif H. Mésothéliome pleural malin. Rev Mal Respir Actual. 2020;12(1):254. |
| 25. Scherpereel A, Astoul P, Baas P, Berghmans T, Clayson H, De Vuyst P, et al. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J. 2010;35(3):479‑95. |
| 26. Scherpereel A. La conférence d’experts de la Société de Pneumologie de Langue Française (SPLF) sur le mésothéliome pleural malin (MPM): des recommandations utiles et nécessaires. Elsevier Masson; 2006; 23(4): 5-6 |
| 27. Baas P, Scherpereel A, Nowak AK, Fujimoto N, Peters S, Tsao AS, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. The Lancet. 2021; 397(10272):375‑86. |
| 28. Opitz I, Scherpereel A, Berghmans T, Psallidas I, Glatzer M, Rigau D, et al. ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma. Eur J Cardiothorac Surg. 2020;58(1):1‑24. |
ARTICLE INFO DOI: 10.12699/jfvpulm.16.50.2025.60
Conflict of Interest
Non
Date of manuscript receiving
10/06/2025
13/09/2025
Article citation
TH Diallo, D Touré, A Camara, BD Diallo,OH Diallo,AO Barry, MH Camara, M Tall,A B Diallo ,LM Camara. Diagnosis and Management of Malignant Pleural Mesothelioma at Bar-le-Duc Hospital, Meuse Department, French Republic (About 4 Cases). J Func Vent Pulm 2025;50(16):60-68